高铜对于肝细胞Wnt/β-catenin信号通路的影响☆
2017-03-06黄雅楠李海董健健程楠韩咏竹
黄雅楠李海董健健程楠韩咏竹○☆
Wilson病(Wilson’s disease,WD),是ATP7b基因突变[1],引起的铜代谢障碍[2]。并导致过量的铜在脏器中沉积,主要影响脑和肝脏[3],严重者可危及生命。Wnt/β-catenin这条信号通路不仅对调控肝脏的正常生理,如肝脏的再生以及代谢等而且也参与了各种肝脏的疾病,如肝癌,肝纤维化等[5],在正常情况下,Wnt信号通路对保护肝细胞的损伤有重要的作用,而过度激活的Wnt信号通路可能导致肝细胞纤维化。目前对Wnt/β-catenin信号通路的研究越来越多,对肝脏的康复有不可替代的作用,该条信号通路对肝脏来说是非常重要的。本研究拟探讨Wnt/β-catenin信号通路在高铜损伤肝细胞模型中的作用机制,在分子水平阐明Wnt/β-catenin信号通路在WD发病过程中的作用机制。
1 材料与方法
1.1 细胞培养将BRL-3A细胞(中国科学院上海细胞库)培养基为10%胎牛血清的1640(美国Gibco公司),放在37℃、5%CO2培养箱中培养,每2 d传代一次。
1.2 MTT法测不同剂量CuSO4作用不同时间点对BRL-3A细胞生长和增殖的影响。细胞以每孔1×104个接种于96孔板中,实验组分别加入Cu-SO4终浓度为25 μM、50 μM、100 μM、200 μM、400 μM、800 μM、1600 μM溶液,正常对照组加无FBS培养基,空白组加PBS,分别培养12 h、24 h、36 h、48 h后,每孔加MTT 20 μL,继续孵育4 h,弃培养液,每孔加150 μL的DMSO,摇床振荡,用酶标仪检测,计算平均半数抑制浓度(IC50)。
1.3 流式细胞仪测细胞内ROS和JC-1的变化。取对数生长期的BRL-3A细胞,收集细胞,PBS洗2遍,ROS检测分组为空白组,150 μM,300 μM,500 μM,600 μM,分别加入DA标记的H2DCF,培养箱孵育20 min且每5 min摇匀一次。JC-1检测分组为空白组,100 μM,200 μM,400 μM,500 μM加入JC-1荧光探针,放培养箱孵育15 min,过滤加入流式管,上机检测。
1.4 酶标仪检测MDA含量和T-SOD活性按照试剂盒要求配制所需试剂,并按照要求操作,取对数生长期的细胞,分组同1.3中ROS检测,每组分别加入所需试剂,混匀,95℃水浴40 min,后流水冷却,离心3500 rpm/min,10 min,吸上清加入比色皿,于波长532处检测。T-SOD检测室温放置10 min,于波长550 nm处,1 cm光径比色杯,双蒸水调零,测吸光度值。
1.5 Western Blot法检测Wnt/β-catenin通路相关蛋白的表达。取对数生长期的细胞,实验分组为空白组,150 μM,300 μM,600 μM,裂解细胞,提总蛋白,BCA测蛋白浓度。制胶,每孔上样10 μL,电泳,转膜(NC),用5%脱脂奶粉在恒温37℃摇床封闭2 h,磷酸盐吐温缓冲液(PBST)洗3次,每次10 min。分别加入含抗β-catenin抗体(ab6302)、抗Dishevelled 3抗体(ab92567)、抗GSK-3β抗体(ab107166)、抗p-Ser9-GSK-3β抗体(ab107166)、抗DKK1(ab93017)、抗p-(S33+S37)-β-catenin(ab53050)和抗c-Myc抗体(ab53050)的稀释液中,水平摇床放在4℃冰箱过夜。用PBST洗3次,孵二抗,常温2 h,PBST洗3次,每次10 min。以β-actin为总蛋白内参,以Lamin B1为核蛋白内参。凝胶成像系统拍照。
1.6 统计学方法采用SPSS 21.0进行统计学分析。连续型变量用x±s进行统计学描述。多组间平均数的比较采用的是单因素方差分析,检验水准α=0.05。
2 结果
2.1 MTT法实验结果CuSO4对BRL-3A细胞的损伤呈现一定的量效和时效关系。随着CuSO4作用剂量的增加及作用时间的延长,BRL-3A细胞存活率呈现明显的下降趋势。326 μM的CuSO4作用BRL-3A细胞24 h后,BRL-3A细胞的存活率最接近IC50(如图1)。
2.2 细胞ROS 150 μM、300 μM、600 μM的Cu-SO4作用BRL-3A细胞24 h后,荧光强度与正常组相比显著增强(P<0.01),表明高铜可使BRL-3A细胞内产生大量ROS(如图2)。
2.3 细胞MDA含量的影响150 μM、300 μM、600 μM的CuSO4作用BRL-3A细胞24 h后,与正常组相比MDA含量上升(P<0.05),显示高铜可使BRL-3A细胞内产生大量自由基(如图3)。

图1 不同剂量CuSO4作用于BRL-3A细胞不同时间(n=6)
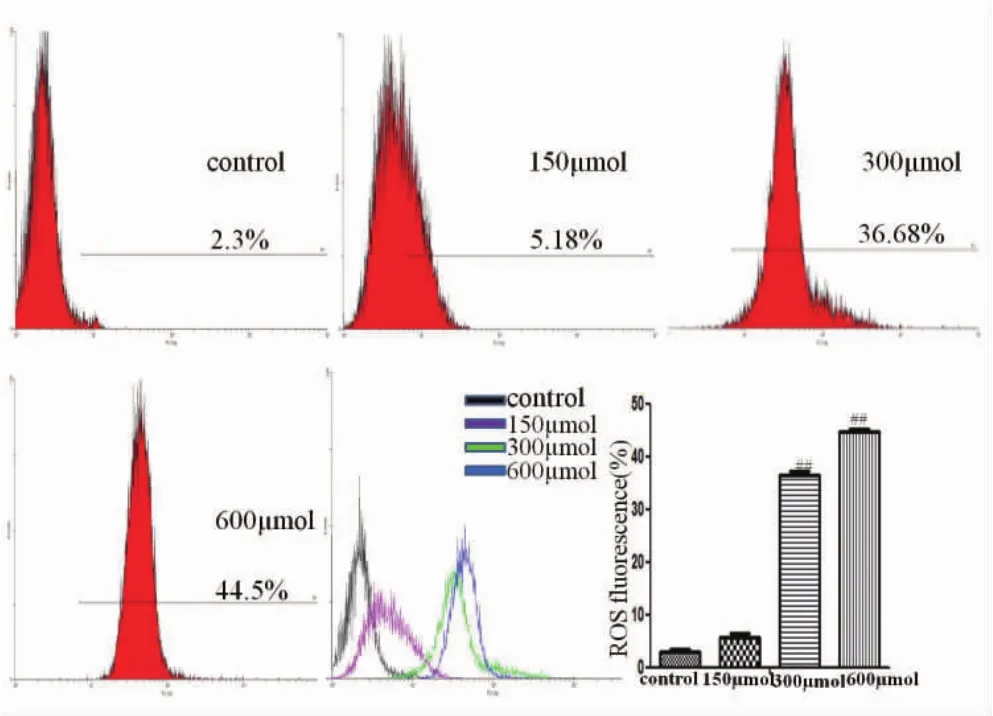
图2 不同浓度CuSO4对BRL-3A细胞ROS的影响(n=3)

图3 不同浓度CuSO4对BRL-3A细胞MDA含量的影响(n=3)
2.4 细胞SOD活性实验结果显示,150 μM、300 μM、600 μM CuSO4作用BRL-3A细胞24 h后,与正常组相比SOD活性降低(P<0.05),结果显示高铜可使BRL-3A细胞清除自由基能力下降(如图4)。
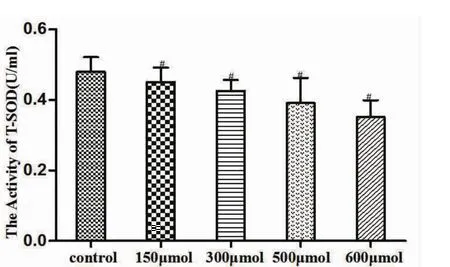
图4 不同浓度CuSO4对BRL-3A细胞SOD活性的影响(n=3)
2.5 细胞细胞线粒体膜电位实验结果显示,100 μM、200 μM、400 μM CuSO4作用BRL-3A细胞24 h后,JC-1的荧光强度与正常组相比显著降低(P<0.01),显示高铜可损伤BRL-3A细胞线粒体膜电位(如图5)。
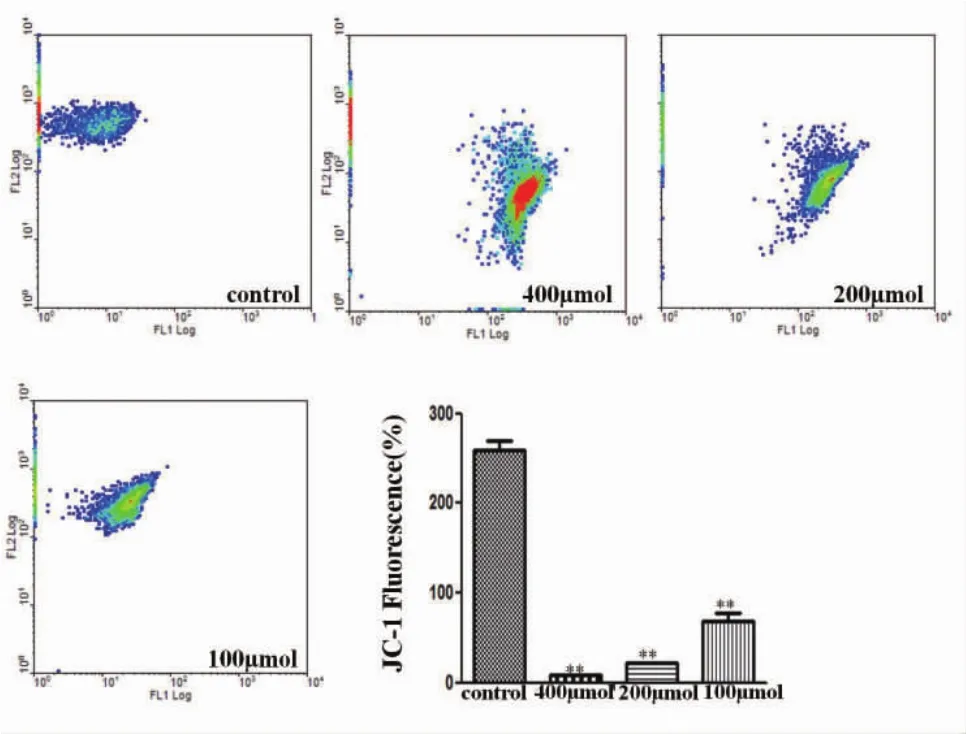
图5 不同浓度CuSO4对BRL-3A细胞细胞线粒体膜电位的影响(n=3)
2.6 Western blotting法检测Wnt信号通路相关蛋白的表达实验结果显示如下:CuSO4可显著降低BRL-3A细胞内总蛋白β-catenin、p-Ser 9-GSK-3β的表达(P<0.01),增加细胞内总蛋白GSK-3β、DKK1、Dishevelled3的表达,以及降低细胞核内蛋白p-(S33+S37)-β-catenin、c-Myc的表达(P<0.01)(如图6)。
3 讨论
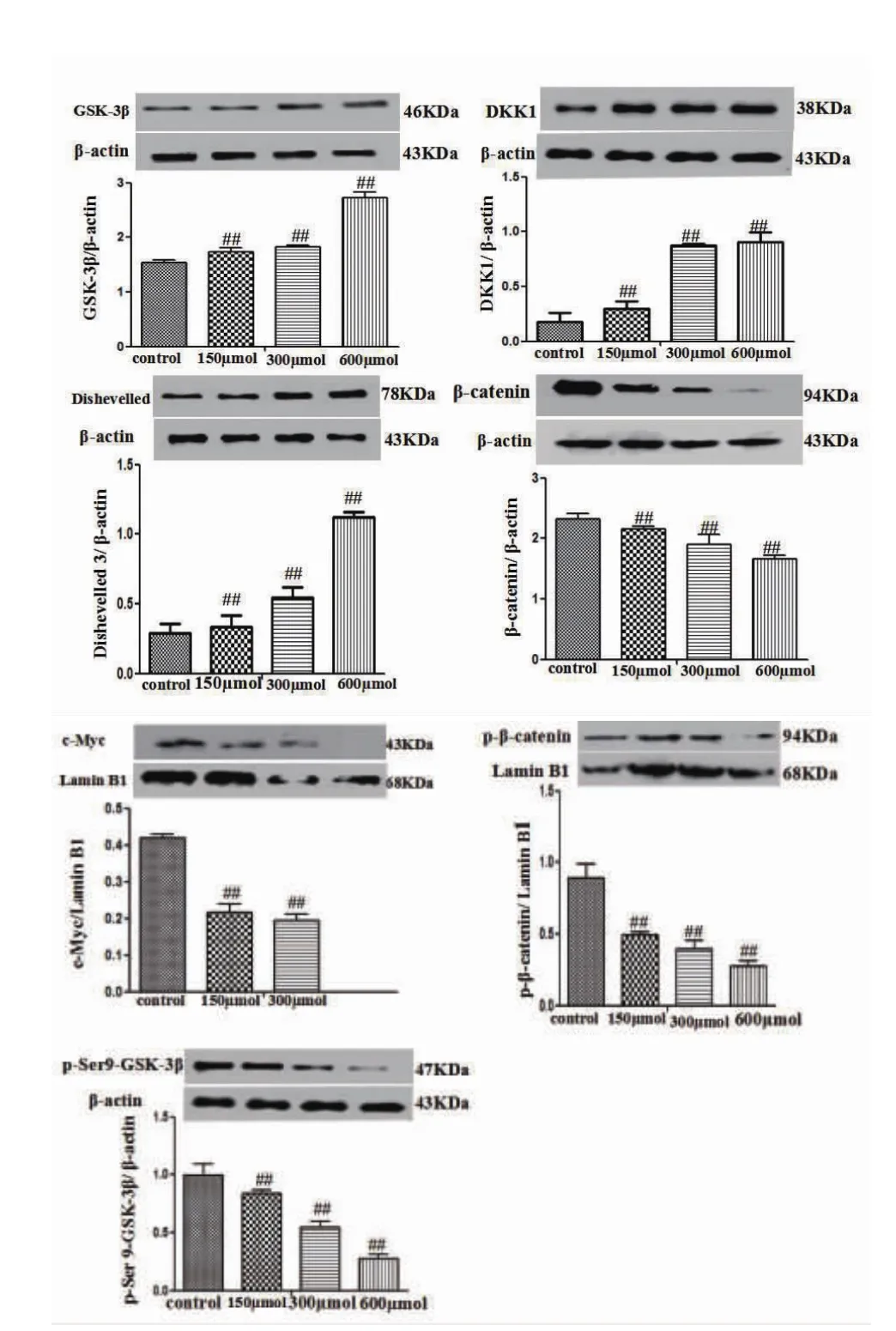
图6 不同浓度CuSO4对BRL-3A细胞内Wnt/β-catenin通路相关蛋白表达的影响(n=3)
Wnt/β-catenin信号通路在肝脏的生理病理方面都有着重要的作用。已知当Wnt信号通路受到抑制时,胞质中β-catenin可以跟轴蛋白、酪蛋白激酶1(casein kinase 1,CK1)和糖原合成激酶3(glycogensynthase kinase 3,GSK3)等物质组成为一种复合物,随后β-catenin进一步被GSK3和CK1磷酸化,磷酸化的β-catenin能够被E3泛素连接酶识别,识别以后降解磷酸化的β-catenin,使得磷酸化的β-catenin不能进入到细胞核内,或只有少量进入的细胞核内,从而不能进一步激活Wnt相关靶基因的表达[6],VIVEKKUMAR等[7]实验显示,在早期激活β-catenin可以增加肝脏的再生。本实验通过对Wnt/β-catenin信号通路上相关蛋白表达情况的检测显示,CuSO4可显著降低BRL-3A细胞内总蛋白β-catenin、c-Myc的表达,增加总蛋白GSK-3β、DKK1、Dishevelled3的表达,以及降低细胞核内p-(S33+S37)-β-catenin、c-Myc蛋白的表达,表明CuSO4可以抑制Wnt信号通路且CuSO4的浓度越高对Wnt信号通路抑制越明显。而WD的典型表现之一就是过量的铜在肝脏内聚集导致肝脏的损害,但是关于高铜是如何导致肝脏损害的研究较少,所以我们推测WD患者的肝损伤是不是由于高铜抑制了Wnt信号通路导致的。本实验的实验结果验证了之前的假设,高铜可以抑制Wnt信号通路,使得肝细胞不能代偿性再生,进一步加重了肝脏的损害。虽然我们知道了高铜可以抑制Wnt信号通路,但是高铜是通过什么抑制Wnt信号通路仍然不是很清楚。
本实验通过对细胞内ROS、JC-1、MDA、SOD的检测显示,铜的浓度越高细胞内ROS的生成越多,而SOD可以清除超氧阴离子自由基,保护细胞免受损伤,但是随着铜浓度的升高,细胞清除能力下降,进一步加重了细胞受到的氧化应激压力,细胞损伤的越严重,实验验证了高铜可诱导肝细胞内线粒体氧化应激,肝脏作为人体重要的器官,对人体的生命活动有着重要的作用,也是富含线粒体的器官,对ROS反应特别的敏感,容易受到影响,ROS也是多种肝脏疾病病理基础,在多种细胞因子的参与下,通过不同的途径可以导致不同程度的肝细胞的损伤以及多种肝脏疾病的产生。分泌性DKK1是Wnt的抑制剂,有实验显示,DKK1转染可以显著增加ROS水平[8]。还有实验显示,酒精能够诱ROS的产生,并且下调Wnt信号通路的活性[9],这些研究显示ROS与Wnt信号通路可能存在着某种密切的联系。本实验的实验结果显示,随着Cu-SO4浓度的增高,BRL-3A细胞内氧化应激水平越高,Wnt信号通路抑制越明显,我们推测是不是由于高铜导致BRL-3A细胞线粒体氧化应激,引起了Wnt通路失活,从而诱导和加重肝细胞损伤,这可能为治疗WD病导致的肝损伤,提供新的思路跟方向。但是到底是Wnt信号通路引起ROS的变化,还是ROS导致Wnt信号通路表达改变,现在仍然不是很清楚,有待于进一步的研究。
[1]BALKHI S,TROCELLO JM,POUPON J,et al.Relative exchangeable copper:a new highly sensitive and highly specific biomarker for Wilson's disease diagnosis[J].Clinica Chimica Acta,2011,412(23):2254-2260.
[2]WANG H,CHENG N,DONG J,et al.Serum pentraxin 3 is elevated in patients with neurological Wilson's disease[J].Clinica Chimica Acta,2016,462:178-182.
[3]LIN CW,ER TK,TSAI FJ,et al.Development of a high-resolution melting method for the screening of Wilson disease-related ATP7B gene mutations[J].Clinica Chimica Acta,2010,411(17):1223-1231.
[4]LOUDIANOS G,LEPORI MB,MAMELI E,et al.Wilson disease[J].Prilozi,2014,35(1):93–98.
[5]BEHARI J.The Wnt/β-catenin signaling pathway in liver biology and disease[J].Expert review of gastroenterology&hepatology,2010,4(6):745-756.
[6]MACDONALD BT,TAMAI K,HE X.Wnt/beta-catenin signaling:components,mechanisms,anddiseases[J].Developmental cell,2009,17(1):9-26.
[7]DADHANIA VP, BHUSHAN B, APTE U, et al. Wnt/β-Catenin Signaling Drives Thioacetamide -Mediated Heteroprotection Against Acetaminophen-Induced Lethal Liver Injury [J]. Dose- Response, 2017, 15(1): 1-13.
[8]PARK JW, KUEHN HS, KIM SY, et al. Downregulation of Wnt -mediated ROS generation is causally implicated in leprechaunism [J]. Molecules and cells, 2010, 29(1): 63-69.
[9]CHEN JR, LAZARENKO OP, SHANKAR K, et al. A role for ethanol -induced oxidative stress in controlling lineage commitment of mesenchymal stromal cells through inhibition of Wnt/β -catenin signaling [J]. Journal of Bone and Mineral Research, 2010, 25(5): 1117-1127.
