脑梗死后卒中相关性感染的危险因素☆
2017-03-06范秉林李吕力韦俊杰钟维章陈志李燕华
范秉林李吕力韦俊杰钟维章陈志李燕华
脑卒中相关性感染是脑卒中后常见的并发症,是当前的研究热点。卒中相关性感染为多因素导致[1],常见原因包括意识障碍、脑梗死面积、气管插管或切开、吞咽困难等。脑卒中后免疫抑制是近来提出的导致脑卒中后感染的一个重要原因。2012年CHAMORRO等[2]描述了脑卒中诱导的免疫抑制综合征(stroke-induced immunodepression syndrome,SIIS)的表现是淋巴细胞凋亡、减少及产生细胞因子减少,单核细胞失活及淋巴器官萎缩,自主神经系统过度激活及压力激素增加。不同的脑梗死部位和程度对卒中后感染是否产生影响,进一步明确脑梗死部位与卒中后感染的关系仍不清楚,皮质醇是应激状态下维持正常免疫功能的重要物质,对机体的免疫功能和炎症反应的调节起重要作用,IL-4是辅助性T细胞释放的细胞因子,与机体免疫功能的调节有密切相关,我们假设不同部位和程度的急性脑梗死,以及不同皮质醇、IL4水平之间对急性脑梗死患者感染具有明显的影响。
1 对象与方法
1.1 研究对象收集2014年1月至2015年6月在我院神经内科住院的急性脑梗死患者共283例,根据2014年中国缺血性脑卒中防治指南的诊断标准纳入[3],纳入标准:①发病在1周以内,经临床、头颅MRI证实急性脑梗死;②年龄≥18岁且<80岁;排除标准:①脑出血、蛛网膜下腔出血、静脉窦血栓形成;②入院时有感染征象;③最近24 h内曾经用或正在使用抗生素;④既往有皮质功能异常;⑤最近30 d内曾经使用过免疫抑制剂的患者。本研究经广西壮族自治区人民医院伦理委员会批准并与患者签署知情同意书。
根据是否感染分为2组:感染组、非感染组,从入院到出院进行全程观察,感染的诊断标准使用美国CDC修订标准[4]:肺炎的诊断至少符合第1项和后面的其他标准中的1项:①异常肺部呼吸音及呼吸困难,胸部X线检查课件肺部渗出性改变;②发热(>38.0℃)、咳嗽、咳痰、血培养及痰培养阳性,血白细胞>12000×109/L,或<4000×109/L,CRP升高。尿路感染的诊断至少符合以下两个或以上的条件:发热(>38.0℃),下尿路感染症状,尿培养阳性,明显的细菌性尿(>105集落单元),血白细胞>1200×109/L。其他感染:发热(>38.0℃)并且血白细胞>1200×109/L,没有明确感染部位的感染,并排除肺部感染及尿路感染。
1.2 研究方法一般资料收集:所有患者均在发病72 h内,血标本收集在患者入院后第1天和第7天进行皮质醇、IL-4测定。同时检测传统危险因素;使用NIHSS对卒中的严重程度进行评估。卒中病因根据TOAST分级标准进行[5],分为大动脉粥样硬化、心源性栓塞、小动脉闭塞、其他原因梗死及原因不明。
1.3 影像学检查所有患者均在入院时进行头颅CT检查排除脑出血,48 h内进行1.5T核磁共振(magnetic resonance imaging,MRI)检查,完善T1、T2、DWI、MRA系列检查。使用DWI对脑梗死部位及梗死面积进行评估,由两个经验丰富的神经放射专家进行测量,该两个专家均不了解患者的临床及实验室检查结果。梗死范围大小根据最大直径分为3组[6]:①小面积(D<1.5 cm);②中面积(1.5 cm<D<1/3MCA区或5 cm);③大面积(D>1/3 MCA区或>5.0 cm)。
1.4 统计学分析所有统计分析均使用统计软件SPSS 13.0版本进行,计量资料采用均数±标准差表示,采用t检验,计数资料采用率表示,相互比较采用卡方检验,分类变量使用Pearson检验或Fisher精确检验进行。偏态分布的连续变量使用Kolmogorov-Smirnov统计方法,正态分布连续变量使用t检验。Mann-Whitney U用于类比非参数检验。在比较梗死部位与感染率方面,Fisher精确检验同样用于确定OR值得重要意义。采用Logistic回归模型分析卒中相关性感染的危险因素。双侧检验,检验水准α=0.05。
2 结果
2.1 一般资料纳入符合标准的患者283例,与对照组相比,吸烟、机械通气、糖尿病、吞咽困难、COPD、意识水平、第1天皮质醇及IL-4升高、入院时平均NIHSS(IQR)、脑梗死面积中1.5cm<D<1/3MCA区或5cm,及D>1/3MCA区或>5.0 cm,TOST分型中大动脉粥样硬化及心源性、脑梗死部位中左侧大脑半球、双侧大脑半球、幕下脑梗死脑梗死后感染发生率明显升高,两组统计学具有差异(P<0.05)主要基线特征见表1。
2.2 脑梗死后感染的单因素分析从表2中可见,感染组和无感染组之间的31个因素中有15个因素两组差异有统计学意义,其中机械通气、吞咽困难、第1天皮质醇及IL-4、大面积脑梗死、大动脉粥样硬化及左侧大脑半球脑梗死差异更明显(P<0.001),吸烟、COPD、意识障碍、入院时平均NIHSS评分、中等面积脑梗死、心源性脑梗死、双侧大脑半球脑梗死及幕下脑梗死两组也有差异(P<0.05)。
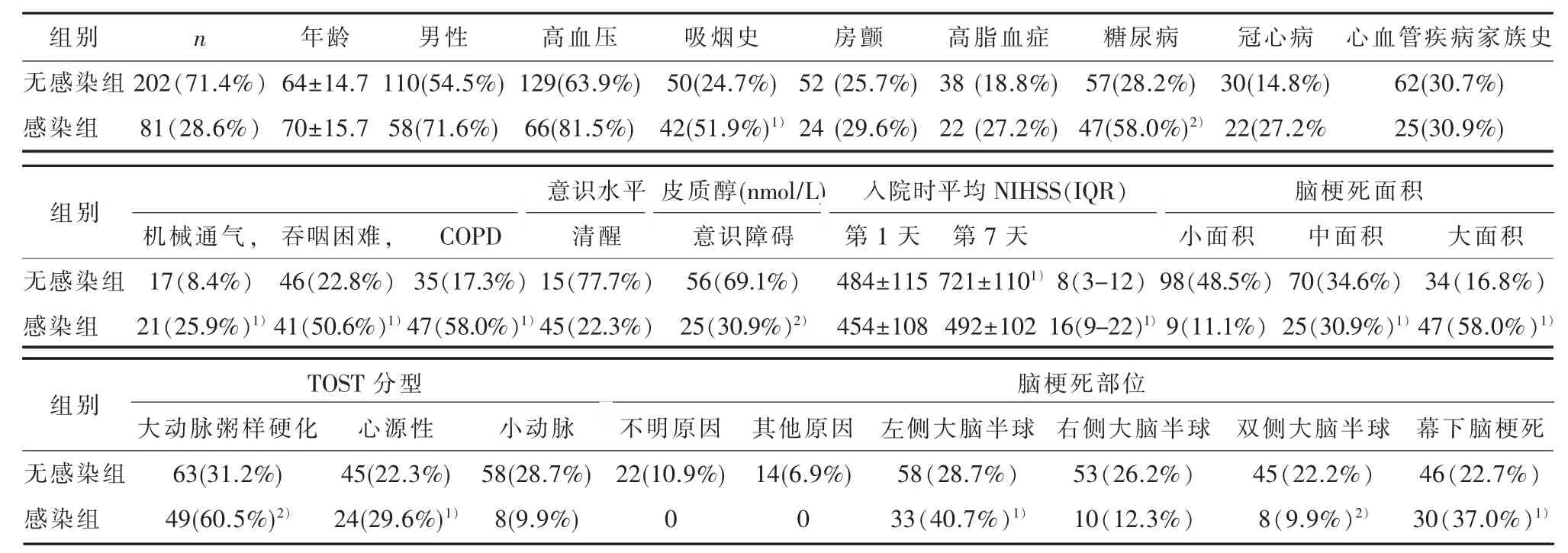
表1 脑卒中患者的主要特征
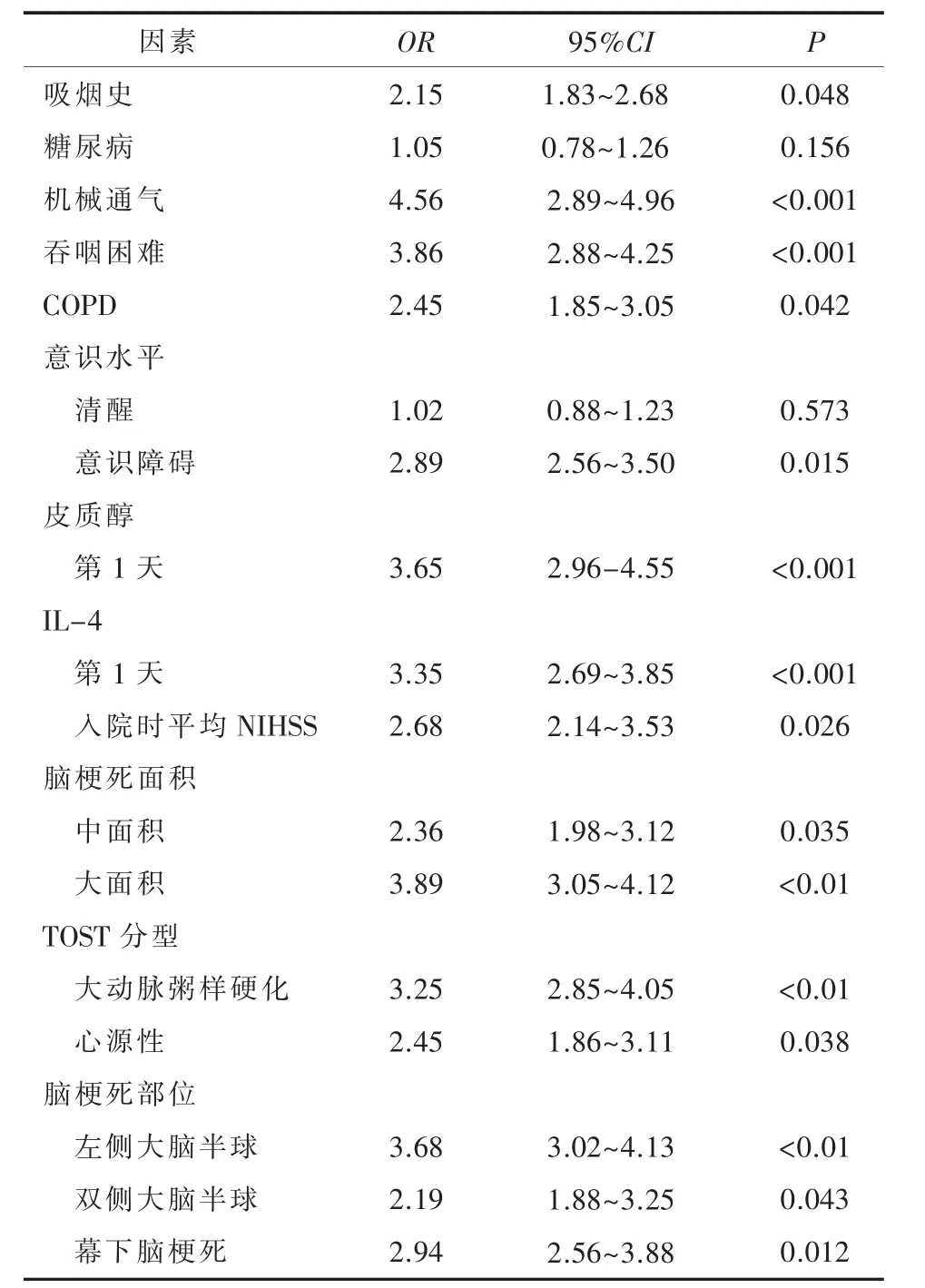
表2 脑梗死后感染的单因素分析
2.3 相关因素的Logistic回归分析(见表3),从表3发现,经过多因素相关分析去除混杂因素后发现,大面积脑梗死(D>1/3MCA区或>5.0 cm脑梗死)(OR=2.67,P=0.008)、COPD(OR=2.77,P=0.002)、入院第1天皮质醇升高(OR=3.26,P<0.001)、IL-4升高(OR=2.83,P=0.0015)、左侧大脑半球脑梗死(OR=3.78,P<0.001)及幕下脑梗死(OR=3.12,P=0.001)与卒中后感染显著相关(P<0.01);吸烟(OR=2.31,P=0.042)、机械通气(OR=2.62,P=0.038)、吞咽困难(OR=2.33,P=0.045)、意识障碍(OR=2.55,P=0.040)均与卒中后感染的发生具有显著相关性。
3 讨论
研究发现,脑部病变如脑外伤的严重程度是感染的主要预测因素之一,她主要与全身免疫抑制和高危感染有关,损伤程度越严重,感染阈值越低,同时与损伤的解剖区域相关[7],在本研究中发现:脑梗死面积对卒中后的感染具有重要影响,而中等面积以上脑梗死各种感染并发症发生率均显著升高(P<0.05),校正混杂因素后大面积脑梗死仍与卒中后感染显著相关,到目前为止,脑梗死面积的大小与卒中后感染的研究并不多[8-9]并且既往关于脑梗死面积的大小与卒中后感染的发生率并没有校正相关变量。因此,本研究结果更能反映出脑梗死面积是感染易感与否的独立危险因素。
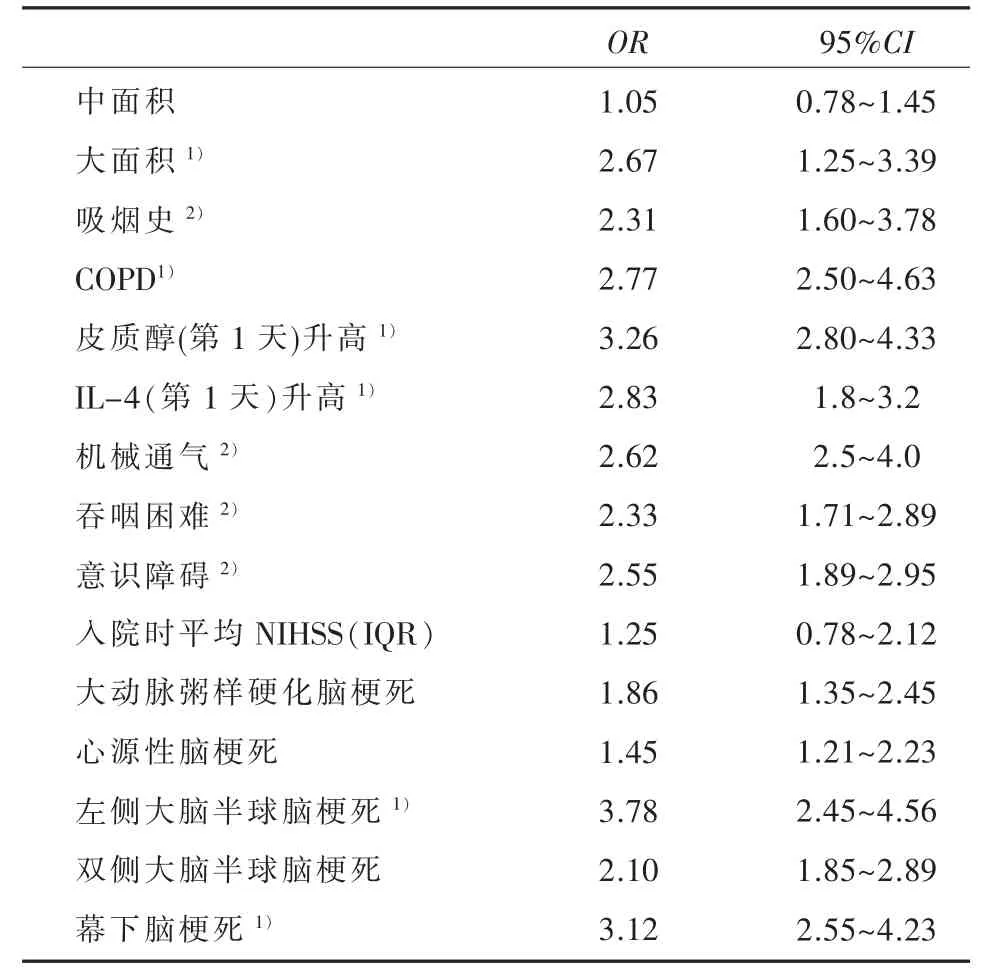
表3 脑梗死后感染相关影响因素的Logistic回归分析
研究发现某些脑区如前额皮质、丘脑、下丘脑、胼胝体、颞上回和小脑与循环自然杀伤细胞及全身多巴胺水平相关,导致全身免疫系统改变,当这些区域受到损害的时候可以引起显著的全身免疫改变以及增加感染风险[7,10-11]。然而,卒中后哪些脑区损伤可以导致或增加感染的易感性尚存在争议,动物实验及临床发现,SIIS主要与卒中严重程度相关[12]。一些研究发现控制自主神经系统为突出功能的左侧为主的脑岛受损的时候发生感染风险明显升高[10,13],然而,有学者发现大脑中动脉皮层支梗死与卒中相关感染有关,甚至与双侧大脑半球大脑中动脉皮层支梗死发生率相似[14],有几个研究甚至发现卒中的发生侧及区域与感染后相关并发症的出现没有关系[10]。本研究发现左侧大脑半球、双侧大脑半球及幕下脑梗死与卒中后感染升高有关,校正混杂因素后仍发现左侧左侧大脑半球脑梗死(OR 3.78,P<0.001)及幕下脑梗死(脑干及小脑,OR 3.12,P=0.001)卒中后感染仍然显著相关,其原因主要是考虑①左侧大脑前动脉供血区累及排尿中枢(旁中央小叶)引起反复尿失禁从而继发尿路感染;②左侧大脑半球是优势大脑半球,当出现损害时容易出现更明显执行功能及言语功能下降,而双侧大脑半球脑梗死病因为心源性梗死多见,病灶小,同时病例数少也是一个原因之一;③脑干梗死多有吞咽困难,大部分患者需要鼻饲饮食,但是唾液吞咽困难导致吸入进入气道是一个最重要因素。最近一个研究发现[7],脑回结构如岛叶及旁中央小叶梗死容易出现肺炎,与本研究结果相符,更加细化研究需要功能磁共振或者其他功能影像学检查进一步证实。
所谓的卒中或中枢神经系统损伤诱导的免疫抑制(CNS-injury-induced immunosuppression,CIDS)的发病机理仍未完全清楚,目前推测是卒中激活交感神经系统(sympathetic nervous system,SNS)及下丘脑垂体肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)通过儿茶酚胺和皮质类固醇终产物。SNS和HPA轴激活通过缺血组织释放细胞因子产生作用,主要应用的免疫抑制标志物包括CD4细胞计数、人白细胞抗原(Leukocyte Antigen-DR,HLA-DR)、皮质醇、去甲肾上腺素、IL-4等,其中皮质醇及IL-4是比较常用于代表免疫抑制标志物。本研究中发现入院时皮质醇升高、IL-4升高与卒中后感染具有显著相关,虽然有部分患者可能存在应激因素,但是大部分患者均为发病24小时以后入院,减少应激因素,提示皮质醇及IL-4升高可以诱发感染,脑缺血损伤交感神经系统和下丘脑垂体肾上腺轴所在脑区会激发自主神经系统失抑制,导致免疫反应下调,并影响其预后。
由于卒中后感染的影响因素非常多,不可能包括所有因素,本文只将其中的部分因素做了分析,重点观察免疫相关因子及脑梗死部位及严重程度对感染的影响,有些因素并没有列入(如慢阻肺病史),可能对结果有一些影响,这是本文的不足之处。
总之,通过本研究发现,脑卒中后感染除了与疾病严重程度及一些常见因素有关以外,还与梗死部位及免疫抑制相关因子的水平有关,为进一步细化梗死部位及免疫抑制的相关性提供研究基础,同时为临床感染的预防提供客观依据。
[1]PRASS K,BRAUN JS,DIRNAGL U,et al.Stroke propagates bacterial aspiration to pneumonia in a model of cerebral ischemia[J].Stroke,2006,37(10):2607-2612.
[2]CHAMORRO Á,MEISEL A,PLANAS AM,et al.The immunology of acute stroke[J].Nat.Rev.Neurol,2012,8(7):401-410.
[3]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2 0 1 4[J].中华神经科杂志,2015,48(04):246-255.
[4]HARMS H,PRASS K,MEISEL C,et al.Preventive antibacterial therapy in acute ischemic stroke:a randomized controlled trial[J].PLoS One,2008,3(5):e2158.
[5]VARGAS M,HORCAJADA JP,OBACH V,et al.Clinical consequences of infection in patients with acute stroke:is it prime time for further antibiotic trials?[J].Stroke,2006,37(2):461-465.
[6]MINNERUP J,WERSCHING H,BROKINKEL B,et al.The impact of lesion location and lesion size on poststroke infection frequency[J].J Neurol Neurosurg Psychiatry,2010,81(2):198-202.
[7]URRA X,LAREDO C,ZHAO Y,et al.Neuroanatomical correlates of stroke-associated infection and stroke-induced immunodepression[J].Brain Behav Immun,2017,60(1):142-150.
[8]HILKER R,POETTER C,FINDEISEN N,et al.Nosocomial pneumonia after acute stroke:implications for neurological intensive care medicine[J].Stroke,2003,34(4):975-981.
[9]WALTER U,KNOBLICH R,STEINHAGEN V,et al.Predictors of pneumonia in acute stroke patients admitted to a neurological intensive care unit[J].J Neurol,2007,254(10):1323-1329.
[10]KEMMLING A,LEV MH,PAYABVASH S,et al.Hospital acquired pneumonia is linked to right hemispheric peri-insular stroke[J].PLoS One,2013,8(8):e71141.
[11]WALTER U,KOLBASKE S,PATEJDL R,et al.Insular stroke is associated with acute sympathetic hyperactivation and immunodepression[J].Eur.J.Neurol,2013,20(1):153-159.
[12]URRA X,CHAMORRO A.Stroke-induced immunodepression is a marker of severe brain damage[J].Stroke,2010,41(2):e110.
[13]FRISINA PG1,KUTLIK AM,BARRETT AM.Left-sided brain injury associated with more hospital-acquired infections during inpatient rehabilitation[J].Arch Phys Med Rehabil,2013,94(3):516-521.
[14]MIRMAN D,CHEN Q,ZHANG Y,et al.Neural organization of spoken language revealed by lesion-symptom mapping[J].Nat.Commun,2015,6(1):6762.
