转录因子E2F3在胃癌组织中的表达及其预后价值*
2017-03-04吕西香王晓燕姜晓玲
李 伟,吕西香,王晓燕,姜晓玲,周 林
转录因子E2F3在胃癌组织中的表达及其预后价值*
李 伟,吕西香,王晓燕,姜晓玲,周 林*
目的 探讨转录因子E2F3在胃癌组织中的表达及其预后价值。方法采用免疫组织化学法检测82例胃癌组织和胃旁组织中E2F3的表达情况,统计分析其表达与临床病理特征及预后的关系。结果胃癌组织中E2F3阳性表达率为65.8%,和癌旁正常胃黏膜组织阳性率(23.2%)比较,差异有统计学意义,P<0.001。E2F3表达与分化程度(P<0.01)、TNM分期(P<0.05)、淋巴结转移(P<0.05)密切相关,而与性别(P=0.131)、年龄(P=0.358)、肿瘤大小(P=0.728)、浸润深度(P=0.367)和其他器官转移(P=0.348)无关。生存期分析提示,E2F3表达阳性患者,相比于阴性表达的,其生存期更短,P<0.01。结论转录因子E2F3与胃癌的发生发展密切相关,其表达与胃癌患者预后紧密相关,具有重要临床意义。
胃癌;E2F3;免疫组织化学;预后
胃癌的发病率在肿瘤中居第四位,病死率居第二位,在包括我国在内的发展中国家尤为严重[1]。研究胃癌发生发展的机制并寻找关键性调控分子对胃癌的诊断、治疗以及预后具有重要作用。E2F转录因子3(E2F transcription factor 3,E2F3)是转录因子E2F家族的重要一员,调控细胞周期的进程,已被证实在多种肿瘤中高表达并促进肿瘤细胞增殖[2-6]。然而,E2F3在胃癌中的表达及功能仍不清楚。该研究通过免疫组织化学检测82例胃癌组织和癌旁组织中E2F3的表达,分析其与胃癌临床病理特征的关系,并探讨其潜在预后价值。
1 资料与方法
1.1 一般资料收集解放军第八十八医院普外科2006年1月1日—2009年12月31日手术切除的人类胃癌82例,癌旁组织选取距癌灶边缘5 cm以上的正常胃组织。所有标本均经病理确诊。所有患者术前均未接受过放疗和化疗。82例胃癌患者中男53例,女29例;年龄35~85岁,中位年龄64岁。高分化和中分化腺癌44例,低分化和未分化腺癌38例。有淋巴结转移62例,无淋巴结转移20例。Ⅰ~Ⅱ期25例,Ⅲ~Ⅳ期57例。
1.2 试剂一抗为兔抗人E2F3购于Abcam公司,采用1∶100的比例稀释。二抗为过氧化物酶标记的链霉卵白素(SP)染色试剂盒和浓缩型二甲基联苯胺(DAB),购自上海生工生物工程有限公司。
1.3 方法采用SP免疫组织化学法,以PBS液代替一抗做阴性对照,以试剂公司提供的阳性照片做阳性对照。
1.4 结果判定标准免疫组化染色评分主要依据染色阳性细胞百分比。结果由两位病理科医师在不知患者临床资料的情况下打分。染色阳性细胞百分比判定:0%、1%~10%、11%~50%、51%~75%和75%以上的细胞为阳性,分别被评分为0、1、2、3和4分,0和1分判定为阴性,2、3和4分判定为阳性。
1.5 随访随访时间自术后第1天,末次随访或死亡时间以月为计量单位,随访至2015年6月,随访时间最长106个月,最短2个月,无失访,随访方式为电话问询,每3个月随访1次。
1.6 统计学方法使用SPSS 19.0统计分析软件。应用卡方检验分析E2F3蛋白在胃癌组织和癌旁组织中的表达差异以及E2F3的表达强度与临床病理学特征间的关系;应用Kaplan-Meier方法进行生存线的描绘;生存曲线差异性应用Log-rank试验进行评估。P<0.05为差异有统计学意义。
2 结果
2.1 E2F3在胃癌组织和癌旁组织中的表达利用免疫组织化学染色方法检测E2F3在82例胃癌及癌旁组织中的表达,结果发现E2F3主要定位于胞核中,在胞质中也有一定表达,在胃癌组织中阳性率达65.8%,而在癌旁组织中仅为23.2%,有统计学差异(P<0.001)。图1和表1所示,胃癌组织中E2F3表达相对于癌旁组织明显升高。

图1 E2F3在胃癌组织和癌旁组织中表达情况(SP×400)
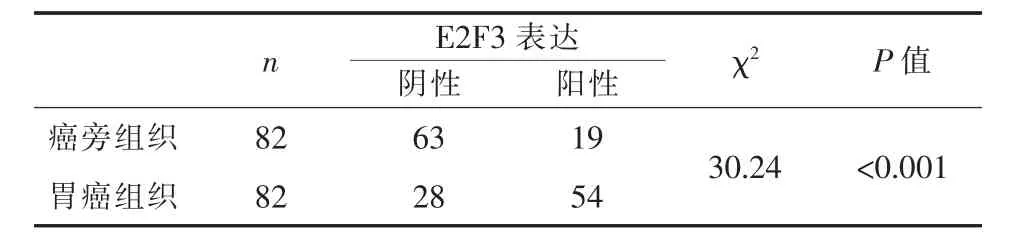
表1 E2F3在胃癌和癌旁组织中的表达情况
2.2 E2F3表达与胃癌临床病理特征的关系为了明确E2F3在胃癌中的生物学功能以及其潜在临床价值,该研究免疫组化结果和临床相关资料结合起来分析E2F3表达水平与胃癌临床病理学特征之间的关系。利用相应的统计方法计算E2F3在82例胃癌组织的表达水平与各个临床特征之间的关系,结果发现,E2F3表达水平与分化程度 (P<0.01)、TNM分期(P<0.05)、淋巴结转移(P<0.05)密切相关,而与性别 (P=0.131)、年龄 (P=0.358)、肿瘤大小 (P= 0.728)、浸润深度(P=0.367)和其他器官转移(P= 0.348)无关(表2)。
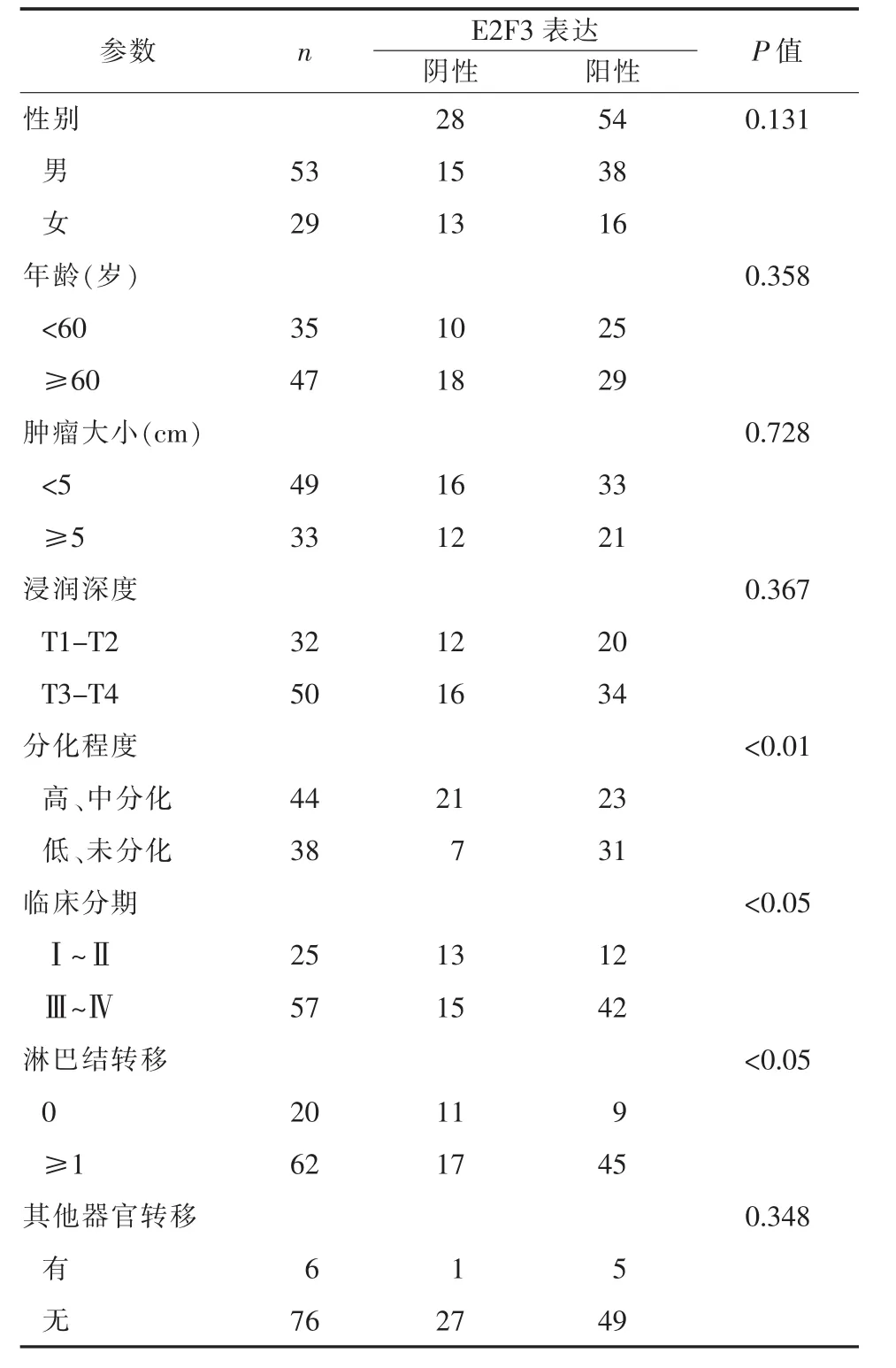
表2 胃癌中E2F3表达情况与临床病理特征关系
2.3 胃癌组织中E2F3的表达与预后的关系为进一步了解E2F3在胃癌中的临床价值,该研究对82例患者进行生存期分析,利用Kaplan-Meier分析发现E2F3表达阳性患者的生存期明显较阴性表达者短,预后更差,P<0.01(图2)。
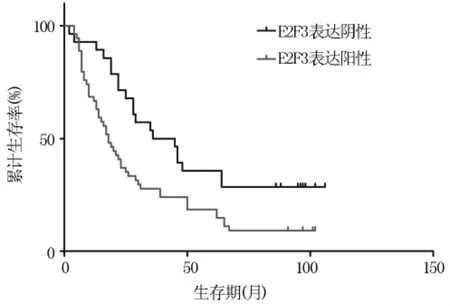
图2 E2F3表达与胃癌患者生存期之间关系
3 讨论
E2F家族转录因子控制细胞周期进程,包括E2F1、E2F2、E2F3、E2F4、E2F5、E2F6、E2F7和E2F8八个成员,其中E2F1-E2F3是转录活化因子,而E2F4-E2F8是转录抑制因子。E2F3作为E2F家族中重要一员,定位于染色体6p22.3,全长91.5kb,编码产物为E2F3蛋白,分为E2F3a和E2F3b两个亚基。正常情况下,E2F3与细胞周期蛋白D1形成二聚体,参与细胞周期的调控,是细胞周期进程的强力转录诱导因子[7]。近期研究表明,E2F3参与肿瘤的发生发展,在包括膀胱癌、前列腺癌、喉癌和乳腺癌等多种肿瘤中表达增高。多项研究的结果表明,膀胱癌中E2F3的高表达和扩增与肿瘤的分期、分级、增殖和侵袭密切相关,并且6p22.3扩增子是膀胱癌侵袭性的分子标志物[2-4]。Lee等指出E2F3表达沉默通过减少进行有丝分裂细胞的百分比来降低乳腺癌的增殖与生长[5,6]。最近研究表明,多种microRNA,包括miR-203、miR-432、miR-200b和miR-377,靶向作用于E2F3参与肿瘤的生长和侵袭进程[8-11]。以上研究均表明E2F3在肿瘤的发生发展中发挥着重要作用。然而,目前E2F3在胃癌中的功能和机制尚不清楚。
为了明确E2F3在胃癌中的生物学功能和其临床价值,该研究首先利用免疫组织化学染色检测E2F3在胃癌以及癌旁组织中的表达情况。笔者发现E2F3在胃癌组织中阳性表达明显增高,其表达与分化程度、TNM 分期和淋巴结转移密切相关,而与性别、年龄、肿瘤大小、浸润深度和其他器官转移无关;生存期分析结果提示E2F3阳性表达的生存期越短,其预后更差。该研究结果与E2F3在其他肿瘤中的发现非常相似,表明E2F3的高表达与胃癌的发生发展密切相关,其表达强度可以作为胃癌患者预后的重要指标。
E2F3主要通过p16Ink4a-Rb-E2F3和Arf-mdm2-p53两条信号通路参与肿瘤的发生发展。肿瘤抑癌基因视网膜母细胞瘤Rb蛋白的磷酸化直接调控E2F3的活性。当Rb蛋白去除磷酸化时,E2F3表达失活,从而导致细胞周期停滞于G1/S期;当Rb蛋白磷酸化时,E2F3被释放而活化,使细胞周期顺利通过G1/S期,促进细胞增殖[2,12-14]。因此pRb/E2F3互相调控是肿瘤发生发展的重要通路。E2F3是Arf-mdm2-p53通路的抑制因子,在E2F3缺失时Arf阻遏解除,p53的活性得到增强而启动一系列抑癌通路;而当E2F3表达增加时,p53抑癌途径失调,最终促进肿瘤的生成和进展[14,15]。E2F3是否通过这两条信号通路参与胃癌的调控,仍需进一步研究来探明。
综上所述,E2F3表达与胃癌的发生发展密切相关,可以作为胃癌患者预后的重要指标,具有重要临床意义,但其具体作用机制还有待于进一步研究。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics[J].CA Cancer J Clin,2016,66(1):7-30.
[2]Hurst CD,Tomlinson DC,Williams SV,et al.Inactivation of the Rb pathway and overexpression of both isoforms of E2F3 are obligate events in bladder tumours with 6p22 amplification[J]. Oncogene,2008,27(24):2716-2727.
[3]Shen H,Morrison CD,Zhang J,et al.6p22.3 amplification as a biomarker and potential therapeutic target of advanced stage bladder cancer[J].Oncotarget,2013,4(20):2124-2134.
[4]Olsson AY,Feber A,Edwards S,et al.Role of E2F3 expression in modulating cellular proliferation rate in human bladder and prostate cancer cells[J].Oncogene,2007,26(10):1028-1037.
[5]Lee M,Oprea-Ilies G,Saavedra HI.Silencing of E2F3 suppresses tumor growth of Her2+breast cancer cells by restricting mitosis[J].Oncotarget,2015,6(24):37316-37334.
[6]Lee MY,Moreno CS,Saavedra HI.E2F activators signal and maintain centrosome amplification in breast cancer cells[J]. Mol Cell Biol,2014,34(21):2581-2599.
[7]Wong JV,Dong P,Nevins JR,et al.Network calisthenics:control of E2F dynamics in cell cycle entry[J].Cell Cycle,2011,10(25):3086-3094.
[8]Zehavi L,Schayek H,Jacob-Hirsch J,et al.MiR-377 targets E2F3 and alters the NF-kB signaling pathway through MAP3K7 in malignant melanoma[J].Mol Cancer,2015,14(1):68.
[9]Chen L,Kong G,Zhang C,et al.MicroRNA-432 functions as a tumor suppressor gene through targeting E2F3 and AXL in lung adenocarcinoma[J].Oncotarget,2016,7(15):20041-20053.
[10]Noguchi S,Mori T,Otsuka Y,et al.Anti-oncogenic microRNA-203 induces senescence by targeting E2F3 protein in human melanoma cells[J].J Biol Chem,2012,287:11769-11777.
[11]Gao Y,Chen L,Song H,et al.A double-negative feedback loop between E2F3b and miR-200b regulates docetaxel chemosensitivity of human lung adenocarcinoma cells[J].Oncotarget,2016,7(19):27613-27626.
[12]Johnson J,Thijssen B,McDermott U,et al.Targeting the RBE2F pathway in breast cancer[J].Oncogene,2016,35(37):4829-4835.
[13]Schaal C,Pillai S,Chellappan SP.The Rb-E2F transcriptional regulatory pathway in tumor angiogenesis and metastasis[J]. Adv Cancer Res,2014,121(12):147-182.
[14]Polager S,Ginsberg D.p53 and E2f:partners in life and death[J].Nat Rev Cancer,2009,9(7):738-748.
[15]Ginsberg D.E2F3-a novel repressor of the ARF/p53 pathway[J].Dev Cell,2004,6(7):742-743.
[2016-08-21收稿,2016-09-19修回]
[本文编辑:吴 蓉]
Expression of transcription factor E2F3 in gastric cancer tissues,and its prognostic value
LI Wei①,LV Xi-xiang,WANG Xiao-yan,et al.Department of Gastroenterology,the 88th Hospital of PLA,Tai'an,Shandong 271000,China
ObjectiveTo determine the expression and prognostic value of transcription factor E2F3 in gastric cancer tissues.MethodsE2F3 expression in 82 paired of gastric carcinoma tissues and adjacent nontumor tissues were detected by immunohistochemical method,and the relationship between E2F3 expression and clinicopathological factors as well as prognosis were analyzed.ResultsPositive expression of E2F3 was detectable in 65.8%of gastric carcinoma tissues and there was significant difference,compared with positive rate in adjacent non-tumor tissues(23.2%,P<0.001).Expression of E2F3 was correlated with differentiation(P<0.01),TNM staging(P<0.05),and lymph node metastases(P<0.05),but not with patient gender(P=0.131),age(P=0.358),tumor size(P= 0.728),invasion depth(P=0.367),and metastasis to other organs(P=0.348).Survival analysis showed that the patients with positive expression of E2F3 had shorter overall survival,compared with negative expression(P<0.01).Conclusion E2F3 is strongly related with gastric cancer development& aggression and could be a great predictor for gastric cancer prognosis.
Gastric cancer;E2F3;Immunohistochemistry;Prognosis
R735.2
A
10.14172/j.issn1671-4008.2017.02.004
国家自然科学基金(81402337)
271000山东泰安,解放军88医院消化内科(李伟,吕西香,周林),病理科(王晓燕,姜晓玲)
周林,Email:zhoulin1105@163.com
