金雀异黄素对脂多糖诱导人肺泡上皮细胞A549炎症及凋亡的影响
2017-03-03王玲刘辉国
王玲,刘辉国
1.武汉大学医院,湖北 武汉 430071;2.华中科技大学同济医学院附属同济医院,湖北 武汉 430030
金雀异黄素对脂多糖诱导人肺泡上皮细胞A549炎症及凋亡的影响
王玲1,刘辉国2
1.武汉大学医院,湖北 武汉 430071;2.华中科技大学同济医学院附属同济医院,湖北 武汉 430030
目的观察金雀异黄素对脂多糖(LPS)诱导人肺泡上皮细胞A549发生炎症与凋亡的影响,探讨其改善肺损伤的作用机制。方法CCK-8法检测不同浓度金雀异黄素和/或LPS干预细胞12 h后的活力;RT-PCR检测金雀异黄素对LPS诱导的炎性因子白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)的表达;TUNEL法检测细胞凋亡;Western blot检测信号通路的变化。结果金雀异黄素(1、5、10 μmol/L)对细胞活力无明显影响,LPS(1 μg/mL)可显著降低细胞活力,而金雀异黄素与LPS共同干预则细胞活力呈浓度依赖性升高;RT-PCR结果显示,LPS可显著提高炎性因子的基因表达,而金雀异黄素则可呈浓度依赖和时间依赖抑制其表达;TUNEL染色结果显示,金雀异黄素(10 μmol/L)与LPS联合干预12 h可显著减少LPS诱导的细胞凋亡;Western blot结果显示,金雀异黄素(10 μmol/L)与LPS(1 μg/mL)协同刺激A549细胞30 min可显著抑制LPS诱导的IκBα、p65信号通路的磷酸化水平。结论金雀异黄素可抑制LPS诱导的人肺泡上皮细胞发生炎症和凋亡,从而发挥保护作用。
金雀异黄素;急性肺损伤;A549细胞;炎症;细胞凋亡
急性肺损伤(acute lung injury,ALI)的死亡率较高,其主要特点为中性粒细胞的聚集、间质水肿、肺泡上皮细胞完整性破坏及大量炎性因子的产生[1]。虽然近些年来对ALI的发病机制研究已经有了长足进步,但目前的治疗并未降低ALI患者死亡率及增加幸存者生活质量[2]。脂多糖(LPS)为革兰阴性细菌细胞壁的组成成分,可诱导炎性反应继而导致免疫功能障碍[3]。LPS气管内给药可造成严重肺损伤模型,近年来已经成为共识[4]。因此,我们采用LPS体外干预肺泡上皮细胞模拟肺损伤模型。核因子-κB(NF-κB)在调控炎症反应过程中发挥关键作用[5]。多项研究表明,NF-κB信号通路在肺部损伤疾病中发挥重要调控作用,其诱导的细胞因子如白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)在ALI的发病过程中发挥关键作用[6]。
金雀异黄素(genistein,GEN)是一种存在于豆科植物和齿状植物中的天然异黄酮化合物,研究表明,其具有抗癌、抗炎、抗氧化等作用[7-8],但其是否影响ALI中肺泡上皮细胞的炎性反应尚未见报道。本实验观察GEN对肺泡Ⅱ型上皮细胞在LPS诱导下发生上皮损伤的影响,探讨其改善ALI的作用机制。
1 实验材料
1.1 药物及制备
GEN,上海融禾医药科技发展有限公司,货号446-72-0,纯度>98%。取2.7 mgGEN溶于1 mL二甲基亚砜(DMSO)中配制实验所用的母液。
1.2 细胞
A549人肺泡Ⅱ型上皮细胞株,中国科学院上海细胞库,细胞培养和干预刺激均在独立的细胞房中进行,置于37 ℃、5%CO2培养箱中培养,待细胞生长达次融合状态时0.25%胰蛋白酶消化,根据实验需要接种于不同的培养皿中。分组诱导前以无血清培养基饥饿24 h,以减少血清对刺激因素的影响。
1.3 主要试剂与仪器
高糖DMEM basic(1×)培养基、新生小牛血清(New born serum,NBS)、胰酶,Gibco公司;CCK-8试剂盒,日本同仁化学研究所;LPS,Sigma公司;RT-PCR试剂盒,Roche公司;p-IκBα、p-p65、IκBα、p65、GAPDH(Rabbit IgG),Cell Signaling Technology公司。多功能微孔板检测系统Synergy HT(美国BioTek公司),紫外分光光度计NANODROP 2000c(Thermo scientific),实时定量PCR仪Light Lycler 480(Roche公司),RT反转录仪Veriti 96 well Thermal Lycler(Applied Biosystems公司),倒置相差显微镜(日本OLYMPUS),恒温培养箱(日本SANYO公司)。
2 实验方法
2.1 细胞处理和分组
待A549细胞贴壁生长密度达80%时,弃去培养基,PBS清洗,加入饥饿液,置于温箱8 h后置换为含有LPS(1 μg/mL)的饥饿液,重新置于温箱中培养,收取蛋白质和RNA样本。实验分为对照组、LPS组、LPS+GEN 1 μmol/L组、LPS+GEN 5 μmol/L组、LPS+GEN 10 μmol/L组和GEN 10 μmol/L组。
2.2 CCK-8法检测细胞活力
细胞被接种至96孔板,每孔100 μL,密度大约为2×105个/mL,置于温箱继续培养24 h,将培养基更换为无血清的培养基饥饿24 h,采用不同处理因素干预72 h后,将96孔板中培养基换为含10 μL CCK-8的无血清培养基100 μL,温箱中孵育2~2.5 h后于酶标仪波长450 nm处进行测定。
2.3 Western blot检测信号通路磷酸化水平
冰上裂解细胞10 min,置于1.5 mL离心管中,超声裂解仪5 kHz裂解10~15 s,4 ℃、12 000 r/min离心15 min,上清液移至离心管中,BCA定量检测蛋白浓度并将蛋白浓度调整一致后置于煮沸仪上将其变性。每组样本混匀后取10 μL行10%SDS-PAGE凝胶电泳,检测内参指标GAPDH,根据各样本的光密度值调整上样剂量,使其与GAPDH的光密度值保持一致,后每组以校正后的上样剂量进行凝胶电泳,将蛋白以100 V、90 min移至PVDF膜上,用一抗封闭液封闭12 h,一抗包括p-IκBα、p-p65、IκBα、p65,再用TBST洗3次,将其放入对应的加有二抗的稀释液中避光孵育1 h,二抗为Alexa Fluor®488 goat anti-Rabbit IgG,再用TBST洗3次,放入荧光检测仪中,检测目的条带,应用Odyssey图像分析软件检测各组蛋白的光密度值,作为蛋白表达水平。
2.4 RT-PCR检测炎性因子基因表达
细胞以不同因素处理后,弃去培养基,以Trizol法提取细胞总RNA,采用紫外分光光度法测定其含量与纯度。根据样本所测浓度,取适当剂量,将各样本浓度调整一致后反转录为cDNA。以GAPDH为内参照,采用20 μL体系进行PCR扩增。反应条件为:94 ℃、2 min,1个循环,94 ℃、40 s,25~35个循环,50~65 ℃、40 s,72 ℃、1 min,72 ℃、5 min,1个循环。引物序列见表1。

表1 RT-PCR引物序列
2.5 TUNEL染色检测细胞凋亡
将细胞接种至爬片上,调整密度为1×105个/mL,饥饿18 h,加入不同干预因素处理细胞12 h,PBS洗3次,1%多聚甲醛固定10 min,再用乙醇/乙酸2∶1混合液-20 ℃固定5 min,PBS清洗3 min。加入平衡液室温孵育10 s后滴加TdT酶工作液,37 ℃孵育1 h。加入工作液,振荡15 s后孵育10 min,PBS洗3次,吸干液体,滴加Anti-Digoxigenin Fluorescein工作液,避光孵育30 min,PBS再洗3次,DAPI封片,镜下观察拍照。正常细胞核被染为蓝色,凋亡细胞核被染为绿色,每组随机选择8个视野,计算细胞凋亡率(凋亡细胞数÷细胞总数×100%),取其平均值。
3 统计学方法
4 结果
4.1 金雀异黄素对A549细胞活力的影响
与对照组比较,GEN(1、5、10 μmol/L)单独干预A549细胞对其活力无影响;GEN(1、5、10 μmol/L)与LPS同时干预A549细胞则细胞活力明显升高(P<0.05,P<0.01)。结果见表2。
表2 各组A549细胞GEN和/或LPS不同浓度干预细胞活力比较(s)
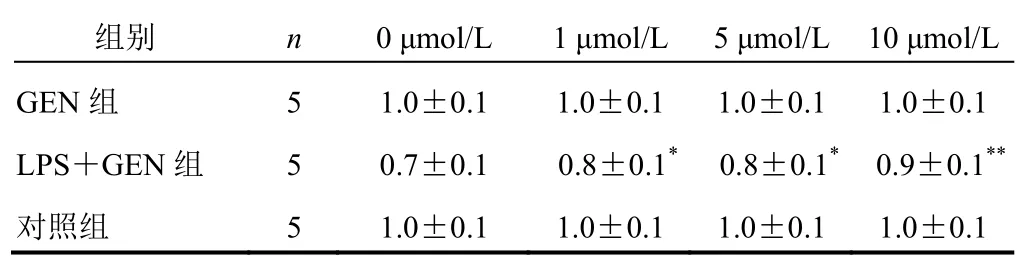
表2 各组A549细胞GEN和/或LPS不同浓度干预细胞活力比较(s)
注:与对照组比较,*P<0.05,**P<0.01
组别 n 0 μmol/L 1 μmol/L 5 μmol/L10 μmol/L GEN组 5 1.0±0.1 1.0±0.1 1.0±0.11.0±0.1 LPS+GEN组 5 0.7±0.1 0.8±0.1*0.8±0.1*0.9±0.1**对照组 5 1.0±0.1 1.0±0.1 1.0±0.11.0±0.1
4.2 金雀异黄素对脂多糖诱导A549细胞炎性因子的影响
与对照组比较,LPS(1 μg/mL)处理12 h后A549细胞炎性因子IL-1β、IL-6及TNF-α基因表达显著增加(P<0.01);GEN(1、5、10 μmol/L)与LPS同时干预炎性因子基因表达较LPS组显著降低(P<0.05,P<0.01),且呈浓度依赖性;GEN(10 μmol/L)单独干预A549细胞则对炎性因子的基因表达无影响。结果见表3。
表3 各组A549细胞炎性因子基因表达比较(±s)
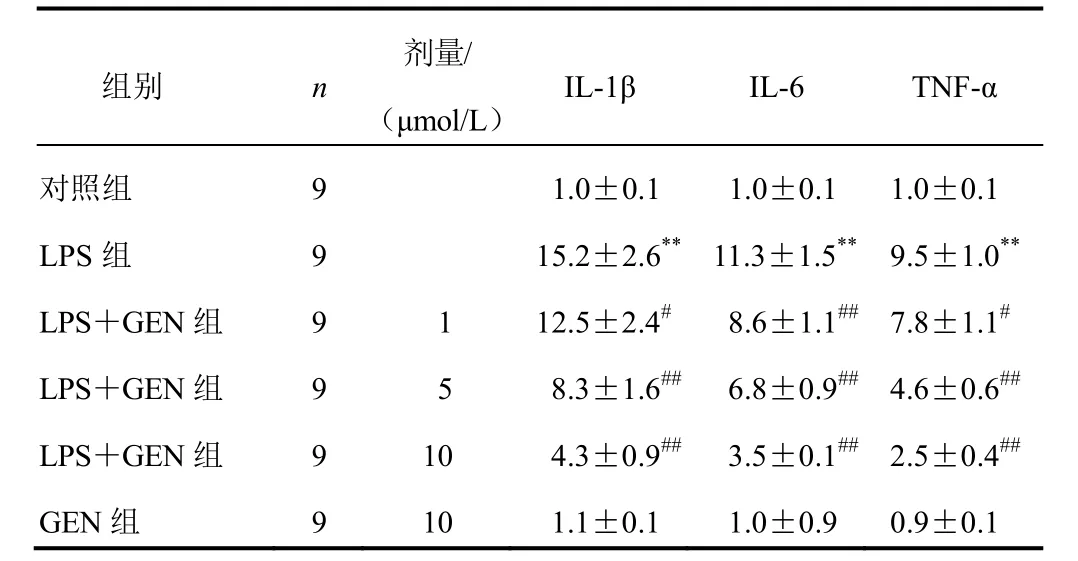
表3 各组A549细胞炎性因子基因表达比较(±s)
注:与对照组比较,**P<0.01;与LPS组比较,#P<0.05,##P<0.01
组别 n剂量/(μmol/L)IL-1β IL-6 TNF-α对照组 9 1.0±0.1 1.0±0.11.0±0.1 LPS组 9 15.2±2.6**11.3±1.5**9.5±1.0**LPS+GEN组 9 1 12.5±2.4#8.6±1.1##7.8±1.1#LPS+GEN组 9 5 8.3±1.6##6.8±0.9##4.6±0.6##LPS+GEN组 9 10 4.3±0.9##3.5±0.1##2.5±0.4##GEN组 9 10 1.1±0.1 1.0±0.90.9±0.1
与对照组比较,LPS干预3、6、12 h后A549细胞炎性因子IL-1β、IL-6和TNF-α基因表达明显升高(P<0.01);GEN(10 μmol/L)与LPS同时干预炎性因子mRNA表达较LPS组显著降低(P<0.01)。结果见表4。
表4 各组A549细胞不同时点炎性因子基因表达比较(±s,n=9)

表4 各组A549细胞不同时点炎性因子基因表达比较(±s,n=9)
注:与对照组比较,**P<0.01;与LPS组比较,##P<0.01
指标0 h 3 h 6 h 12 h对照组 LPS组 LPS+GEN组 对照组 LPS组LPS+GEN组 对照组LPS组 LPS+GEN组 对照组 LPS组 LPS+GEN组IL-1β 1.0±0.1 1.0±0.1 1.0±0.1 1.0±0.1 4.8±0.7**3.2±0.4##1.0±0.110.6±1.8**6.3±0.9##1.0±0.1 15.0±2.6**4.3±0.9##IL-6 1.0±0.1 1.0±0.8 1.0±0.8 1.0±0.1 3.4±0.7**2.5±0.6##1.0±0.1 7.9±1.1**3.6±0.7##1.0±0.1 11.3±1.5**3.5±0.6##TNF-α 1.0±0.1 1.0±0.1 1.0±0.1 1.0±0.1 4.2±0.7**2.5±0.4##1.0±0.1 8.3±1.6**3.6±0.2##1.0±0.1 11.2±1.9**3.0±0.6##
4.3 金雀异黄素对脂多糖诱导A549细胞凋亡的影响
与对照组比较,LPS(1 μg/mL)干预细胞12 h后凋亡率为42.3%,GEN(10 μmol/L)与LPS同时干预A549细胞后凋亡率降为13.6%,GEN(10 μmol/L)单独干预A549细胞对细胞凋亡无影响。结果见图1。
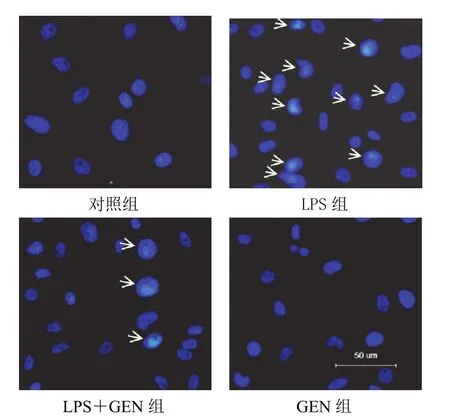
图1 各组A549细胞凋亡形态
4.4 金雀异黄素对脂多糖诱导A549细胞IκBα、p65信号通路磷酸化水平的影响
GEN(10 μmol/L)与LPS(1 μg/mL)协同刺激A549细胞30 min可显著抑制LPS诱导IκBα、p65信号通路的磷酸化水平(P<0.01),GEN(10 μmol/L)单独干预A549细胞对以上信号通路则无影响。结果见图2、表5。

图2 各组A549细胞信号通路蛋白表达免疫印迹图
表5 各组A549细胞IκBα、p65信号通路磷酸化水平比较(±s,OD值)

表5 各组A549细胞IκBα、p65信号通路磷酸化水平比较(±s,OD值)
注:与LPS组比较,##P<0.01
组别 n 剂量/(μmol/L) p-IκBα p-p65对照组 3 1.0±0.1 1.0±0.1 LPS组 3 2.1±0.2 2.3±0.2 LPS+GEN组 3 10 1.2±0.1##1.2±0.1##GEN组 3 10 1.0±0.1 1.0±0.1
5 讨论
本研究结果显示:LPS连续刺激A549细胞12 h可诱导其产生大量炎性因子且细胞凋亡率上升;RT-PCR结果提示,GEN可呈浓度依赖性及时间依赖性逆转炎性因子的上调;TUNEL染色结果提示,其亦可降低细胞凋亡率。Western blot检测结果显示,GEN可能是通过抑制NF-κB信号通路中的IκBα及p65的磷酸化而发挥保护作用。
有研究显示,GEN在急性和慢性炎症中均可发挥显著调控作用,作用靶点是通过抑制NF-κB及STAT信号通路的活化[9]。冯赞杰等[10]研究显示,GEN可抑制人血管平滑肌细胞中NF-κB的激活从而发挥抗动脉粥样硬化的作用,其亦可抑制大鼠关节炎滑膜细胞中IL-1β、TNF-α等炎症因子的产生。本实验选择GEN对ALI的体外细胞模型进行干预,通过预实验结果选择了3个药物浓度(1、5、10 μmol/L)来进行实验。
天然免疫在机体预防病原体侵袭发挥首当其冲的作用,LPS与之细胞膜上对应的Toll样受体相结合后可触发天然免疫反应,NF-κB信号通路的活化需要κB(IκBα和IκBβ)的磷酸化与降解。NF-κB主要由2个亚基(p65和p50)组成。IκBα与p65在细胞质中相结合,抑制NF-κB的细胞核转位,一旦NF-κB入核,其可调控细胞核转录细胞因子如IL-1β、IL-6、TNF-α及COX-2等。此外,LPS可增加细胞内活性氧的产生,增加线粒体膜电位的通透性,继而诱发内源性凋亡通路Caspase9的激活,细胞本身产生的TNF-α亦可作用于细胞膜,诱导外源性凋亡通路Caspase8的活化,2组凋亡通路均可通过Caspase3的活化而诱导细胞凋亡。本实验结果显示,GEN可显著抑制IκBα及p65的磷酸化水平,抑制NF-κB的核转位,其下游的炎性因子IL-1β、IL-6、TNF-α的mRNA水平均被GEN所抑制,TUNEL染色提示LPS诱导的细胞凋亡也明显减少。因此,我们认为GEN可能通过抑制IκBα及p65的磷酸化从而发挥抗细胞炎症及凋亡的作用。
综上,GEN可抑制LPS诱导肺泡Ⅱ型上皮细胞发生炎症与凋亡,为下一步动物在体研究提供了一定基础,但本研究对信号通路的具体机制阐述尚不明确,对线粒体膜电位及活性氧的产生亦未能明确,有待进一步实验,以明确GEN的具体作用机制。
[1] LEE C Y, YANG J J, LEE S S, et al. Protective effect of Ginkgo biloba leaves extract, EGb761, on endotoxin-induced acute lung injury via a JNK- and Akt-dependent NFκB pathway[J]. J Agric Food Chem,2014,62(27):6337-6344.
[2] XIE X, SUN S, ZHONG W, et al. Zingerone attenuates lipopolysaccharide-induced acute lung injury in mice[J]. Int Immunopharmacol,2014,19(1):103-109.
[3] LOU T, JIANG W, XU D, et al. Inhibitory effects of polydatin on lipopolysaccharide-stimulated RAW 264.7 cells[J]. Inflammation, 2015,38(3):1213-1220.
[4] TAO W, SU Q, WANG H, et al. Platycodin D attenuates acute lung injury by suppressing apoptosis and inflammation in vivo and in vitro[J]. Int Immunopharmacol,2015,27(1):138-147.
[5] BAO S, ZOU Y, WANG B, et al. Ginsenoside Rg1 improves lipopolysaccharide-induced acute lung injury by inhibiting inflammatory responses and modulating infiltration of M2 macrophages[J]. Int Immunopharmacol,2015,28(1):429-434.
[6] LI Y, WU Q, DENG Y, et al. D(-)-Salicin inhibits the LPS-induced inflammation in RAW264.7 cells and mouse models[J]. Int Immunopharmacol,2015,26(2):286-294.
[7] 王玲,刘辉国.金雀异黄素对肺泡Ⅱ型上皮细胞发生上皮-间质转化的影响[J].中国中医药信息杂志,2016,23(10):63-66.
[8] 金永生,刘超美.金雀异黄素的药理作用[J].国外医药:植物药分册, 2002,17(5):190-193.
[9] 马莹莹,张育,许金鑫,等.金雀异黄素对CIA大鼠促炎和抗炎因子分泌的影响[J].实用药物与临床,2014,17(10):1247-1251.
[10] 冯赞杰,卢志顺,刘洋,等.金雀异黄素抑制人血管平滑肌细胞中核因子κB的激活[J].中国动脉硬化杂志,2009,17(5):363-366.
(修回日期:2016-05-18;编辑:华强)
Effects of Genistein on Inflammation and Apoptosis of Human Alveolar Epithelial Cell A549 Induced by Lipopolysaccharide
WANG Ling1, LIU Hui-guo2
(1. The Hospital of Wuhan University, Wuhan 430071, China; 2. Tongji Hospital Affiliated to Tongji Medical College of HUST, Wuhan 430030, China)
ObjectiveTo investigate the effects of Genistein (GEN) acting on human lung adenocarcinoma A549 cells induced by LPS; To discuss its action of mechanism for improving injuries of lung.MethodsThe activity of cell treated with different concentrations of Genistein was detected by CCK-8 method and / or LPS intervention for 12 h. The expressions of inflammatory cytokines IL-1β, IL-6, and TNF-α induced by LPS were detected by RT-PCR. TUNEL was used to detect apoptosis, and Western blot was used to detect the changes of signal pathway.ResultsGEN (1, 5, 10 μmol/L) alone had no effects on cell activity; LPS (1 μg/mL) reduced cell viability significantly, while co-treated the A549 cells with GEN and LPS could reverse this condition in a concentration-dependent manner; RT-PCR results showed that LPS could significantly increase the level of gene expression of inflammatory factors, while GEN could inhibited this phenomenon in both concentration-and time-dependent manner; the results of TUNEL staining showed that GEN (10 μmol/L) combined with LPS for 12 h could significantly decrease the apoptosis rate; the results of Western blot showed that GEN possibly inhibited the inflammation and apoptosis through inhibiting the phosphorylation of IκBα, p65 signaling pathways.ConclusionGEN has anti-inflammation and anti-apoptosis effects on A549 cells induced by LPS, so as to play a protective rate.
Genistein; acute lung injury; A549; inflammation; apoptosis
10.3969/j.issn.1005-5304.2017.03.014
R285.5
A
1005-5304(2017)03-0057-04
2016-04-21)
