参芪抑瘤方药物血清对胃癌MGC-803细胞增殖的影响
2017-03-03马春林吴红彦李海龙陈杰张宣李红亮
马春林,吴红彦,2,3,李海龙,2,陈杰,张宣,李红亮
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中医方药挖掘和创新转化重点实验室,甘肃 兰州 730000;3.甘肃省中药新产品创制工程实验室,甘肃 兰州 730000
参芪抑瘤方药物血清对胃癌MGC-803细胞增殖的影响
马春林1,吴红彦1,2,3,李海龙1,2,陈杰1,张宣1,李红亮1
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省中医方药挖掘和创新转化重点实验室,甘肃 兰州 730000;3.甘肃省中药新产品创制工程实验室,甘肃 兰州 730000
目的观察参芪抑瘤方药物血清对胃癌MGC-803细胞增殖的影响,探讨其相关机制。方法以参芪抑瘤方不同浓度药物血清干预胃癌MGC-803细胞后,MTT法检测细胞增殖,流式细胞仪检测细胞周期,qRT-PCR检测CDKN1B、CDKN1C基因表达,Western blot检测p27、p57蛋白表达。结果3%、5%、10%药物血清作用于MGC-803细胞24、48、72 h,细胞增殖水平显著降低(P<0.01),且与时间和剂量呈依赖关系;3%、5%、10%药物血清作用于MGC-803细胞24 h后,G0/G1期细胞增多,S期细胞减少;qRT-PCR检测结果显示,与对照组和空白血清组比较,药物血清各剂量组MGC-803细胞CDKN1B、CDKN1C mRNA表达显著上调(P<0.01);Western blot检测结果显示,与对照组比较,药物血清各剂量组MGC-803细胞p27、p57蛋白表达显著上调(P<0.01)。结论参芪抑瘤方药物血清可抑制胃癌MGC-803细胞的增殖,其机制可能是通过调节CDKN1B、CDKN1C mRNA和蛋白表达,进而干预细胞周期。
参芪抑瘤方;药物血清;胃癌细胞;细胞增殖;细胞周期
参芪抑瘤方临床用于肿瘤的治疗,具有益气扶正、养血活血、化痰散结、清热利湿、解毒散结、通络止痛等功效。本实验在前期研究的基础上[1-3],进一步探索优化后的组方——参芪抑瘤方药物血清对胃癌MGC-803细胞增殖的影响,探讨其相关机制。
1 实验材料
1.1 药物
参芪抑瘤方(苦参、黄芪、当归、贝母等),饮片由甘肃中医药大学附属医院提供,经甘肃中医药大学附属医院杨锡仓主任药师鉴定符合2015年版《中华人民共和国药典》规定。
1.2 细胞株
胃癌MGC-803细胞株受赠于甘肃省中医方药挖掘和创新转化重点实验室。
1.3 动物
SPF级SD雌性大鼠50只,6~8周龄,体质量(200±20)g,甘肃中医药大学实验动物中心,动物合格证号2001000000198。饲养于室温20~25 ℃、湿度45%~55%的清洁级实验动物房,喂标准饲料,自由饮水。
1.4 试剂
DMEM高糖培养基(Gibco),四季青胎牛血清(浙江天杭生物科技有限公司),胰蛋白酶(Gibco),噻唑蓝(Sigma),二甲基亚砜(DMSO,Sigma),反转录试剂盒(美国Roche),扩增试剂盒(韩国BIONEER),RIPA裂解液(北京普利莱基因技术有限公司),化学发光液(美国Thermo),一抗、二抗(艾菲生物技术有限公司)。
1.5 仪器
流式细胞仪(美国COULTER,EPICS XL),细胞培养箱(上海力申科学仪器有限公司,HF212),倒置显微镜(日本OLYMPUS,CKX41+DP21),连续波长酶标仪(美国BIO-RAD),电泳槽、转印槽及配套电源(美国BIO-RAD),CFX96型PCR仪、凝胶成像仪(美国BIO-RAD)。
2 实验方法
2.1 中药汤剂制备
采用传统水煎方法。将称好的药材混合,先用10倍量水冷浸1 h,加热,待煮沸后,再持续煎煮40 min,滤出煎液,剩余药渣中再加6倍量水,至沸后继续煎煮30 min,滤出煎液,2次煎液合并,70 ℃水浴浓缩至含原药材5.7 g/mL水提液,4 ℃冰箱保存备用。
2.2 药物血清制备
将50只SPF级SD大鼠随机分为参芪抑瘤方组和空白组。给药组按3 mL/200 g予5.7 g原药材/mL汤剂灌胃(用药量为人等效剂量5倍),空白组予等量饮用水灌胃,每日2次,连续7 d,于末次给药1 h后,股动脉采血,4 ℃、3000 r/min离心10 min,将所采2组血清分别混合,-80 ℃冷藏备用,临用前56 ℃、30 min灭活。
2.3 细胞复苏与培养
复苏MGC-803胃癌细胞株,用含10%小牛血清DMEM培养液接种于无菌培养瓶中,置于37 ℃、5%CO2饱和湿度培养箱中单层贴壁培养。待细胞铺满培养瓶底后,弃去培养液,0.25%胰蛋白酶消化,吹打成细胞悬液后接种传代。
2.4 MTT法检测细胞抑制率
取对数生长期细胞,制备成密度为5×104/mL细胞悬液,接种于96孔板中,使每孔加入的细胞悬液为100 μL,待细胞贴壁后,设对照组、空白血清组和参芪抑瘤方药物血清低、中、高剂量组(药物血清低、中、高剂量组),每组设6个复孔。对照组予常规培养液;空白血清组和药物血清低、中、高剂量组予常规培养液的同时,每孔分别加非药物大鼠血清20、10、6、0 μL和药物大鼠血清0、6、10、20 μL,使各孔终体积为200 μL,各组所加大鼠血清占总培养液体积的10%。分别取经血清干预24、48、72 h的96孔培养板,每孔加5 g/L MTT 20 μL,继续培养4 h后弃去培养基,每孔加DMSO 150 μL,摇床震荡10 min,于酶标仪波长570 nm处测定吸光度(OD)值,计算细胞抑制率。细胞抑制率(%)=(对照孔OD值-给药孔OD值)÷对照孔OD值×100%。
2.5 流式细胞仪检测细胞周期
取对数生长期细胞接种于6孔板中,增殖为80%时,按“2.4”项分组,加入不同浓度的药物血清处理24 h,检测前用胰酶消化,1500 r/min离心5 min,吸弃上清液,PBS洗2次,70%乙醇固定,4 ℃过夜。用PBS配制成单细胞悬液,50 μg/mL碘化丙啶染色液室温染色30 min,流式细胞仪分析细胞周期。
2.6 qRT-PCR检测CDKN1B、CDKN1C基因表达
按Trizol法分别提取培养24 h后不同组别胃癌MGC-803细胞的总RNA,检测纯度后,用Takara反转录试剂盒反转录合成cDNA,按试剂盒说明操作,-20 ℃保存备用。引物由宝生物工程(大连)有限公司合成,其序列见表1。按照荧光定量PCR试剂盒说明操作,扩增反应在CFX96 Real-Time荧光PCR仪上进行。分析融解曲线,确认扩增产物的特异性,以2-ΔΔCt法计算相对表达量。
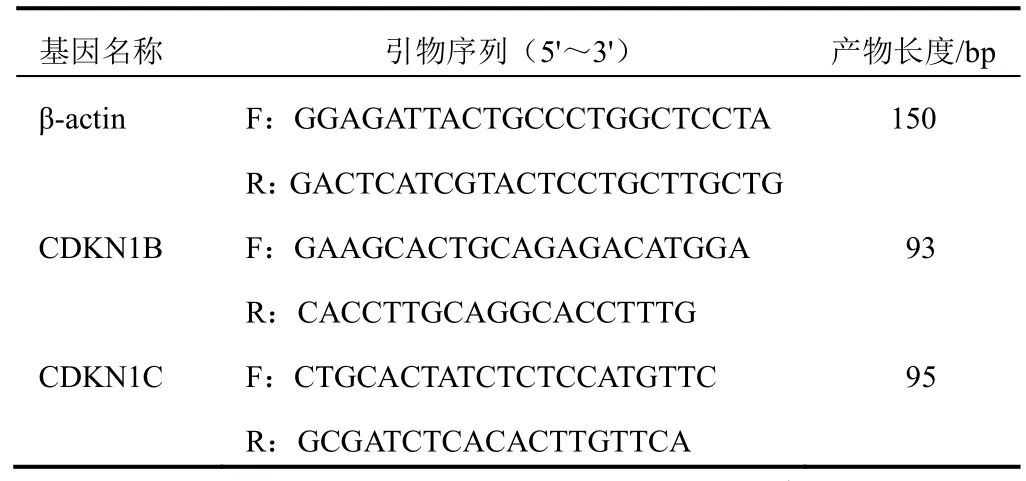
表1 PCR反应基因序列
2.7 Western blot检测p27、p57蛋白表达
低温下分别提取培养24 h后不同组别胃癌MGC-803细胞的蛋白,BCA法检测蛋白浓度,并把各组蛋白浓度调整一致,严格按试剂盒说明书进行操作。每孔上样10 μL,15%聚丙烯酰胺凝胶100 V恒压电泳分离约2 h;经200 mA、2 h转至PVDF膜;含5%脱脂奶粉的封闭液封闭1.5 h后,分别加入一抗p27(1∶500)、p57(1∶500)抗体4 ℃孵育过夜,TBST洗2次,TBS洗1次×5 min;再用抗兔辣根过氧化物酶耦联的二抗室温孵育1 h,TBST洗2次,TBS洗1次×5 min;加ECL工作液,凝胶成像仪下曝光成像。运用ImageJ2X专业图像软件分析目的蛋白条带灰度值。
3 统计学方法
4 结果
4.1 参芪抑瘤方药物血清对胃癌MGC-803细胞增殖的影响
不同浓度参芪抑瘤方药物血清对MGC-803细胞增殖有抑制作用,药物血清组OD值明显低于对照组。MGC-803细胞药物血清干预24 h高、中、低剂量组细胞抑制率分别为31.43%、16.98%、5.84%,MGC-803细胞药物血清干预48 h高、中、低剂量组抑制率分别为30.32%、22.67%、16.09%,MGC-803细胞药物血清干预72 h高、中、低剂量组抑制率分别为41.06%、23.27%、17.63%(P<0.05,P<0.01)。结果见表2。
表2 各组胃癌MGC-803细胞不同时点增殖水平比较(±s,OD值)
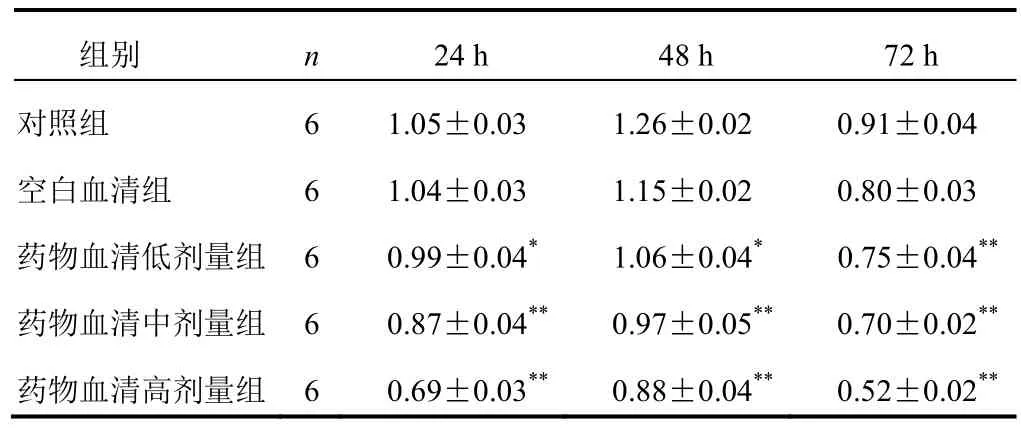
表2 各组胃癌MGC-803细胞不同时点增殖水平比较(±s,OD值)
注:与对照组比较,*P<0.05,**P<0.01
组别 n 24 h 48 h 72 h对照组 6 1.05±0.03 1.26±0.02 0.91±0.04空白血清组 6 1.04±0.03 1.15±0.02 0.80±0.03药物血清低剂量组 6 0.99±0.04*1.06±0.04*0.75±0.04**药物血清中剂量组 6 0.87±0.04**0.97±0.05**0.70±0.02**药物血清高剂量组 6 0.69±0.03**0.88±0.04**0.52±0.02**
4.2 参芪抑瘤方药物血清对胃癌MGC-803细胞周期的影响
不同浓度药物血清处理MGC-803细胞24 h后,与对照组比较,低剂量组G0/G1期比例由41.8%上升至53.4%,S期比例由50.8%下降至33.2%;中剂量组G0/G1期比例由41.8%上升至59.2%,S期比例由50.8%下降到27.2%;高剂量组G0/G1期比例由41.8%上升至70.6%,S期比例由50.8%下降至15.3%。结果见表3、图1。
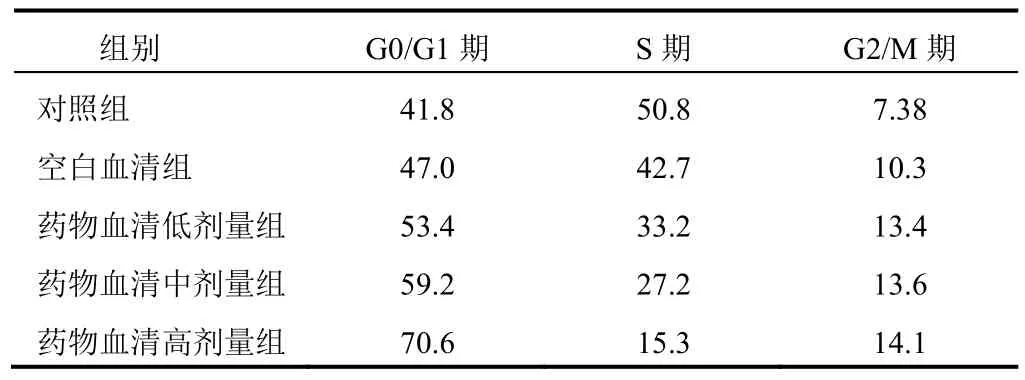
表3 各组胃癌MGC-803细胞周期分布比较(%)
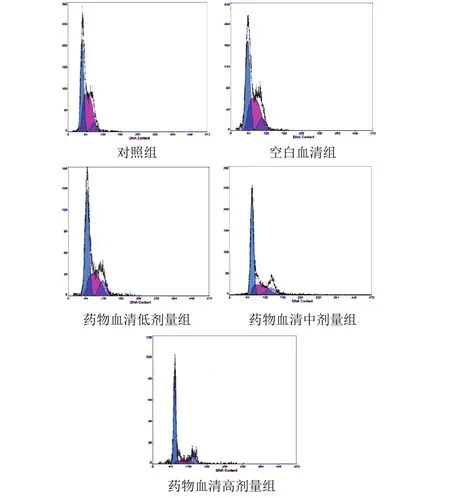
图1 各组胃癌MGC-803细胞流式细胞图
4.3 参芪抑瘤方药物血清对胃癌MGC-803细胞CDKN1B、CDKN1C基因表达的影响
参芪抑瘤方药物血清干预胃癌MGC-803细胞24 h后,与对照组和空白血清组比较,药物血清各剂量组抑癌基因CDKN1B、CDKN1C表达量明显上调(P<0.01)。结果见表4。
4.4 参芪抑瘤方药物血清对胃癌MGC-803细胞p27、p57蛋白表达的影响
与对照组比较,药物血清各剂量组p27、p57蛋白表达明显增加(P<0.01)。结果见表5、图2。
表4 各组胃癌MGC-803细胞CDKN1B、CDKN1C mRNA表达比较(±s,2-ΔΔCt值)

表4 各组胃癌MGC-803细胞CDKN1B、CDKN1C mRNA表达比较(±s,2-ΔΔCt值)
注:与对照组比较,*P<0.05,**P<0.01;与空白血清组比较,##P<0.01
组别 n CDKN1B CDKN1C对照组 6 1.00±0.00 1.00±0.00空白血清组 6 1.27±0.19*1.44±0.22*药物血清低剂量组 6 2.64±0.23**##2.57±0.29**##药物血清中剂量组 6 4.27±0.34**##3.40±0.41**##药物血清高剂量组 6 7.47±0.32**##9.67±0.20**##
表5 各组胃癌MGC-803细胞p27、p57蛋白表达比较(±s,平均灰度值)
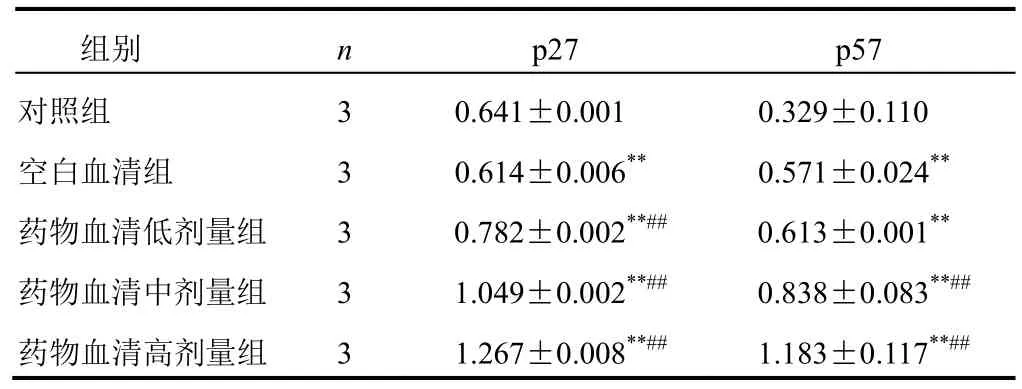
表5 各组胃癌MGC-803细胞p27、p57蛋白表达比较(±s,平均灰度值)
注:与对照组比较,**P<0.01;与空白血清组比较,##P<0.01
组别 n p27 p57对照组 3 0.641±0.001 0.329±0.110空白血清组 3 0.614±0.006**0.571±0.024**药物血清低剂量组 3 0.782±0.002**##0.613±0.001**药物血清中剂量组 3 1.049±0.002**##0.838±0.083**##药物血清高剂量组 3 1.267±0.008**##1.183±0.117**##

图2 各组p27、p57蛋白表达免疫印迹电泳图
5 讨论
参芪抑瘤方由苦参、黄芪、当归、贝母等组成,现代药理研究表明,方中各味中药有效成分对多种癌细胞均有明显的抑制作用[4-6]。
CDKN1B即p27kip基因定位于染色体12p13上,外显子和内显子各2个,属cip/kip家族成员之一,是重要的细胞周期素依赖激酶抑制因子,通过与细胞周期蛋白结合,产生对大多数Cyclin-CDK复合物(包括Cyclin E2-CDK在内)激酶活性的抑制作用,发挥负调控细胞周期的功能。而Cyclin E2很可能是细胞周期G1期的限速因子。p27kip既能抑制被激活Cyclin-CDK的活性,也可对CDK的激活过程进行干预,最终使细胞从G1期向S期的转变受到抑制。
CDKN1C即p57kip2基因定位于染色体11p15.5上,也是cip/kip家族成员之一,属细胞周期蛋白依赖性激酶抑制因子。在它的C末端有一核定位信号,近氨基末端有一介导细胞周期蛋白依赖性激酶的抑制的保守区。它可以抑制某些G1期和S期激酶复合物,如Cyclin E-CDK2、Cyclin A-CDK2及Cyclin D-CDK2等,阻滞细胞由G1期向S期的转变,停滞细胞于G1期,近而发挥负调控细胞周期的作用。
现代研究表明,胃癌组织p27kip1和p57kip2的阳性表达明显低于正常胃组织,提示胃癌的发生可能与p27kip1和p57kip2蛋白的低表达或缺失有关[7-9],其机理可能是胃癌组织p27kip蛋白表达降低,增加Cyclin-CDK2复合物的活性,加速细胞由G期向S期的过渡,促使细胞过度增殖而形成肿瘤;或是p57Kip2的缺乏导致Cyclin D/CDK6的聚集,Rb蛋白活性受到抑制,促使E2F因子的释放,进而激活相关应答基因转录,细胞开始增殖,导致Cyclin E/CDK2激酶复合物的持续激活,加速细胞周期G1向S期的进程,导致Cyclin A/CDK2激酶复合物的持续激活,升高Cyclin A的表达水平,进而利于细胞更快地进入S期。
本研究结果表明,参芪抑瘤方药物血清可抑制胃癌MGC-803细胞的增殖,且对胃癌MGC-803细胞由G1期向S期的转化有一定阻滞作用,其机制可能是通过调节CDKN1B和1C的表达,促使其与细胞周期蛋白结合,抑制Cyclin-CDK2等复合物的活性,发挥负调控细胞周期的功能。
[1] 石金凤,李海龙,吴红彦,等.当归贝母苦参丸含药血清对胃癌细胞SGC-7901和侵袭转移能力和周期的影响[J].辽宁中医药大学学报, 2014,16(10):30-33.
[2] 吴红彦,荣倩倩,李海龙,等.当归贝母苦参丸含药血清对胃癌细胞SGC-7901抑制作用机制的研究[J].中国实验方剂学杂志,2016,22(2):137-141.
[3] 马春林,吴红彦,李海龙,等.参芪抑瘤方药物血清对胃癌MKN-45细胞周期阻滞及抗侵袭转移的影响[J].中国中医药信息杂志,2016,23(4):64-66.
[4] 刘宝瑞,钱晓萍,孟宪志,等.阿魏酸钠对人大肠癌Moser细胞和乳腺癌MCF7细胞增殖和凋亡的影响[J].中国中西医结合杂志,2002,22(特刊):188-190.
[5] 吴素珍,李加林,陈水亲,等.硫酸酯化当归多糖抗肿瘤实验研究[J].时珍国医国药,2012,23(2):319-320.
[6] 张裴,顾政一,孙玉华,等.贝母素乙逆转SGC-7901/VCR细胞株多药耐药的初步研究[J].新疆医科大学学报,2012,35(4):452-456.
[7] 刘娟妮,张中冕,陈琛.ERCC1、P27kip1、CyclinE在胃癌组织中的表达及其临床意义[J].肿瘤防治研究,2010,37(5):540-543.
[8] 张也频.Cip/Kip家族的独特成员p57Kip2的研究进展[J].中国肿瘤生物治疗杂志,2011,18(15):574-580.
[9] LI G, DOMENICO J, LUCAS J J, et al. Identification of multiple cell cycle regulatory functions of p57Kip2 in human T lymphocytes [J]. J Immunol,2004,173(4):2383-2391.
Effects of Medicinal Serum of Shenqi Yiliu Formula on Proliferation of Gastric Cancer MGC-803 Cells
MA Chun-lin1, WU Hong-yan1,2,3, LI Hai-long1,2, CHEN Jie1, ZHANG Xuan1, LI Hong-liang1
(1. Gansu University of Chinese Medicine, Lanzhou 730000, China; 2. State Key Laboratory of Traditional Chinese Medicine Excavation Innovation and Transformation of Gansu Province, Lanzhou 730000, China; 3. Laboratory for TCM New Products Development Engineering of Gansu Province, Lanzhou 730000, China)
ObjectiveTo investigate the inhibitory effects of medicinal serum of Shenqi Yiliu Formula on cell proliferation of gastric cancer MGC-803 cells; To discuss relevant mechanism.MethodsAfter treated with different concentrations of medicinal serum of Shenqi Yiliu Formula, gastric cancer MGC-803 cells were tested by the following methods: MTT was employed to test the proliferation of gastric cancer MGC-803 cells; Flow cytometry was used to detect cell cycle; qRT-PCR was used to detect the genetic expressions of CDKN1B and CDKN1C; Western blot was employed to test the protein expressions of p27 and p57.ResultsWhen 3%, 5% and 10% medicinal serum of Shenqi Yiliu Formula was treated to MGC-803 cells for 24 h, 48 h and 72 h, proliferation of cells decreased significantly (P<0.01), with time- and dosage-dependent relationship. When 3%, 5% and 10% medicinal serum of Shenqi Yiliu Formula was treated to MGC-803 cells for 24 h, cells in G0/G1 increased, decreased in S. qRT-PCR results showed that compared with the blank control group and the negative control group, mRNA expressions of CDKN1B and CDKN1C of MGC-803 cells in medicinal serum all dose group increased significantly (P<0.01). Western blot results showed that compared with the blank control group, protein expressions of p27 and p57 of MGC-803 cells in medicinal serum all dose group increased significantly (P<0.01).ConclusionMedicinal serum of Shenqi Yiliu Formula can inhibit MGC-803 cells proliferation and the mechanism may be through adjusting CDKN1B, CDKN1C mRNA and proteins expression to intervene in the cell cycle.
Shenqi Yiliu Formula; medicinal serum; gastric cancer cell; cell proliferation; cell cycle
10.3969/j.issn.1005-5304.2017.03.013
R285.5
A
1005-5304(2017)03-0053-04
2016-04-07)
(
2016-04-24;编辑:华强)
甘肃中医药大学研究生创新基金(2015CX11);兰州市人才创新创业扶持项目(2015-RC-24)
吴红彦,E-mail:wuhy@163.com
