异常黏液质成熟剂对APP/PS1转基因阿尔茨海默病小鼠学习记忆和脑组织RAGE、LRP1蛋白表达的影响
2017-03-03塔依尔吐尔松阿地兰沙拉木兰希孙龙飞努尔买买提艾买提
塔依尔·吐尔松,阿地兰·沙拉木,兰希,孙龙飞,努尔买买提·艾买提
1.新疆医科大学维吾尔医学院,新疆 乌鲁木齐 830011;2.新疆医科大学第一附属医院,新疆 乌鲁木齐 830011;3.新疆医科大学中医学院,新疆 乌鲁木齐 830011
异常黏液质成熟剂对APP/PS1转基因阿尔茨海默病小鼠学习记忆和脑组织RAGE、LRP1蛋白表达的影响
塔依尔·吐尔松1,阿地兰·沙拉木2,兰希2,孙龙飞3,努尔买买提·艾买提1
1.新疆医科大学维吾尔医学院,新疆 乌鲁木齐 830011;2.新疆医科大学第一附属医院,新疆 乌鲁木齐 830011;3.新疆医科大学中医学院,新疆 乌鲁木齐 830011
目的观察异常黏液质成熟剂对APP/PS1转基因阿尔茨海默病(AD)小鼠学习记忆和脑组织RAGE、LRP1蛋白表达的影响,探讨其作用机制。方法选取3月龄APP/PS1转基因AD模型小鼠并将其随机分为模型组、阳性药组和异常黏液质成熟剂高、中、低剂量组,每组18只,另取18只3月龄C57BL/6J小鼠作为正常组。各给药组给予相应药物灌胃,连续6个月。跳台实验观察小鼠学习和记忆能力;免疫组化和Western blot检测LRP1、RAGE蛋白表达。结果与正常组比较,模型组学习成绩反应期时间和错误次数增加,记忆成绩潜伏期时间减少、错误次数增加(P<0.01);与模型组比较,各给药组学习成绩反应期时间和错误次数减少,记忆成绩潜伏期时间增加、错误次数减少(P<0.05,P<0.01);免疫组化和Western blot结果显示,与正常组比较,模型组小鼠脑组织LRP1表达降低、RAGE表达增加(P<0.05);与模型组比较,异常黏液质成熟剂各剂量组小鼠脑组织LRP1表达增加、RAGE表达降低(P<0.05,P<0.01)。结论异常黏液质成熟剂可改善APP/PS1转基因AD小鼠空间学习记忆能力,调整RAGE和LRP1的表达。
异常黏液质成熟剂;APP/PS1转基因小鼠;空间学习记忆;海马CA1区;RAGE;LRP1
阿尔茨海默病(Alzheimer's disease,AD)是一种神经系统退行性疾病,以多种原因引起的记忆和认知功能障碍及神经功能受损为主要特征。AD属于维医学异常体液所致“失忆”“失眠”“愚蠢”等范畴。在早期的轻度认知功能障碍期,异常黏液质在临床表现中占主要地位[1]。本实验观察异常黏液质成熟剂对APP/PS1转基因AD模型小鼠学习记忆和脑组织RAGE、LRP1蛋白表达的影响,探讨其作用机制。
1 实验材料
1.1 动物
3月龄APP/PS1转基因AD模型雄性小鼠90只,SPF级,体质量(25±2)g;3月龄SPF级C57BL/6J雄性小鼠18只,体质量(25±2)g,北京华阜康生物科技股份有限公司,动物许可证号SCXK(京)2009-0004。小鼠饲养于新疆医科大学SPF级实验动物中心。
1.2 药物
异常黏液质成熟剂,新疆医科大学维吾尔医学院;盐酸多奈哌齐,卫材(中国)药业有限公司,批号061653928914,使用前粉碎,用蒸馏水溶解。
1.3 主要试剂与仪器
RAGE抗体、LRP1抗体(美国Abcam)。封闭用山羊血清、羊抗兔二抗、DAB显色液、BCA定量检测试剂盒、山羊抗小鼠IgG(H+L)-HRP、山羊抗兔IgG(H+L)-HRP、SDS-PAGE凝胶制备试剂盒、SDS-PAGE上样缓冲液(5×)、SDS-PAGE电泳缓冲液、ECL Western Blot Kit高灵敏度化学发光检测试剂盒,CWbio.Co.Ltd。BS-1105型电子天平(北京Sartorius天平有限公司),OLYMPUS CX-3双目显微镜(日本OLYMPUS),Laica DM300图像采集系统(德国Laica)。
2 实验方法
2.1 分组和给药
将90只转基因AD小鼠随机分为模型组、阳性药组和异常黏液质成熟剂高、中、低剂量组(高、中、低剂量组),每组18只;同时以18只相同月龄的C57BL/6J小鼠作为正常组。实验小鼠给药6个月后,做行为学实验。依据异常黏液质成熟剂的临床应用剂量换算成小鼠给药剂量,低、中、高剂量组分别按1.5、2、3 g/(kg·d)予异常黏液质成熟剂灌胃,阳性药组予0.92 mg/(kg·d)多奈哌齐灌胃,正常组和模型组予等量生理盐水灌胃。给药体积均为1 g/0.1 mL,按照病情初步尝试给药6个月。实验阶段所有小鼠均正常饮食和饮水,每日1次。
2.2 跳台实验
小鼠在跳台测试箱内放置5 min,使其适应测试箱内环境后通电。小鼠受到电击时跳回跳台,大多数小鼠可以多次跳上跳下,以小鼠第2次从跳台跳下,记为第1次错误次数。训练时间为5 min,记录5 min内错误次数。第2日开始测试记忆能力,直接把小鼠放在安全跳台上后再通电,记录5 min内小鼠停止的时间(即潜伏期)和错误次数。
2.3 免疫组化检测
烤箱内烤溶标本置于二甲苯Ⅰ内脱蜡。染色前石蜡切片脱蜡,梯度乙醇脱水,二甲苯Ⅰ 5 min,二甲苯Ⅱ 10 min,无水乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、80%乙醇各5 s,再水洗,3%H2O2室温10 min消除内源性过氧化物酶,蒸馏水洗3次×5 min,PBS洗3次×5 min。0.01 mol/L柠檬酸抗原修复液,微波修复10 min,室温冷却,蒸馏水冲洗3×5 min,PBS冲洗3×5 min,加一抗,4 ℃冰箱过夜,PBS洗3×5 min,滴加通用免疫球蛋白G抗体聚合物(二抗),37 ℃温箱25 min孵化,PBS冲洗3×5 min,新鲜制备DAB显色液自来水终止显色,Hematoxylin复染5~10 min,蒸馏水洗涤,盐酸乙醇分化,返蓝,脱水,透明,取出封片,组织学实验室通风橱内进行检测。
2.4 Western blot检测
小鼠全脑匀浆,Western blot测定整个大脑RAGE、LPR1蛋白含量。蛋白样品处理:每孔取50 μg蛋白上样,将样品置于水浴锅煮沸5 min,冰浴5 min,4 ℃、12 000 r/min离心5 min。SDS-PAGE电泳:加入提前准备好的蛋白样品,每孔上样量为20 μL,蛋白Marker上样量为10 μL,积层胶电压80 V,分离胶电压120 V。转膜:将剪裁完毕PVDF膜甲醇中浸泡5 min,转移盘中加入少量转移缓冲液,将剪裁完毕8张滤纸浸泡,转移板放置转移盘中,将4张滤纸放置在转移板海绵垫上的中间位置,在滤纸上小心平铺凝胶,将PVDF膜覆盖于分离胶上面,标记好Marker位置后,再放置4张滤纸,赶走气泡。80 V恒压4 ℃进行半干转。封闭:转膜结束后,PVDF膜于温摇床封闭1 h,TBST冲洗3次×5 min。孵育抗体:封闭完成后,TBST于室温摇床洗涤5次×10 min,TBST将一抗稀释至所需浓度,4 ℃摇床孵育过夜,TBST于室温摇床洗涤5次×10 min,TBST将二抗稀释到所需浓度,37 ℃摇床孵育1 h,室温2 h。TBST室温摇床洗涤3次×10 min,显色观察。
3 统计学方法
4 结果
4.1 异常黏液质成熟剂对APP/PS1转基因模型小鼠空间学习记忆能力的影响
与正常组比较,模型组学习成绩反应期时间和错误次数显著增加(P<0.01),记忆成绩潜伏期时间减少、错误次数显著增加(P<0.01);与模型组比较,各给药组学习成绩反应期时间和错误次数显著减少(P<0.05,P<0.01),记忆成绩潜伏期时间增加、错误次数显著减少(P<0.05,P<0.01)。结果见表1。
表1 各组小鼠跳台实验学习和记忆成绩比较(±s)

表1 各组小鼠跳台实验学习和记忆成绩比较(±s)
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01
学习成绩 记忆成绩组别 只数反应期/s 错误次数 潜伏期/s 错误次数正常组 10 13.30±3.16 2.20±2.39 24.90± 5.03 0.70±0.10模型组 10 21.63±2.56△△5.38±2.77△△5.63± 5.21△△5.75±0.92△△阳性药组 10 12.10±4.81*2.90±3.70**11.50± 4.12*4.90±5.44**低剂量组 10 18.80±5.05**4.00±2.48**13.10± 6.85*1.70±4.50**中剂量组 10 17.10±1.14**3.20±3.65**15.60±10.82**1.85±7.24**高剂量组 10 15.60±4.44**3.00±2.57**18.00± 5.05**1.03±4.42**
4.2 异常黏液质成熟剂对APP/PS1转基因模型小鼠海马CA1区RAGE表达的影响
用RAGE抗体免疫组织化学染色后,可以分辨小鼠海马CA1区的阳性反应物,分布在神经元细胞膜和细胞质。与正常组比较,模型组RAGE阳性细胞平均密度和平均数量显著增加(P<0.05);与模型组比较,各给药组RAGE阳性细胞平均密度和平均数量显著减少,差异有统计学意义(P<0.05,P<0.01)。结果见表2、图1。
表2 各组小鼠海马CA1区RAGE蛋白表达比较(±s)

表2 各组小鼠海马CA1区RAGE蛋白表达比较(±s)
注:与正常组比较,△P<0.05;与模型组比较,*P<0.05,**P<0.01
组别 只数 平均密度 阳性细胞数正常组 10 75.17±7.82 8.16±7.13模型组 10 110.14±9.42△27.26±2.26△阳性药组 10 76.23±6.33*10.27±4.16**低剂量组 10 78.12±5.24*13.13±2.54*中剂量组 10 70.27±7.54**11.15±3.13**高剂量组 10 54.48±6.45**9.12±3.12**
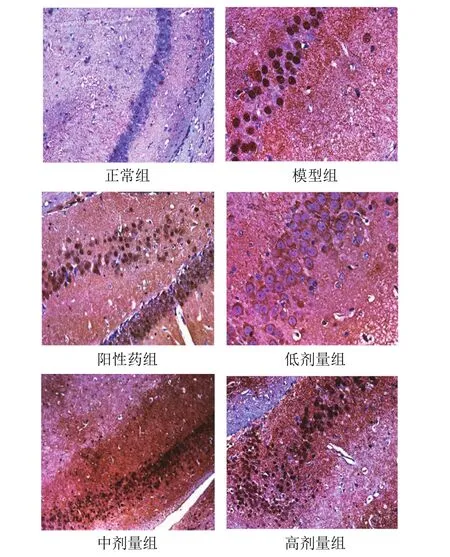
图 1 各组小鼠海马CA1区RAGE阳性表达病理形态(免疫组化染色,×100)
4.3 异常黏液质成熟剂对APP/PS1转基因模型小鼠海马CA1区LRP1表达的影响
LRP1抗体免疫组织化学染色后,可以分辨小鼠海马CA1区的阳性反应物,分布在神经元细胞膜和细胞质。与正常组比较,模型组小鼠海马CA1区LRP1阳性细胞平均密度和平均数量显著降低(P<0.05);与模型组比较,各给药组阳性细胞平均密度和平均数量显著增加(P<0.05,P<0.01)。结果见表3、图2。
表3 各组小鼠海马CA1区LRP1蛋白表达比较(s)

表3 各组小鼠海马CA1区LRP1蛋白表达比较(s)
注:与正常组比较,△P<0.05;与模型组比较,*P<0.05,**P<0.01
组别 只数 平均密度 阳性细胞数正常组 10 172.14±6.93 48.41±3.34模型组 10 104.28±8.43△23.15±4.21△阳性药组 10 119.34±6.21*30.25±4.12*低剂量组 10 120.09±8.54*30.83±2.94*中剂量组 10 125.17±7.18**27.08±5.24*高剂量组 10 139.67±6.21**36.12±6.13**
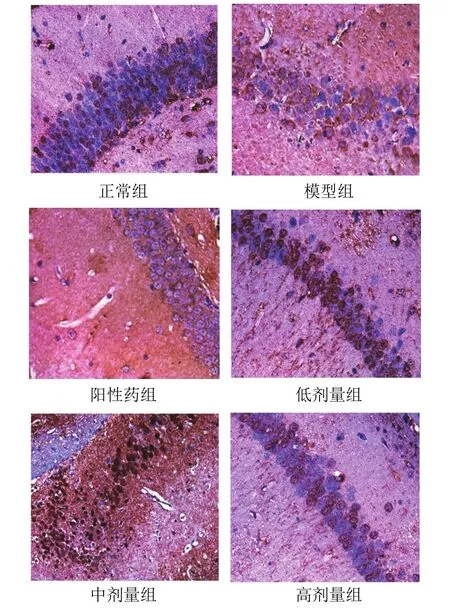
图 2 各组小鼠海马CA1区LRP1阳性表达病理形态(IHC染色,×100)
4.4 异常黏液质成熟剂对APP/PS1转基因模型小鼠全脑RAGE蛋白表达的变化
各组在42 kD处有一个明显的条纹,模型组条带颜色加深;与模型组比较,异常黏液质成熟剂各剂量组条带颜色变浅,表明蛋白表达减弱。结果见图3。
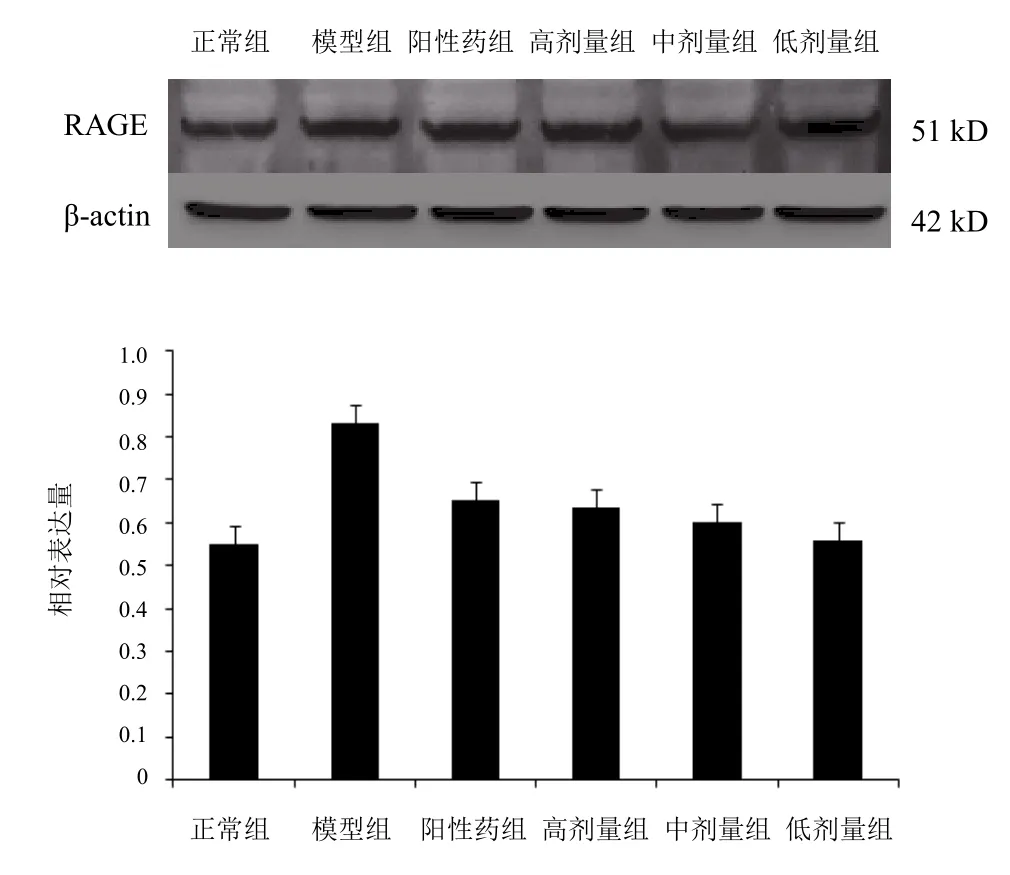
图3 各组小鼠全脑RAGE蛋白表达
4.5 异常黏液质成熟剂对APP/PS1转基因模型小鼠全脑LPR1蛋白表达的影响
各组在70 kD处有一个明显的条纹,模型组和正常组条带颜色变化不显著;与模型组比较,异常黏液质成熟剂各剂量组条带颜色稍微变深,表明蛋白表达逐步增强。结果见图4。
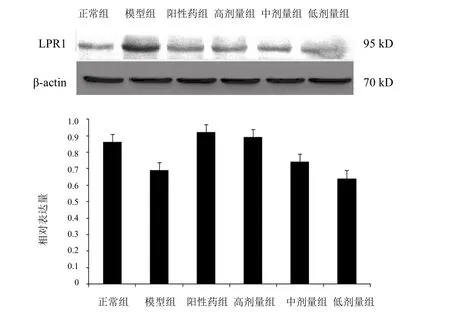
图4 各组小鼠全脑LRP1蛋白表达
5 讨论
AD是一种与年龄相关、不可逆的神经退行性疾病,初期呈现轻度认知功能障碍,最终发展为严重的记忆功能缺损。在疾病后期,抑郁或焦虑和易怒等精神症状出现。血脑屏障中的LPR1和RAGE与β淀粉样蛋白(β-amyloid,Aβ)生成和清除有关[2]。在AD患者和APP/PS1转基因AD模型中,晚期糖基化终末产物受体RAGE在血脑屏障中的表达大幅上升,从而使更多的Aβ进入大脑内。而Aβ沉积可以刺激RAGE表达进一步增强,形成一个恶性循环。神经元和小神经胶质细胞与血管内皮细胞膜上RAGE及Aβ结合,引起神经元毒性、持久性的炎症反应。LRP1为低密度脂蛋白受体相关蛋白属LDL受体家族的多配体受体,LRP1可以在神经元、内皮细胞、胶质细胞等表达,不同细胞表达作用不同。在AD动物模型中脑内LRP1的严重缺失和血脑屏障受体相关蛋(RAP)基因的缺失均导致脑内淀粉沉积加倍[3]。已发现在AD患者和APP转基因动物模型中,RAGE在血脑屏障中显著上调,而LRP1下调,并与脑内Aβ聚集有关[4-5]。
目前治疗AD药物主要是通过增强胆碱能神经的功能发挥治疗作用,可逆性地抑制乙酰胆碱酯酶对乙酰胆碱的水解,从而提高乙酰胆碱的浓度。维医认为,大脑是湿寒性脏器,黏液质属性也是湿寒,其中涩味黏液质是黏液之中混入黑胆质的异常体液,份量重、质地稠,作为大脑病理产物在大脑中沉淀,容易形成神经阻滞,从不同途径和/或不同程度上影响破坏神经组织、影响细胞的正常生理功能,进而导致引起相应的神经功能障碍和AD等神经系统疾病[6]。
本实验结果显示,模型组小鼠海马RAGE蛋白表达明显增加,这与Hori O等[7]研究的AD患者脑内RAGE表达均显著增高,RAGE能介导Aβ跨越血脑屏障进入脑实质的结果相似。AD病因包括APP、PS1基因的突变[8],Aβ引起的神经元损害已被认可作为一种重要的病理特征,在研究和开发转基因小鼠的过程中起十分重要的作用[9]。APP/PS1转基因小鼠是使用最广泛的模型之一。本实验通过使用APP/PS1转基因小鼠模型,以AD主要治疗药物多奈哌齐为阳性对照,以维吾尔医学体液论为基础,根据维吾尔医学治疗原则,以异常黏液质成熟剂作为实验药物进行干预。
实验结果表明,异常黏液质成熟剂治疗后各给药组小鼠海马CA1区RAGE阳性细胞数较模型组减少,异常黏液质成熟剂高、中剂量组阳性细胞平均密度明显降低。比异常黏液质成熟剂各剂量组海马CA1区表达的LRP1阳性细胞数明显增加,高剂量效果最明显,提示异常黏液质成熟剂可有效地改善神经细胞的损伤。Western blot结果显示,给药组转基因小鼠脑内存在RAGE的表达下降,LRP1表达上调,最终改善APP/PS1转基因小鼠的认知功能。
[1] 新疆维吾尔自治区卫生厅中国医学百科全书维吾尔医学分卷办公室.中国医学百科全书:维吾尔医学分卷[M].乌鲁木齐:新疆人民卫生出版社,1985:17-25.
[2] MA L, CARTER R J, MORTON A J, et al. RAGE is expressed in pyramidal cells of the hippocampus following moderate hypoxic-ischemic brain injury in rats[J]. Brain Res,2003,966(2):167-174.
[3] DEANE R, WU Z, SAGARE A,et a1. LRP1/amyloid beta-peptide interaction mediates differential brain efflux of Abeta isoforms[J]. Neuron,2004,43(3):333-344.
[4] JAEGER L B, DOHG U S, SULTANA R, et al. Lipopolysaccharide alters the blood-brain barrier transport of amyloid beta protein:a mechanism for inflammation in the progression of Alzheimer's disease[J]. Brain Behav Immun,2009,23(4):507-517.
[5] BANKS W A, BURNEY B O, ROBINSON S M, et al. Effects of triglycerides, obesity, and starvation on ghrelin transport across the blood-brain barrier[J]. Peptides,2008,29(11):2061-2065.
[6] 塔依尔·吐尔松,买吾拉尼江·依孜布拉,买地尼也提·尼亚孜,等.异常黏液质成熟剂颗粒对APP/PS1转基因小鼠行为学和海马组织病理形态学的影响[J].中国中医药信息杂志,2016,23(4):41-44.
[7] HORI O, BRETT J, SLATTERY T, et al. The Receptor for advanced glycation end products (RAGE) is a cellular binding site for amphoterin[J]. Journal of Biological Chemistry,1995,270(43):25752-25761.
[8] JENNIFER W, JILL G, MPHIL K, et al. Genetic aspects of Alzheimer disease[J]. Neurologist,2009,15(2):80-86.
[9] OANA C, LUCIAN H, MARIUS M, et al. Cognitive-enhancing and antioxidant activities of inhaled coriander volatile oil in amyloid β(1-42) rat model of Alzheimer's disease[J]. Physiology & Behavior,2013,120(15):193-202.
Effects of Abnormal Phlegmatic Munziq on Ability of Learning and Memory and Protein Expressions of Brain Tissue RAGE and LRP1 of APP/PS1 Transgenic Mice Model of AD
Tayerjan Tursun1, Adilan Shalamu2, LAN Xi2, SUN Long-fei3, Nurmuhammat Amat1
(1. Traditional Uyghur Medicine College, Xinjiang Medical University, Urumqi 830011, China; 2. The First Affiliated Hospital, Xinjiang Medical University, Urumqi 830011, China; 3. Traditional Chinese Medicine College , Xinjiang Medical University, Urumqi 830011, China)
ObjectiveTo investigate the effects of Abnormal Phlegmatic Munziq on ability of learning and memory, and protein expressions of brain tissue RAGE and LRP1 of APP/PS1 transgenetic mice model of AD; To discuss its mechanism of action.MethodsThree-month-old APP/PS1 transgenic mice were randomly divided into 5 groups: model control group, positive control group, Abnormal Phlegmatic Munziq high-, medium-, and low-dose groups, 18 mice in each group. Another 18 three-month-old C57BL/6J mice were chosen as normal control group. All administration groups received relevant medicine for successive 6 months. Then the changes in ability of learning and memory of mice were detected by Step-down test; protein expressions of LRP1 and RAGE were detected by immunohistochemistry and Western blot.ResultsCompared with the normal control group, the reaction time of learning grades and the mistake times increased, incubation of memory grades decreased and the mistake times increased in the model control group (P<0.01); Compared with the model control group, the reaction time of learning grades and the mistake times decreased, incubation of memory grades increased and the mistake times decreased in all administration groups (P<0.05, P<0.01). Immunohistochemistry and Western blot results showed that compared with normal control group, the LRP1 expression decreased and RAGE increased in the model control group (P<0.05);Compared with the model control group, the LRP1 expression decreased and RAGE increased in Abnormal Phlegmatic Munziq high-, medium-, and low-dose groups (P<0.05,P<0.01).ConclusionAbnormal Phlegmatic Munziq can improve ability of spatial learning and memory in APP/PS1 mice and regulate the expressions of RAGE and LRP1.
Abnormal Phlegmatic Munziq; APP/PS1 transgenic mice; spatial learning and memory; hippocampal CA1; RAGE; LRP1
10.3969/j.issn.1005-5304.2017.03.011
R285.5
A
1005-5304(2017)03-0043-05
2016-02-24)
(
2016-04-05;编辑:华强)
教育部新世纪优秀人才计划(NCET-11-1073)
努尔买买提·艾买提,E-mail:Oglan1972@126.com
