EHD2与E-cadherin在肝细胞肝癌中的表达及其相关性*
2017-03-03刘金霞瞿利帅陆翠华倪温慨倪润洲
刘金霞 瞿利帅 陆翠华 倪温慨 倪润洲
·临床研究与应用·
EHD2与E-cadherin在肝细胞肝癌中的表达及其相关性*
刘金霞 瞿利帅 陆翠华 倪温慨 倪润洲
目的:研究EHD2、E-cadherin蛋白在肝细胞肝癌中的表达及两者相关性。方法:Western blot法和免疫组织化学法检测肝细胞肝癌及对应的癌旁组织中EHD2与E-cadherin表达情况,分析两者的相关性及与患者临床病理学参数及预后的关系。结果:EHD2、E-cadherin蛋白在肝癌组织中的表达明显低于癌旁组织,且两者的表达水平与肝癌的组织分化程度、静脉侵袭及淋巴结转移密切相关(P<0.05),与年龄、性别、肿瘤大小等参数无相关性。EHD2、E-cadherin低表达与肝癌患者的不良预后显著相关(P<0.05)。结论:EHD2、E-cadherin蛋白表达与肝细胞肝癌的发生发展有关,两者的联合检测有助于肝细胞肝癌的诊断、恶性程度及预后的评估。
肝细胞肝癌 EHD2 E-cadherin Western blot免疫组织化学
肝细胞肝癌(hepatocellular carcinoma,HCC)简称肝癌,是全球五大常见恶性肿瘤之一,死亡率在肿瘤性疾病中居第三位,发病率高并呈增长趋势[1]。肝癌的发生发展是多因素多阶段的连续发展过程,如原癌基因的激活和抑癌基因的失活,但其确切的发病机制仍不清楚[2]。EHD2(EH-domain containing pro⁃tein 2)是新近发现的一种C端含有EH域(Eps 15 ho⁃mology domain)的膜转运调控蛋白,与EHD1、EHD3和EHD4共同组成EHD(Eps15 homology domain con⁃taining proteins,EHDs)蛋白家族亚类[3-4]。EHD2在食管癌、乳腺癌和神经胶质瘤等多种肿瘤中表达下降且作为抑癌基因参与其发生发展[5-8]。E-cadherin是一种广泛分布于上皮细胞的钙依赖性糖蛋白,其表达下降或缺失亦是肿瘤发生发展的重要因素[9]。目前国内外对于EHD2、E-cadherin在肝癌中的联合检测报道较少。本研究旨在检测EHD2、E-cadherin在肝癌组织中的表达,探讨其表达水平与肝癌患者临床病理学参数及预后的关系,为肿瘤治疗提供新的途径。
1 材料与方法
1.1 材料
110例肝癌组织石蜡切片标本收集自2005年1月至2009年12月就诊于南通大学附属医院普外科实施肝癌根治性切除术的患者,其中男性91例、女性19例,年龄23~70岁,平均年龄48岁。其中肝癌直径≤5 cm为52例,直径>5 cm为58例。组织分化程度:低分化43例,中分化46例,高分化21例。所有组织标本均经H&E染色病理诊断为原发性肝细胞肝癌,且标本切缘均>1 cm。所有患者均有完整的随访资料,且术前未进行化疗、放疗或者其他治疗。8例配对的新鲜肝癌及癌旁组织标本均于离体后30 min内置于-70℃冰箱内保存,作为后续蛋白提取。本研究通过南通大学附属医院伦理审查委员会的审查。
1.2 方法
1.2.1 Western blot实验 各取100 mg新鲜的肝癌及癌旁组织,加入RIPA裂解液提取组织蛋白,用BCA法测定蛋白浓度,加入制备好的SDS-PAGE上样缓冲液,经电泳、转膜后将PVDF膜置于脱脂牛奶中室温封闭2 h,孵育稀释的一抗EHD2(1:400)购自美国Santa Cruz公司,E-cadherin(1:1 000)购自美国Santa Cruz公司,GAPDH(1:1 000)购自美国Santa Cruz公司。4℃过夜,TBST洗膜后,室温孵育辣根过氧化物酶(HRP)标记的二抗2 h,经增强化学发光(ECL)荧光底物反应后,胶片曝光显影,扫描灰度。目的蛋白与内参灰度的比值即为目的蛋白的相对表达量。
1.2.2 免疫组织化学SP法染色 程序按照SP试剂盒说明书操作。所有的石蜡切片常规烤片、脱蜡、水化后,加入柠檬酸抗原修复液进行抗原修复,3%过氧化氢封闭10 min阻断内源性过氧化物酶,滴加稀释的一抗EHD2(1:100)购自美国Santa Cruz公司,E-cadherin(1:500)购自美国Santa Cruz公司,室温孵育1 h,磷酸盐缓冲液(PBS)洗涤后加入对应的二抗室温孵育30 min,PBS再次充分洗涤后DAB显色,苏木青衬染,0.1%HCL分化,梯度酒精、二甲苯脱水,中性树胶封片镜检。采用PBS代替一抗者作为阴性对照。
1.2.3 阳性结果判断标准 EHD2以细胞浆或细胞膜出现弥漫分布的棕黄色或棕黄色颗粒为阳性。E-cadherin以细胞膜出现棕黄色或者棕黄色颗粒为阳性,细胞质表达而细胞膜不表达者为阴性。双盲法读片。每张切片随机选取10个高倍视野(×200倍),分别计数100个细胞,总共计数1 000个细胞,得到阳性细胞百分比。阳性细胞百分比定义为1(<10%)、2(11~50%)、3(51~80%)、4(>80%)。染色强度评分定义为:0(阴性)、1分(弱阳性)、2分(阳性)、3分(强阳性)。最终染色评分以染色强度得分×阳性细胞百分比计算[10],0~4分为低表达,>4分为高表达。
1.3 统计学处理
统计学采用SPSS 21.0软件进行实验数据分析。EHD2、E-cadherin在肝癌组织中的表达和临床病理学参数之间的关系采用χ2检验分析,EHD2、E-cad⁃herin两者表达的相关性Spearman等级相关分析,生存曲线采用Kaplan-Meier法绘制。P<0.05为差异具有统计学意义。
2 结果
2.1 EHD2、E-cadherin在肝癌和癌旁组织中的表达
Western blot结果表明,EHD2、E-cadherin在癌旁组织中均可检测到表达,对应的肝癌组织中低表达或者缺失表达(图1)。免疫组织化学结果表明,EHD2、E-cadherin在肝癌组织中低表达或者缺失表达(图2A,B)。EHD2、E-cadherin在癌旁组织高表达,主要定位于细胞浆或者细胞膜,染色呈棕黄色(图2C,D)。


▶A.Expression of EHD2 and E-cadherin protein in eight fresh HCC specimens and adjacent noncancerous tissues. B.The preceding bar chart demonstrates the ratio of EHD2 and E-cadherin protein to GAPDH by densitometry; T:HCC tissues;N:adjacent noncancerous tissues图1 EHD2、E-cadherin在新鲜肝癌及癌旁组织中的表达Figure 1 EHD2 and E-cadherin expression in HCC tissues and adjacent noncancerous tissues
2.2 EHD2、E-cadherin的表达与肝癌临床病理因素的关系
肝癌组织中EHD2、E-cadherin的表达与组织分化程度、静脉侵袭及淋巴结转移密切相关(P<0.05),而与患者年龄、性别、肿瘤结节数目、肿瘤大小、肿瘤包膜、乙肝病毒感染、肝硬化、血清AFP等无相关性(表1)。
2.3 EHD2、E-cadherin在肝癌组织表达的相关性分析
在110例肝癌组织中对EHD2、E-cadherin的表达进行免疫组织化学染色分析,发现两者的表达在肝癌组织中存在正向变化趋势,Spearman等级相关分析显示两者的表达呈正相关(r=0.580,P<0.001)。
2.4 EHD2、E-cadherin对肝癌患者生存期的影响
经Kaplan-Meier法分析,EHD2高表达的53例患者生存率明显高于57例低表达或者缺失表达的患者(P<0.05,图3A),E-cadherin高表达的48例患者生存率也明显高于其62例低表达或者缺失表达的患者(P<0.05,图3B),且EHD2、E-cadherin同时高表达的40例患者生存率亦明显高于其他患者(n=70),预后较好(P<0.05,图3C)。
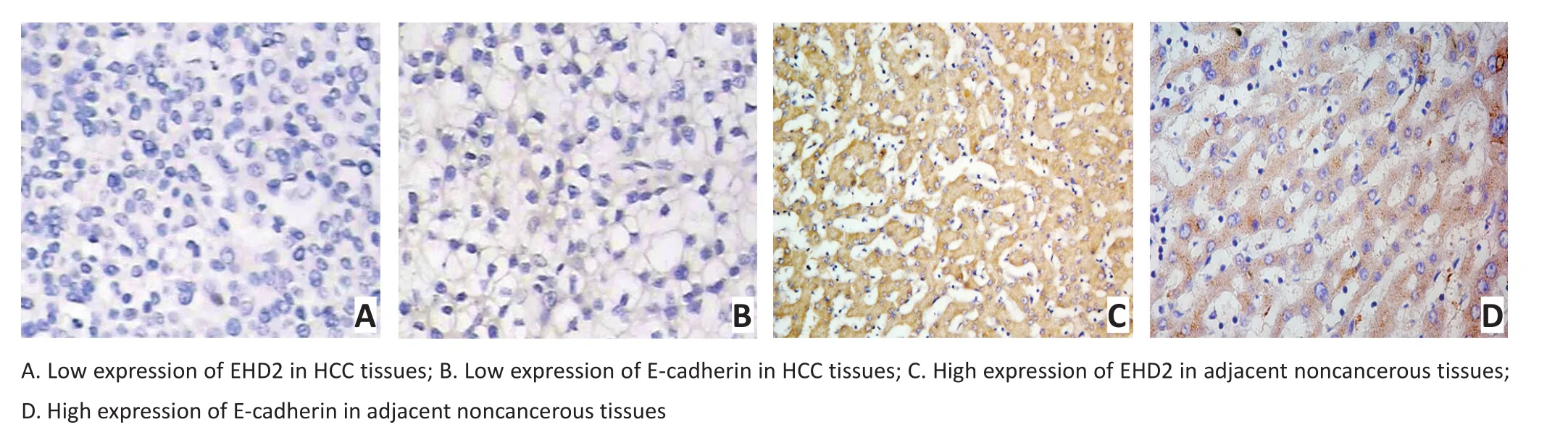
图2 EHD2、E-cadherin在肝癌和癌旁石蜡组织中的表达(SP×200)Figure 2 Expression of EHD2 and E-cadherin in HCC tissues and adjacent noncancerous tissues(SP×200)
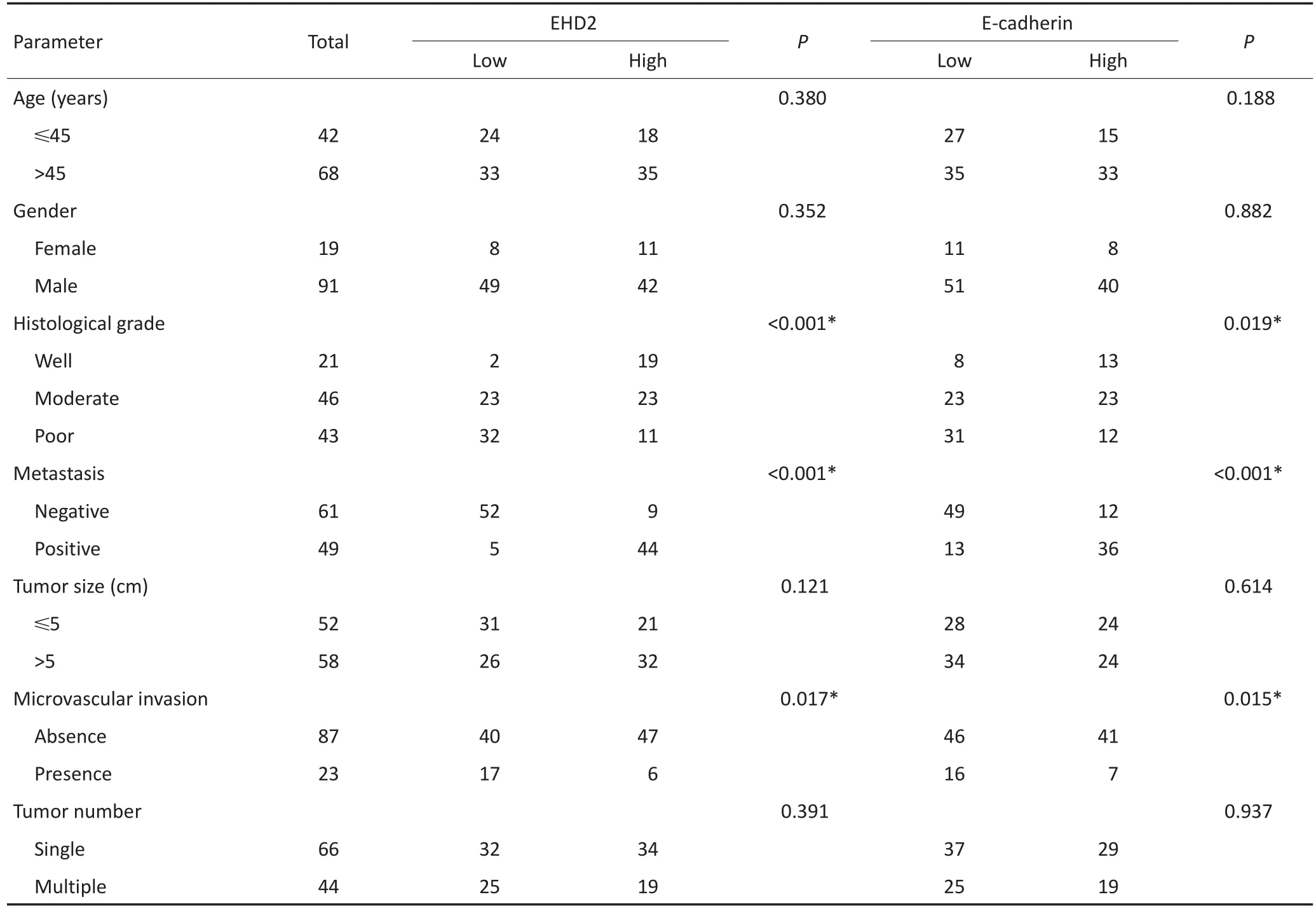
表1 肝癌中EHD2、E-cadherin表达水平与临床病理学参数的关系Table 1 Association of EHD2 and E-cadherin expression with clinicopathological parameters in 110 hepatocellular carcinoma specimens
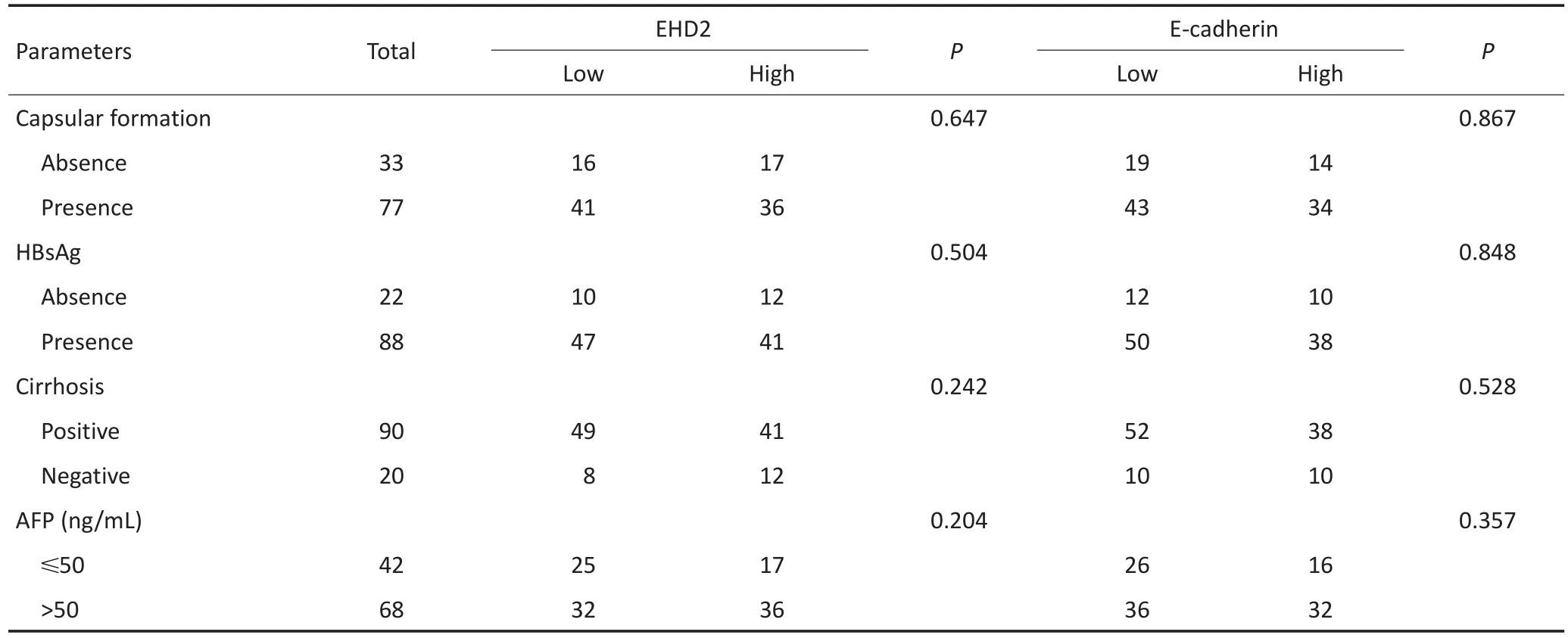
表1 肝癌中EHD2、E-cadherin表达水平与临床病理学参数的关系(续表1)Table 1 Association of EHD2 and E-cadherin expression with clinicopathological parameters in 110 hepatocellular carcinoma specimens

图3 EHD2、E-cadherin表达与患者生存率的关系Figure 3 Association of EHD2 and E-cadherin expression with the overall survival of HCC patients by Kaplan-Meier analysis
3 讨论
肝细胞肝癌是全球最常见的恶性肿瘤之一,是导致肿瘤相关性死亡的重要原因之一,特别是在亚洲[11]。尽管近年来肝癌发病率和死亡率有所降低,但是肝癌切除术后的患者5年生存率低,预后差[12]。目前对于肝细胞肝癌发生发展的精确分子机制尚未明确,因此探索研究在肝癌进程中所涉及的癌基因及抑癌基因可为设计分子生物学预防及治疗提供依据。
胞吞作用通过调节核信号、核转录和肿瘤致瘤性促进肿瘤的进展[13]。EHD2作为新发现的膜转运蛋白可以调节包括神经生长因子受体、类胰岛素生长因子受体等在内的多种受体的循环和胞吞,从而参与调节细胞黏附、形态发生、迁移和细胞分裂等生理病理过程[14-16]。文献报道EHD2能与参与肌动蛋白微丝组装的重要分子EHBP1相互作用,调节细胞骨架和极性从而促进肿瘤的恶性进展[17]。EHD2也能够与Nek3和Vav1相互作用调节Rac1的活性从而调节肌动蛋白重组促进胞吞作用影响肿瘤发生、浸润和转移[18]。近年研究发现,EHD2在多种肿瘤中均存在异常表达。EHD2在恶性浆液卵巢癌中表达明显降低[19],且在神经胶质瘤中作为抑癌基因缺失表达,EHD2在食管鳞状细胞癌中的表达障碍可以引起食管鳞状细胞结构的改变而促进其迁移。在乳腺癌中,EHD2的表达水平随着其肿瘤病理学分级的升高而逐渐降低,与其不良预后密切相关,且在乳腺癌细胞中抑制EHD2的表达可以促进E-cadherin表达下降和N-cadherin表达上调从而促进细胞的增殖和迁移,由此推测EHD2可以通过调节EMT的发生影响乳腺癌的进展。E-cadherin的缺失或降低也会影响细胞黏附,造成肿瘤扩散浸润转移,是肿瘤发展过程中的重要步骤[20]。但是两者在肝癌发生发展中的作用及相关性鲜有报道。
本研究通过Western blot检测8例新鲜的肝癌组织和癌旁组织中EHD2和E-cadherin的表达,结果显示两者存在差异性表达,且在肝癌组织中的表达显著低于癌旁组织的表达。通过免疫组织化学检测进一步证实了EHD2、E-cadherin在肝癌组织中低表达或者缺失表达,在癌旁组织中高表达,且差异具有统计学意义(P<0.05)。分析两者的表达与肝癌患者临床病理学参数之间的相关性,发现EHD2、E-cadherin的表达与肝癌的组织分化程度、静脉侵袭及淋巴结转移密切相关(P<0.05),且随着肿瘤组织分化程度的降低,静脉侵袭及淋巴结转移的出现,表达水平逐渐降低,而与年龄、性别、肿瘤结节数目、肿瘤大小、肿瘤包膜、乙肝病毒感染、肝硬化、血清AFP等参数无相关性。通过Kaplan-Meier法对患者生存时间及预后进行分析,提示EHD2高表达的患者生存率明显高于低表达或者缺失表达的患者(P<0.05),EHD2、E-cadherin同时高表达的患者生存率亦明显高于其他患者(P<0.05)。这些结果均表明EHD2、E-cadherin在肝癌组织中的表达与患者预后有关,可以作为判断患者预后的重要指标。此外,EHD2、E-cadherin在肝癌组织中的表达呈正相关(r=0.580,P<0.001),提示两者在肝癌的发生发展中可能存在协同作用。由于EHD2是可调节多种受体内吞的膜转运蛋白,且E-cadherin为重要的跨膜受体,推测两者之间存在相互作用,EHD2的表达下降可以促进E-cadherin的循环从而促进肝癌的进展。因此联合检测肝癌组织中EHD2、E-cadherin有助于判断肿瘤的恶性程度及进展,也为预后判断和辅助治疗提供了依据。
综上所述,本研究结果提示EHD2可能作为肝癌新的抑癌基因与E-cadherin协同在肝癌发生发展中发挥重要作用,是肝癌基因治疗潜在的靶点。但是EHD2协同E-cadherin参与肝癌发生发展的具体分子机制尚需要在肝癌细胞系中进行深入研究。
[1]Sun H,Gao Y,Lu K,et al.Overexpression of Klotho suppresses liver cancer progression and induces cell apoptosis by negatively regulating wnt/b-catenin signaling pathway[J].World J Surg Oncol,2015,13:307.
[2]Huang W,Chen Z,Shang X,et al.Sox12,a direct target ofFoxQ1, promotes hepatocellular carcinoma metastasis throughup-regulating Twist1 and FGFBP1[J].Hepatology,2015,61(6):1920-1933.
[3]Naslavsky N,Caplan S.EHD proteins:key conductors of endocytic transport[J].Trends Cell Biol,2011,21(2):122-131.
[4]Lu Q,Insinna C,Ott C,et al.Early steps in primary cilium assembly require EHD1/EHD3-dependent ciliary vesicle formation[J].Nat Cell Biol,2015,17(4):228-240.
[5]Yang X,Ren H,Yao L,et al.Role of EHD2 in migration and invasion of human breast cancer cells[J].TumourBiol,2015,36(5):3717-3726.
[6]Shi Y,Liu X,Sun Y,et al.Decreased expression and prognosticrole of EHD2 in human breastcarcinoma:correlation withE-cadherin[J]. J MolHistol,2015,46(2):221-231.
[7]Smith JS,Tachibana I,Pohl U,et al.A transcript map of thechromosome 19q-arm glioma tumor suppressor region[J].Genomics,2000, 64(2):44-50.
[8]Li M,Yang X,Zhang J,et al.Effects of EHD2 interference on migration of esophageal squamous cell carcinoma[J].Med Oncol,2013,30(1): 396.
[9]Kowalski PJ,Rubin MA,Kleer CG.E-cadherin expression in primary carcinomas of the breast and its distant metastases[J].Breast Cancer Res,2003,5(6):R217-R222.
[10]Liu LK,Jiang XY,Zhou XX,et al.Upregulation of vimentin and aberrant expression of E-cadherin/beta-catenin complex in oral squamous cell carcinomas:correlation with the clinicopathological features and patient outcome[J].Mod Pathol,2010,23(2):213-224.
[11]Liu J,Ni W,Xiao M,et al.Decreased expression and prognostic role of mitogen-activated protein kinase phosphatase 4 in hepatocellular carcinoma[J].J Gastrointest Surg,2013,17(4):756-765.
[12]Zhang S,Shi W,Chen Y,et al.Overexpression of SYF2 correlateswith enhanced cell growth and poor prognosis in humanhepatocellular carcinoma[J].Mol Cell Biochem,2015,410(1-2):1-9.
[13]Maritzen T,Schachtner H,Legler DF.On the move:endocytic trafficking in cell migration[J].Cell Mol Life Sci,2015,72(11):2119-2134.
[14]Park SY,Ha BG,Choi GH,et al.EHD2 interacts with the insulin-responsive glucose transporter(GLUT4)in rat adipocytes and may participate in insulin-induced GLUT4 recruitment[J].Biochem,2004, 43(23):7552-7562.
[15]Rotem-Yehudar R,Galperin E,Horowitz M.Association of insulin-like growth factor 1 receptor with EHD1 and SNAP29[J].J Biol Chem,2001, 276(35):33054-33060.
[16]Shao Y,Akmentin W,Toledo-Aral JJ,et al.Pincher,a pinocyticchaperone for nerve growth factor/TrkA signaling endosomes[J],J Cell Biol,2002,157(4):679-691.
[17]Guilherme A,Soriano NA,Bose S,et al.EHD2 and the novel EH domain binding protein EHBP1 couple endocytosis to the actin cytoskeleton[J].J Biol Chem,2004,279(11):10593-605.
[18]Benjamin S,Weidberg H,Rapaport D,et al.EHD2 mediates trafficking from the plasma membrane by modulating Rac1 activity[J].Biochem J,2011,439(3):433-442.
[19]Bignotti E,Tassi RA,Calza S,et al.Differential gene expression profiles between tumor biopsies and short-term primary cultures of ovarian serous carcinomas:identification of novel molecular biomarkers for early diagnosis and therapy[J].Gynecol Oncol,2006, 103(2):405-416.
[20]Gan WJ,Wang JR,Zhu XL.RARγ-induced E-cadherin downregulationpromotes hepatocellular carcinoma invasion and metastasis[J].J ExpClin Cancer Res,2016,35(1):164.
(2016-11-18收稿)
(2017-01-13修回)
Expression and correlation of EHD2 and E-cadherin in hepatocellular carcinoma
Jinxia LIU,Lishuai QU,Cuihua LU,Wenkai NI,Runzhou NI
Correspondence to:Runzhou NI;E-mail:Nirunzhou@yeah.net
Department of Gastroenterology,The Affiliated Hospital of Nantong University,Nantong 226001,China
This work was supported by the National Natural Science Foundation of China(No.81401985)
Objective:To investigate the expression and correlation of EHD2 and E-cadherin in hepatocellular carcinoma(HCC).Methods:Western blot and immunohistochemistry were used to detect the expression of EHD2 and E-cadherin in HCC specimens and adjacent noncancerous tissues.The correlations of EHD2 and E-cadherin with the clinicopathological characteristics and prognosis of patients were further analyzed using Pearson χ2test and Kaplan-Meier method.Results:EHD2 expression,along with E-cadherin,was markedly reduced in HCC tissues than in adjacent noncancerous tissues.Moreover,EHD2 and E-cadherin expression were correlated with histological grade,microvascular invasion,and lymph node metastasis(P<0.05).Kaplan-Meier survival analysis showed that HCC patients with decreased EHD2 and E-cadherin expression had shorter overall survival time than those with higher expression.Conclusion:The abnormal expression of EHD2 and E-cadherin possibly promote HCC.Detection of EHD2 and E-cadherin may be valuable for diagnosing HCC and evaluating malignancy extent and prognosis.
hepatocellular carcinoma,EHD2,E-cadherin,Western blot,immunohistochemistry

10.3969/j.issn.1000-8179.2017.03.329
南通大学附属医院消化内科(江苏省南通市226001)
*本文课题受国家自然科学基金项目(编号:81401985)资助
倪润洲 Nirunzhou@yeah.net
刘金霞 专业方向为肝细胞肝癌的分子生物学研究。
E-mail:liujinxia1985@yeah.net
