我国重要病原性真菌的耐药性研究现状
2017-03-02刘伟
刘伟
北京大学第一医院皮肤性病科,北京大学真菌和真菌病研究中心,皮肤病分子诊断北京市重点实验室,北京 100034
·特约专稿·
我国重要病原性真菌的耐药性研究现状
刘伟
北京大学第一医院皮肤性病科,北京大学真菌和真菌病研究中心,皮肤病分子诊断北京市重点实验室,北京 100034
近年来,病原性真菌的耐药现象越来越多,呈逐年上升趋势,且所致侵袭性感染已成为目前临床上患者死亡的重要原因之一。本文就我国在耐药性真菌的判断、流行病学、耐药机制及其防治等方面的研究现状进行简单介绍。
病原性真菌;耐药性;机制
近年来,各类广谱抗生素、皮质激素和免疫抑制剂在临床上的广泛应用,器官移植及导管技术的不断推广普及,以及艾滋病、糖尿病等疾病的发病率不断上升,免疫损伤患者逐渐增多。相应地,各种病原性真菌引起的机会性感染发生率正急剧上升,假丝酵母(又称念珠菌)已成为此类患者血液中分离出的最常见病原性真菌[1];且此类感染的病死率高,如骨髓移植受者中侵袭性曲霉病的死亡率高达70%~90%[2-3]。这种情况,一方面源于机体免疫状态严重受损,另一方面则与病原性真菌对抗真菌药物产生耐药性密切相关。本文简介我国重要病原性真菌的耐药性研究现状,希望对真菌感染的准确诊断和精准治疗提供帮助。
1 确定病原性真菌耐药性的方法
耐药真菌菌株通过抗真菌药敏试验确定,方法包括琼脂稀释法、纸片扩散法、E-test法、液基稀释法等。目前用于确定耐药菌株的方法是美国临床和实验室标准协会(Clinical Laboratory Standard Institute,CLSI)颁布的用于酵母的M27-A3和用于丝状真菌的M38-A2方案[4-5],以及由隶属于欧洲临床微生物学与感染性疾病学会的欧洲抗菌药物敏感试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)[6]颁布的抗真菌药敏试验方案。这些方案在培养基种类和酸碱度、孵育温度和时间、接种菌量、终点判读标准和质量控制等方面都做了统一规定,使得按照这些方案进行的试验及其结果在不同时间甚至不同实验室之间具有可重复性和可比性,客观性强。本实验室于1994年即开始在国内引进CLSI的建议方案、其后的一系列修订方案及目前的确定方案,通过实施研究课题、举办培训班、撰写论文等多种形式,向国内同行进行介绍和推广。截至目前,此客观方案已在我国得到普及和广泛应用。
譬如CLSI方案规定,试验用培养基为RPMI 1640液体培养基,酵母的接种量为(1~5)×103CFU/mL,丝状真菌为(1~5)×104CFU/mL,孵育温度为35 ℃,念珠菌和曲霉的孵育时间为48 h,隐球菌为72 h。每次试验前进行质量控制的菌株为ATCC 22019及ATCC 6258。该方案规定了根据氟康唑最低抑菌浓度(minimum inhibitory concentration,MIC)结果而进行白念珠菌、热带念珠菌等菌株敏感性判读的折点:≤8 μg/mL为敏感,16~32 μg/mL为剂量依赖敏感,≥64 μg/mL为耐药;也提供了伊曲康唑和伏立康唑对这些菌种的敏感性判读折点;同时强调指出,对于伊曲康唑的判读折点只适用于黏膜部位感染念珠菌的判读,涉及深部感染时必须依靠药物的血液浓度[4]。近几年,在深入研究的基础上,相关专家建议对白念珠菌、热带念珠菌及近平滑念珠菌可在孵育24 h后进行结果判读;还增加了棘白菌素类药物的标准,如表1所示[5]。这些改进可为临床更快速地提供参考信息,甚至对治疗药物的选择具有重要意义。遗憾的是,CLSI方案并未对丝状真菌药敏试验结果给出判读标准。
表1 CLSI液基稀释法抗真菌药敏试验方案中念珠菌药敏结果的判读标准
Tab.1 Interpretive guidelines forinvitrosusceptibility testing ofCandida. spp.
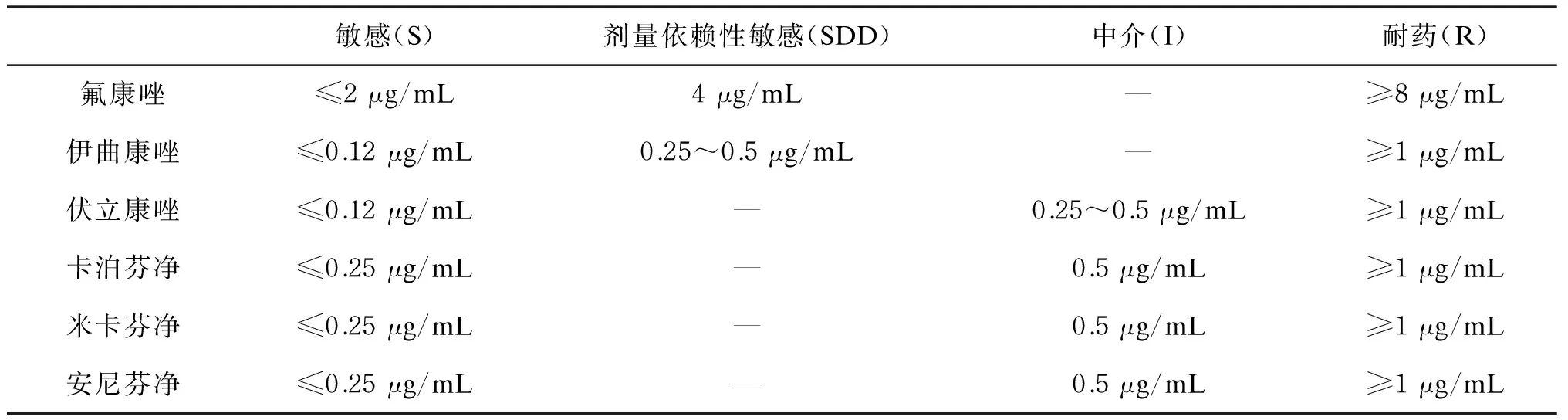
敏感(S)剂量依赖性敏感(SDD)中介(I)耐药(R)氟康唑≤2μg/mL4μg/mL—≥8μg/mL伊曲康唑≤0.12μg/mL0.25~0.5μg/mL—≥1μg/mL伏立康唑≤0.12μg/mL—0.25~0.5μg/mL≥1μg/mL卡泊芬净≤0.25μg/mL—0.5μg/mL≥1μg/mL米卡芬净≤0.25μg/mL—0.5μg/mL≥1μg/mL安尼芬净≤0.25μg/mL—0.5μg/mL≥1μg/mL
注:近平滑念珠菌的棘白菌素类药物判读折点:≤2 μg/mL为敏感;4 μg/mL为中介;≥8 μg/mL为耐药。
EUCAST方案的基本思路与CLSI方案非常相似,只是其接种密度是CLSI方案的100倍,RPMI液体培养基中葡萄糖含量为2%,是CLSI方案的10倍,孵育时间为24 h;且EUCAST方案较CLSI方案似乎更易检出耐药菌株。最近有学者基于EUCAST方案就曲霉对伊曲康唑和伏立康唑敏感性的判读折点给出建议:<2 μg/mL为敏感、=2 μg/mL为中介、>2 μg/mL为耐药[6]。该建议非常重要,对在目前病原性曲霉耐药菌株增多的情况下开展相关耐药性曲霉菌株的监测、耐药机制研究等有非常及时的指导作用。
2 病原性真菌耐药性的流行病学研究
自从20世纪90年代北京大学真菌和真菌病研究中心最早开始进行白念珠菌对唑类药物耐药性[7]研究以来,病原性真菌耐药性相关工作逐渐开展,包括对唑类药物耐药的临床菌株监测、耐药机制及生物膜形成的探讨等,还有对其他药物如丙烯胺类药物耐药性的研究[8]。这些工作集中在病原性真菌耐药现象的某一个具体方面,且显得比较零散。2009年7月由北京协和医院检验科牵头在全国开展的中国侵袭性真菌耐药监测网(CHIF-NET)启动,专门监测病原性酵母对氟康唑和伏立康唑敏感性的流行病学变迁。2012年的资料显示[9],超过94%的白念珠菌、热带念珠菌和近平滑念珠菌对药物敏感,12.2%的光滑念珠菌对氟康唑耐药,7株热带念珠菌对氟康唑和伏立康唑交叉耐药,31.9%的少见念珠菌和13.3%的非白念珠菌对氟康唑和伏立康唑耐药。2015年的资料显示[10],超过97.5%的近平滑念珠菌对唑类药物敏感,11.6%和9.5%的热带念珠菌分别对氟康唑和伏立康唑不敏感,14.3%的光滑念珠菌对氟康唑耐药,11.6%的光滑念珠菌对氟康唑和伏立康唑交叉耐药,2.3%的光滑念珠菌对安尼芬净耐药,但未检测到对唑类药物和棘白菌素类药物交叉耐药者。2009年11月—2011年4月,由全国63家医院67个重症监护室(intensive care unit,ICU)共同参加的“中国ICU念珠菌菌血症病原菌的分布和抗真菌药物敏感性评估”前瞻性研究(China-SCAN)调查了96 060例患者,确诊249例念珠菌菌血症,分离到389株病原性念珠菌;药物敏感性测定显示[11],15/156株白念珠菌对氟康唑耐药,7/156株白念珠菌对氟康唑呈剂量依赖性敏感,部分对伏立康唑和伊曲康唑交叉耐药,2株热带念珠菌对氟康唑耐药,2株光滑念珠菌对氟康唑耐药,48/50株光滑念珠菌对氟康唑不敏感,7/50株光滑念珠菌对卡泊芬净不敏感。这种情况使得两性霉素B成为治疗此类感染的唯一选择,已引起“全球抗击侵袭性真菌感染联盟”的关注[12]。该研究还发现了一些少见或罕见甚至国际上首次出现的念珠菌所致感染,如对两性霉素B和唑类药物均耐药的希木龙念珠菌所致感染。由于侵袭性真菌感染日益增多,抗真菌治疗也深入开展,使得病原性真菌的耐药性呈现上升趋势。因此,定期了解当地病原性真菌药物敏感性的流行病学特征,具有重要意义。
由烟曲霉、黄曲霉等病原性曲霉所致的侵袭性曲霉病是仅次于念珠菌感染的又一重要真菌感染性疾病。自1997年由Denning等[13]首先描述了烟曲霉对伊曲康唑的耐药性之后,病原性曲霉对唑类药物耐药性的报道越来越多。我国2005年首先由北京大学真菌和真菌病研究中心从1例肺结核后曲霉球患者的痰液标本中分离到对伊曲康唑耐药的烟曲霉系列菌株[14]。鉴于耐药性曲霉所致感染日益增多,本课题组从2008年开始对所有临床标本进行曲霉鉴定、药敏测定、菌株收藏和耐药机制的研究。截至目前,已分离到耐唑类药物的曲霉20余株,其中包括少见的耐药性黄曲霉、爪甲曲霉等,还构建了药物敏感性显著变化的曲霉突变株4株,系统演化性研究提示了这些曲霉耐药性的获得和传播规律。最近南京学者调查了我国不同城市中烟曲霉对唑类药物的耐药情况[15],从呼吸道感染标本中分离出4/72株耐伊曲康唑的烟曲霉。解放军疾病预防控制所的学者[16]在8个城市从2010—2015年的临床标本中分离出8/317株耐唑类药物的菌株,在13个城市从2014—2015年自然环境中分离出2/144株耐唑类药物的烟曲霉。这些工作反映了我国耐药性曲霉的分布和分离情况。由于耐药性曲霉所致疾病已成为全球性健康问题,包括本课题组在内的我国学者已加入了全球耐药性曲霉监测协作组。此外,我国学者基于酵母研究的启发,在烟曲霉中证实了协同调节麦角固醇合成和唑类药物敏感性的DAP蛋白家族[17],并描述了线粒体中一个钙离子输送体可能参与钙离子动态平衡、应激反应及对唑类药物的敏感性[18]。
3 病原性真菌耐药性的机制研究
白念珠菌是最重要的病原性真菌,且唑类药物是临床上最常用的抗真菌药物,因此白念珠菌对氟康唑的耐药最常见,有关白念珠菌对氟康唑的耐药机制在国际上也研究得最多、最清楚。目前,已明确的耐药机制有以下几方面[19]。①唑类药物作用靶酶的改变:唑类药物通过抑制真菌14α-脱甲基酶使麦角固醇合成受阻,导致真菌细胞膜的完整性受损而发挥抗真菌作用。在白念珠菌中,ERG11基因编码唑类药物作用靶酶,其突变和过度表达均可导致白念珠菌对氟康唑耐药。②药物外排泵的过度表达:与唑类药物耐药有关的外排泵有两类,一类是依赖ATP进行主动运输的ATP结合盒转运子(ATP binding cassette transporter,ABCT),包括Cdr1p和Cdr2p;另一类是通过电化学势能进行被动转运的主要易化子(major facilitator,MF)超家族成员,包括Mdr1p和Ful1p。这两类外排泵基因过度表达使细胞内积聚的氟康唑减少,最终引起对唑类药物耐药。此外,转录因子Tacp1和组蛋白去乙酰化酶也参与上述外排泵编码基因的过度表达。③麦角固醇合成途径下游蛋白失活:主要是ERG3基因突变后不能生成有活性的Δ-5,6去饱和酶,引起有毒性的固醇中间产物在真菌细胞内蓄积,最终导致耐药。④热休克蛋白90(heat shock protein 90,HSP90)通过钙调磷酸酶(calcineurin)途径:研究证实该途径可引起对唑类药物和棘白菌素类药物耐药并维持。
本实验室在我国最早开始进行白念珠菌对唑类药物耐药机制的研究,证实靶酶基因ERG11突变可导致对唑类药物的耐药性[7];其后我国陆续有学者证实靶酶基因ERG11的突变和高表达可导致白念珠菌、热带念珠菌、光滑念珠菌、克柔念珠菌对氟康唑、伊曲康唑、伏立康唑等唑类药物耐药[20-22],由转录因子TAC突变所致的CDR1、CDR2和PDR17高表达可引起白念珠菌对唑类药物耐药[23]。白念珠菌可通过Rta2P参与的钙调磷酸酶途径来降低对氟康唑的敏感性[24-26]。还有学者在我国确定白念珠菌染色体R的三体型亦可导致对三唑类药物耐药[27]。这些工作丰富了病原性念珠菌对唑类药物耐药的机制。
随着耐唑类药物的病原性曲霉日益增多,我国学者于2005年在我国首先证实唑类药物作用靶酶cyp51A基因突变所致的M220和G54氨基酸置换能导致对伏立康唑和伊曲康唑耐药[14];其后,我国还分离到cyp51A基因启动子区34 bp的串联重复序列联合编码区突变所致L98H氨基酸置换(TR34/L98H基因型)及该基因启动子区46 bp的串联重复序列联合编码区突变所致Y121F和T289A氨基酸置换(TR46/Y121F/T289A)的耐唑类药物的烟曲霉[15-16,28],这些突变已被国外学者证实是导致耐药的原因。此外,本课题组在我国首次揭示引起侵袭性曲霉病的耐伏立康唑的黄曲霉中cyp51C基因T778G错义突变是黄曲霉耐伏立康唑的机制[29],还确定曲霉生物膜对各种抗真菌药物的敏感性明显下降[30]。
4 耐药性真菌的检测及其相关感染的防治
耐药性真菌常导致治疗失败,因此利用先进手段快速检测耐药菌株对临床选择合理的抗真菌药物具有重要的指导作用。例如,基于临床上对唑类药物耐药的烟曲霉主要由唑类药物靶酶基因突变所致,包括我国在内的各国学者及时发展了检测耐药性烟曲霉的实时聚合酶链反应(polymerase chain reaction,PCR)方法[31]。
此外,探索杀伤耐药菌株的有效方法是临床上战胜耐药菌株感染的有效措施。我国学者发现小檗碱(黄连素)可降低耐药性念珠菌CDR1基因的过度表达[32],且黄连素、黄岑素(baicalein)等与氟康唑对耐药性念珠菌具有协同抑制作用[33-34]。本课题组确定了格尔德霉素与氟康唑对耐药性念珠菌具有协同抑制作用[35-36],卡泊芬净与伏立康唑、两性霉素B对耐药的曲霉生物膜具有协同抑制作用[30],还在国际上首先确定了He/O2(2%)低温等离子体可杀伤耐药的病原性真菌及其生物膜[37-38]。
5 结语
近年来病原性真菌耐药现象越来越多,我国的耐药情况具有独特性。我们应重视基础研究与临床工作的密切结合,加强临床各科、各专业之间的配合与协作,从而在耐药性机制、耐药菌株检测及逆转耐药性方面作出确实有效的成绩。
[1] Arendrup MC. Candida and candidaemia. Susceptibility and epidemiology [J]. Dan Med J, 2013, 60(11): B4698.
[2] Kontoyiannis DP, Bodey GP. Invasive aspergillosis in 2002: an update [J]. Eur J Clin Microbiol Infect Dis, 2002, 21(3): 161-172.
[3] Denning DW. Invasive aspergillosis [J]. Clin Infect Dis, 1998, 26(4): 781-803.
[4] Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts: Approved standard M27-A3 [M]. Pennsylvania: Clinical and Laboratory Standards Institute, 2008.
[5] Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi: Approved standard [M]. 2nd ed. Pennsylvania: Clinical and Laboratory Standards Institute, 2008.
[6] Verweij PE, Howard SJ, Melchers WJ, Denning DW. Azole-resistance in Aspergillus: proposed nomenclature and breakpoints [J]. Drug Resist Updat, 2009, 12(6): 141-147.
[7] 王文莉,李若瑜,王端礼,万哲,王晓红,李世荫,朱立煌. 念珠菌对唑类药物耐药机理的探讨 [J]. 中华皮肤科杂志,1997,30(5):306-309.
[8] 刘伟,李若瑜,卜定方,王端礼,马圣清. 耐特比萘芬的白念珠菌角鲨烯环氧化酶基因开放读框的克隆及序列分析 [J]. 北京大学学报(医学版),2002,34(6):735-736.
[9] Wang H, Xiao M, Chen SC, Kong F, Sun ZY, Liao K, Lu J, Shao HF, Yan Y, Fan H, Hu ZD, Chu YZ, Hu TS, Ni YX, Zou GL, Xu YC. In vitro susceptibilities of yeast species to fluconazole and voriconazole as determined by the 2010 National China Hospital Invasive Fungal Surveillance Net (CHIF-NET) study [J]. J Clin Microbiol, 2012, 50(12): 3952-3959.
[10] Xiao M, Fan X, Chen SC, Wang H, Sun ZY, Liao K, Chen SL, Yan Y, Kang M, Hu ZD, Chu YZ, Hu TS, Ni YX, Zou GL, Kong F, Xu YC. Antifungal susceptibilities of Candida glabrata species complex, Candida krusei, Candida parapsilosis species complex and Candida tropicalis causing invasive candidiasis in China: 3 year national surveillance [J]. J Antimicrob Chemother, 2015, 70(3): 802-810.
[11] Liu W, Tan J, Sun J, Xu Z, Li M, Yang Q, Shao H, Zhang L, Liu W, Wan Z, Cui W, Zang B, Jiang D, Fang Q, Qin B, Qin T, Li W, Guo F, Liu D, Guan X, Yu K, Qiu H, Li R; China-SCAN team. Invasive candidiasis in intensive care units in China: in vitro antifungal susceptibility in the China-SCAN study [J]. J Antimicrob Chemother, 2014, 69(1): 162-167.
[12] GAFFI. Resistance (AMR) in Candida glabrata reaching epic proportions [EB/OL]. [2014-01-29]. http://www.gaffi.org / resistance-amr-in-candida-glabrata-reaching-epic-proportions/.
[13] Denning DW, Venkateswarlu K, Oakley KL, Anderson MJ, Manning NJ, Stevens DA, Warnock DW, Kelly SL. Itraconazole resistance in Aspergillus fumigatus [J]. Antimicrob Agents Chemother, 1997, 41(6): 1364-1368.
[14] Chen J, Li H, Li R, Bu D, Wan Z. Mutations in the cyp51A gene and susceptibility to itraconazole in Aspergillus fumigatus serially isolated from a patient with lung aspergilloma [J]. J Antimicrob Chemother, 2005, 55(1): 31-37.
[15] Liu M, Zeng R, Zhang L, Li D, Lv G, Shen Y, Zheng H, Zhang Q, Zhao J, Zheng N, Liu W. Multiple cyp51A-based mechanisms identified in azole-resistant isolates of Aspergillus fumigatus from China [J]. Antimicrob Agents Chemother, 2015, 59(7): 4321-4325.
[16] Chen Y, Lu Z, Zhao J, Zou Z, Gong Y, Qu F, Bao Z, Qiu G, Song M, Zhang Q, Liu L, Hu M, Han X, Tian S, Zhao J, Chen F, Zhang C, Sun Y, Verweij PE, Huang L, Han L. Epidemiology and molecular characterizations of azole resistance in clinical and environmental Aspergillus fumigatus isolates from China [J]. Antimicrob Agents Chemother, 2016, 60(10): 5878-5884.
[17] Song J, Zhai P, Zhang Y, Zhang C, Sang H, Han G, Keller NP, Lu L. The Aspergillus fumigatus damage resistance protein family coordinately regulates ergosterol biosynthesis and azole susceptibility [J]. MBio, 2016, 7(1): e01919-15. doi: 10.1128/mBio.01919-15.
[18] Song J, Liu X, Zhai P, Huang J, Lu L. A putative mitochondrial calcium uniporter in A.fumigatus contributes to mitochondrial Ca2+homeostasis and stress responses [J]. Fungal Genet Biol, 2016, 94: 15-22. doi: 10.1016/j.fgb.2016.07.001.
[19] 谭静文,冯丽娟,李若瑜,刘伟. 白念珠菌唑类药物作用靶酶在菌株唑类耐药机制中的作用 [J]. 中华微生物学和免疫学杂志,2014,34(4):323-326.
[20] Xu Y, Chen L, Li C. Susceptibility of clinical isolates of Candida species to fluconazole and detection of Candida albicans ERG11 mutations [J]. J Antimicrob Chemother, 2008,61(4): 798-804.
[21] He X, Zhao M, Chen J, Wu R, Zhang J, Cui R, Jiang Y, Chen J, Cao X, Xing Y, Zhang Y, Meng J, Deng Q, Sui T. Overexpression of both ERG11 and ABC2 genes might be responsible for itraconazole resistance in clinical isolates of Candida krusei [J]. PLoS One, 2015, 10(8): e0136185.
[22] Tan J, Zhang J, Chen W, Sun Y, Wan Z, Li R, Liu W. The A395T mutation in ERG11 gene confers fluconazole resistance in Candida tropicalis causing candidemia [J]. Mycopathologia, 2015, 179(3-4): 213-218.
[23] 李丽娟,李若瑜,刘伟. TAC1在白念珠菌对抗真菌药物产生耐药性中的作用 [J]. 中国医药生物技术,2008,3(6):451-453.
[24] Wang L, Jia Y, Tang RJ, Xu Z, Cao YB, Jia XM, Jiang YY. Proteomic analysis of Rta2p-dependent raft-association of detergent-resistant membranes in Candida albicans [J]. PLoS One, 2012, 7(5): e37768.
[25] Jia Y, Tang RJ, Wang L, Zhang X, Wang Y, Jia XM, Jiang YY. Calcium-activated-calcineurin reduces the in vitro and in vivo sensitivity of fluconazole to Candida albicans via Rta2p [J]. PLoS One, 2012, 7(10): e48369.
[26] Zhang SQ, Miao Q, Li LP, Zhang LL, Yan L, Jia Y, Cao YB, Jiang YY. Mutation of G234 amino acid residue in Candida albicans drug-resistance-related protein Rta2p is associated with fluconazole resistance and dihydrosphingosine transport [J]. Virulence, 2015, 6(6): 599-607.
[27] Li X, Yang F, Li D, Zhou M, Wang X, Xu Q, Zhang Y, Yan L, Jiang Y. Trisomy of chromosome R confers resistance to triazoles in Candida albicans [J]. Med Mycol, 2015, 53(3): 302-309.
[28] Chen Y, Wang H, Lu Z, Li P, Zhang Q, Jia T, Zhao J, Tian S, Han X, Chen F, Zhang C, Jia X, Huang L, Qu F, Han L. Emergence of TR46/Y121F/T289A in an Aspergillus fumigatus isolate from a Chinese patient [J]. Antimicrob Agents Chemother, 2015, 59(11): 7148-7150.
[29] Liu W, Sun Y, Chen W, Liu W, Wan Z, Bu D, Li R. The T788G mutation in the cyp51C gene confers voriconazole resistance in Aspergillus flavus causing aspergillosis [J]. Antimicrob Agents Chemother, 2012, 56(5): 2598-2603.
[30] Liu W, Li L, Sun Y, Chen W, Wan Z, Li R, Liu W. Interaction of the echinocandin caspofungin with amphotericin B or voriconazole against Aspergillus biofilms in vitro [J]. Antimicrob Agents Chemother, 2012, 56(12): 6414-6416.
[31] Xu H, Chen W, Li L, Wan Z, Li R, Liu W. Clinical itraconazole-resistant strains of Aspergillus fumigatus, isolated serially from a lung aspergilloma patient with pulmonary tuberculosis, can be detected with real-time PCR method [J]. Mycopathologia, 2010, 169(3): 193-199.
[32] Zhu SL, Yan L, Zhang YX, Jiang ZH, Gao PH, Qiu Y, Wang L, Zhao MZ, Ni TJ, Cai Z, Tian SJ, Zang CX, Zhang DZ, Jiang YY. Berberine inhibits fluphenazine-induced up-regulation of CDR1 in Candida albicans [J]. Biol Pharm Bull, 2014, 37(2): 268-273.
[33] Quan H, Cao YY, Xu Z, Zhao JX, Gao PH, Qin XF, Jiang YY. Potent in vitro synergism of fluconazole and berberine chloride against clinical isolates of Candida albicans resistant to fluconazole [J]. Antimicrob Agents Chemother, 2006, 50(3): 1096-1099.
[34] Huang S, Cao YY, Dai BD, Sun XR, Zhu ZY, Cao YB, Wang Y, Gao PH, Jiang YY. In vitro synergism of fluconazole and baicalein against clinical isolates of Candida albicans resistant to fluconazole [J]. Biol Pharm Bull, 2008, 31(12): 2234-2236.
[35] Zhang J, Liu W, Tan J, Sun Y, Wan Z, Li R. Antifungal activity of geldanamycin alone or in combination with fluconazole against Candida species [J]. Mycopathologia, 2013, 175(3-4): 273-279.
[36] Li Y, Wan Z, Liu W, Li R. Synergistic activity of chloroquine with fluconazole against fluconazole-resistant isolates of Candida species [J]. Antimicrob Agents Chemother, 2015, 59(2): 1365-1369.
[37] Sun P, Sun Y, Wu H, Zhu W, Lopez JL, Liu W, Zhang J, Li R, Fang J. Atmospheric pressure cold plasma as an antifungal therapy [J]. Appl Phys Lett, 2011, 98: 021501. doi:10.1063/1.3530434.
[38] Sun Y, Yu S, Sun P, Wu H, Zhu W, Liu W, Zhang J, Fang J, Li R. Inactivation of Candida biofilms by non-thermal plasma and its enhancement for fungistatic effect of antifungal drugs [J]. PLoS One, 2012, 7(7): e40629.
. LIU Wei, E-mail: liuwei@bjmu.edu.cn
Research progress on resistant pathogenic fungi in China
LIU Wei
DepartmentofDermatologyandVenereology,PekingUniversityFirstHospital,ResearchCenterforMedicalMycology,BeijingKeyLaboratoryofMolecularDiagnosisonDermatoses,PekingUniversity,Beijing100034,China
Antifungal resistance has increased rapidly in recent years. The invasive fungal infections caused by the resistant pathogenic fungi have become one of the important reasons resulting in death of patients. In this review, we briefly described the current status concerning defining criteria, epidemiology, resistant mechanisms and treating strategies for resistant fungi in China.
Pathogenic fungus;Drug resistance;Mechanism
国家自然科学基金(81471925)
刘伟
2016-11-10)
