小麦干热风抗性鉴定及热胁迫相关基因TaHSPs的表达分析
2017-03-01李美玲孙爱清张杰道王振林陈蕾太陈路路马雪丽尹燕枰
李美玲,孙爱清,杨 敏,张杰道,王振林,陈蕾太,陈路路,马雪丽,尹燕枰
(山东农业大学农学院/作物生物学国家重点实验室/山东省作物生物学重点实验室,山东泰安 271018)
小麦干热风抗性鉴定及热胁迫相关基因TaHSPs的表达分析
李美玲,孙爱清,杨 敏,张杰道,王振林,陈蕾太,陈路路,马雪丽,尹燕枰
(山东农业大学农学院/作物生物学国家重点实验室/山东省作物生物学重点实验室,山东泰安 271018)
为鉴定黄淮麦区小麦品种干热风抗性以及不同抗性品种热激蛋白(TaHSPs)基因的表达差异,以98个小麦品种为试验材料,于花后10~20 d进行人工模拟干热风处理,通过测定小麦不同生长时期的叶绿素含量、收获后的千粒重与籽粒品质,评价不同品种干热风抗性;对筛选出的干热风抗性不同的品种在出苗15 d进行热胁迫处理,通过荧光定量PCR测定热胁迫0~4.5 h内TaHSPs基因表达量的变化。结果表明,干热风处理后,供试小麦品种旗叶的叶绿素含量均降低,高抗干热风品种降幅较小,热敏感型品种降幅较大;供试小麦品种的千粒重均降低。山农23号等3个品种达到高、中抗干热风等级,且抗性比较稳定,师栾02-1为热敏感型品种。干热风处理后籽粒蛋白质含量升高,总淀粉含量降低,抗干热风小麦品种总淀粉相对含量降幅较小。不同小麦品种幼苗在热胁迫0~4.5 h期间,TaHSPs基因表达量均为抛物线趋势,抗干热风品种在热胁迫1 h时 TaHSP16.9基因表达上调幅度大于热敏感型品种。对于 TaHSP17.8基因,抗干热风品种在热胁迫期间,上调表达反应时间均早于热敏感型品种;在热胁迫0.5 h时,山农23号、周麦18与泰山9818三个抗干热风品种基因表达均上调至590倍以上,而师栾02-1与济南17号的上调幅度在300倍以下。对于 TaHSP23.6基因,山农23号的上调表达峰值远高于其他品种。对于 TaHSP26.6基因,热敏感型品种在热胁迫后期的上调倍数高于抗干热风品种,师栾02-1与济南17号两个热敏感型品种在热胁迫4.5 h时上调幅度均在4 000倍以上,而抗干热风品种山农23号、周麦18与泰山9818上调幅度均在3 000倍以下。
小麦;干热风;千粒重;抗逆指数;热激蛋白
干热风是中国北方麦区的主要气象灾害之一,发生在每年5月中下旬到6月初的高温少雨天气,此时正值小麦灌浆期,高温低湿使得籽粒灌浆期缩短,造成小麦产量、品质严重下降。高温对小麦产量和穗粒数有显著影响[1],对籽粒蛋白质的影响也明显高于水分、干旱等其他胁迫对蛋白质的影响[2-3]。高温主要通过影响小麦淀粉的形成而影响其品质,蛋白质相对含量的提高也与淀粉合成减少有关[4-6]。刘 萍等[4]研究表明,灌浆期温度超过30 ℃,小麦淀粉的形成受到抑制,且在花后25~27 d受影响程度最大。李永庚等[5]研究表明,灌浆后期高温会提高小麦蛋白质的含量,主要原因是籽粒淀粉积累减少。
防御干热风的关键在于选用适宜当地播种的抗干热风品种,因此,鉴定、筛选抗干热风小麦品种、研究其抗性相关指标具有重要意义。仪小梅等[7]于2011-2013年以旗叶功能期抗逆指数和千粒重抗逆指数为鉴定指标,对黄淮麦区部分小麦品种进行了干热风抗性鉴定,筛选出一批干热风抗性好的品种。有研究表明,叶绿素是评价植物抗逆境胁迫、尤其是热胁迫的一个关键性指标[8-10]。Kumar等[11]认为,从分子生物学角度研究小麦抗性,是当前研究小麦抵御高温危害的趋势。不同基因型小麦的耐热性不同,可能与热激蛋白的表达、转录因子以及其他相关基因有关[12]。Miller等[13]研究表明,热激蛋白可以通过提高植物的光合效率、改变同化物的分配、提高水分和营养成分的利用效率、增强细胞膜稳定性等生理作用提高植物体应对高温胁迫的能力[14]。在热激蛋白中,12~45 kD小分子量热激蛋白种类最丰富,且在植物生长的各个阶段都有分布,植物在遭遇高温时,其表达量会在短时间内异常升高,是植物耐高温胁迫的关键[15-16]。郭秀林等[17]研究表明,耐热小麦品种受高温胁迫后会激发更强的抗性基因表达。Lee等[18]发现, EsHSP16.9基因表达量升高可以提高野生黑麦的抗逆性。Abu-Romman[19]研究发现, TdHSP23.5 与 TdHSP26.5基因在高抗性小麦品种中表达量高于低抗品种。上述研究主要涉及高温对小麦产量和品质或对小麦品种某个热激蛋白的影响,而在田间模拟干热风胁迫鉴定小麦品种的干热风抗性,并利用多个热抗性不同的品种同时分析多个热激蛋白表达的报道较少。本研究在仪小梅等[7]研究的基础上,田间模拟干热风胁迫,根据传统指标对黄淮麦区小麦品种干热风抗性进行鉴定,并利用分子生物学方法研究干热风抗性不同的多个小麦品种的小分子热激蛋白基因(TaHSPs)的表达差异,分析小麦干热风抗性与TaHSPs基因表达的关系,以期为小麦品种的合理布局和灌浆期小麦干热风抗性鉴定提供参考依据。
1 材料与方法
1.1 试验材料
供试材料为98个小麦品种,分别于2014、2015两年进行鉴定,部分品种在两年内均有鉴定,详情见表1。

表1 供试小麦品种Table 1 Wheat cultivars tested in this study
1~10:两年重复鉴定品种;11~60:2014年鉴定品种;61~98:2015年鉴定品种。
1-10:Wheat cultivars with repetitive identification in two years; 11-60:Wheat cultivars identified in 2014; 61-98:Wheat cultivars identified in 2015.
1.2 试验设计
灌浆期干热风处理试验于2013-2014和2014-2015两个小麦生长季在山东农业大学农学试验站完成。试验采用裂区设计,主区为干热风处理,副区为品种,以正常生长为对照;3次重复。于小麦花后10 d进行人工模拟干热风处理,处理时间为每天9:00~16:00,通过人工气候室中智能控温、控湿系统控制温、湿度,温度低于38 ℃系统自动加温,温度高于40 ℃时,手动开窗散热,连续10 d进行模拟干热风处理。期间采用Davis气象仪记录温、湿度等气象数据。
在预试验基础上,选取小麦品种周麦18、山农23号、潍麦9903、鲁麦23号、藁城8901、沧麦6003、师栾02-1及济南17号用于灌浆期干热风处理期间叶绿素的测定。
山农23号、周麦18、泰山9818、师栾02-1及济南17号用于苗期高温诱导相关基因TaHSPs的表达测定。苗期TaHSPs基因的表达测定于2015年9月18日至2015年10月6日在山东农业大学国家重点实验室进行。选取饱满一致的种子,点播于穴盘的基质中,待幼苗在室外长至10 d后,转移至光照培养箱中继续培养。光暗比14/10,温度22/17 ℃,相对湿度为60%,培养5 d后分别置于38 ℃和25 ℃培养箱,分别于处理0、0.5、1.0、1.5、2.5、3.5、4.5 h后剪取小麦叶片于2 mL离心管中,液氮速冻后保存于-80 ℃冰箱中备用。3次重复。
1.3 测定项目与方法
1.3.1 叶绿素和千粒重测定
叶绿素含量测定:在小麦抽穗期选取长势一致的穗子挂牌标记,每个品种标记20个单茎,利用SPAD 502叶绿素仪测定小麦干热风处理前、中、后期旗叶的SPAD值。
千粒重测定:选用百粒法测千粒重。
1.3.2 小麦品种抗性评定
采用仪小梅等[7]提出的千粒重抗逆指数评价小麦干热风抗性,抗逆指数≥100为高抗干热风品种(HR),90~99之间为中抗干热风品种(R),80~89之间为低抗干热风品种(LR),小于80为敏感干热风品种(S)。
1.3.3 品质性状的测定
用近红外谷物分析仪测定不同小麦品种籽粒淀粉、蛋白质含量,3次重复。
1.3.4 基因表达量的测定
采用荧光定量PCR方法测定1.2中于-80 ℃保存小麦叶片的小分子热激蛋白基因 TaHSP16.9、 TaHSP17.8、 TaHSP23.6、 TaHSP26.6的表达量。扩增体系为20 μL,10 μmol·L-1的上下游引物各0.4 μL,10 μL 2×SYBR,0.4 μL ROX Reference Dye,2 μL稀释后的cDNA,用ddH2O补足至20 μL。PCR扩增程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃ 30 s;75 ℃ 34 s,40个循环。RNA的提取按照RNAiso Plus C Takara说明书进行。用紫外分光光度计测量RNA浓度与纯度;用1%琼脂糖凝胶电泳法检测RNA的完整性。RNA的反转录试剂盒(RR047A)与荧光定量试剂盒(RR420A)均购自大连宝生物工程有限公司。所用引物见表2,由北京六合华大基因科技有限公司合成。
1.4 数据分析
用Microsoft Excel 2003进行数据分析与作图,用DPS v7.05进行差异显著性分析。

表2 小分子热激蛋白基因表达分析所用引物Table 2 Primers used in the expression analysis of TaHSPs gene
2 结果与分析
2.1 干热风对小麦旗叶SPAD值的影响
由图1可知,小麦灌浆期经干热风处理后,不同抗性品种旗叶的SPAD值均有不同程度下降,处理前期下降缓慢,后期下降幅度较大;藁城8901、沧麦6003、师栾02-1、济南17号4个热敏感型品种叶绿素含量下降幅度较大,在热胁迫10 d后SPAD值低于周麦18、山农23号、潍麦9903、鲁麦23号4个抗干热风品种。其中,干热风抗性强的山农23号旗叶的SPAD值大于50,降低幅度最小。

Gaocheng 8901:藁城8901;Cangmai 6003:沧麦6003;Shiluan 02-1:师栾02-1;Jinan 17:济南17号;Zhoumai 18:周麦18;Shannong 23:山农23号;Weimai 9903:潍麦9903;Lumai 23:鲁麦23号。

图1 8个小麦品种经干热风处理不同时期后旗叶的叶绿素含量
DH:干热风处理;CK:对照;HR:高抗干热风;R:中抗干热风;LR:低抗干热风;S:干热风敏感型。同一品种数据后不同字母表示处理与对照在5%水平下差异显著。表4至表8同。
DH:Dry-hot wind treatment; CK:Control;TKW:Thousand kernal weight;AITKW:Adversity index of TKW;HR:High resistant to dry-hot wind; R:Resistant to dry-hot wind; LR:Low resistant to dry-hot wind; S:Sensitive to dry-hot wind. Different letters following data of the same variety mean significant difference at 5% level between dry-hot wind stress and CK. The same in table 4-8.
2.2 干热风对小麦千粒重的影响
由表3、表4可知,98个小麦品种经干热风处理后,千粒重均有不同程度下降。2014年的运旱2129、京冬8号等4个品种与2015年的山农23号、丰德存麦1号等5个品种经干热风处理后,千粒重平均下降6 g左右,抗逆指数达到100%以上,属高抗干热风品种;2014年的济宁16、潍麦9903等8个小麦品种与2015年的周麦18、豫农211等8个小麦品种千粒重平均下降7.6 g左右,抗逆指数达到90%以上,属中抗干热风品种。2014年的邯6172、鲁原502等16个小麦品种与2015年的鑫289、冀5265等13个小麦品种千粒重平均下降8 g左右,抗逆指数大于80%,为低抗干热风品种。2014年的洛麦21号与济核916等32个小麦品种与2015年的鲁麦15、中育12等22个品种千粒重平均下降10 g以上,抗逆指数均小于80%,为热敏感型品种,占到供试品种的二分之一。
共10个品种在2014与2015年均有鉴定,其中山农23号、运旱2129与周麦18三个品种在两年抗性鉴定中的抗逆指数均达到90%以上,抗性比较稳定,属于抗干热风品种;冀5265、鲁麦23号、沧麦119、济宁16号与中优9507五个品种在两年抗性鉴定中,抗性表现不稳定,2014年表现为中抗与高抗干热风,2015年表现为低抗干热风;2014年筛选出的热敏感型小麦品种师栾02-1,在2015年的重复鉴定中,抗逆指数在70%以下,抗性表现仍比较差。

表4 2015年鉴定小麦品种的千粒重及其抗逆指数与抗性等级Table 4 Classification of wheat cultivars in 2015 based on adversity resistance index of 1 000-kernel weight
2.3 干热风对小麦品质的影响
2.3.1 干热风对蛋白质含量的影响
表5、表6显示,98个小麦品种中,除2014年鉴定的中优9507、鲁麦23号2个品种和2015年鉴定的山农23号等6个品种,其余品种的蛋白质含量经干热风处理后均升高。2014年鉴定品种中(表5),蛋白质含量增幅在-1.73%~26.67%之间,其中,中优9507蛋白质含量变化最小,仅比对照降低0.25%,而豫麦34变化幅度最大,在干热风处理后,蛋白质含量升高26.67%。2015年鉴定品种中(表6),蛋白质含量变化幅度在-11.43%~19.64%之间,其中,沧麦119变化幅度最小,蛋白质相对含量仅比对照高0.64%,而菏麦17变化幅度最大,处理后升高19.64%。
蛋白质含量的增幅与干热风抗性等级存在一定关系,2014年鉴定的小麦品种中(表5),高抗小麦品种(HR)经干热风处理后,蛋白质含量增幅均在10%以下,而大部分热敏感型品种(S)蛋白质含量增幅均15%以上,甚至高于20%。表6显示,2015年鉴定的小麦品种中,高抗干热风品种(HR)的蛋白质含量增幅均在10%以下,同样,大部分的热敏感型品种(S)蛋白质含量增幅在15%以上。高抗干热风品种经干热风处理后蛋白质含量升高幅度显著低于热敏感型品种(P<0.05)。对两年鉴定小麦品种的抗逆指数与蛋白质含量增幅分别进行相关性分析发现,2014年、2015年鉴定品种的相关系数分别为-0.681与-0.659(P≤0.01),均表现为极显著负相关。
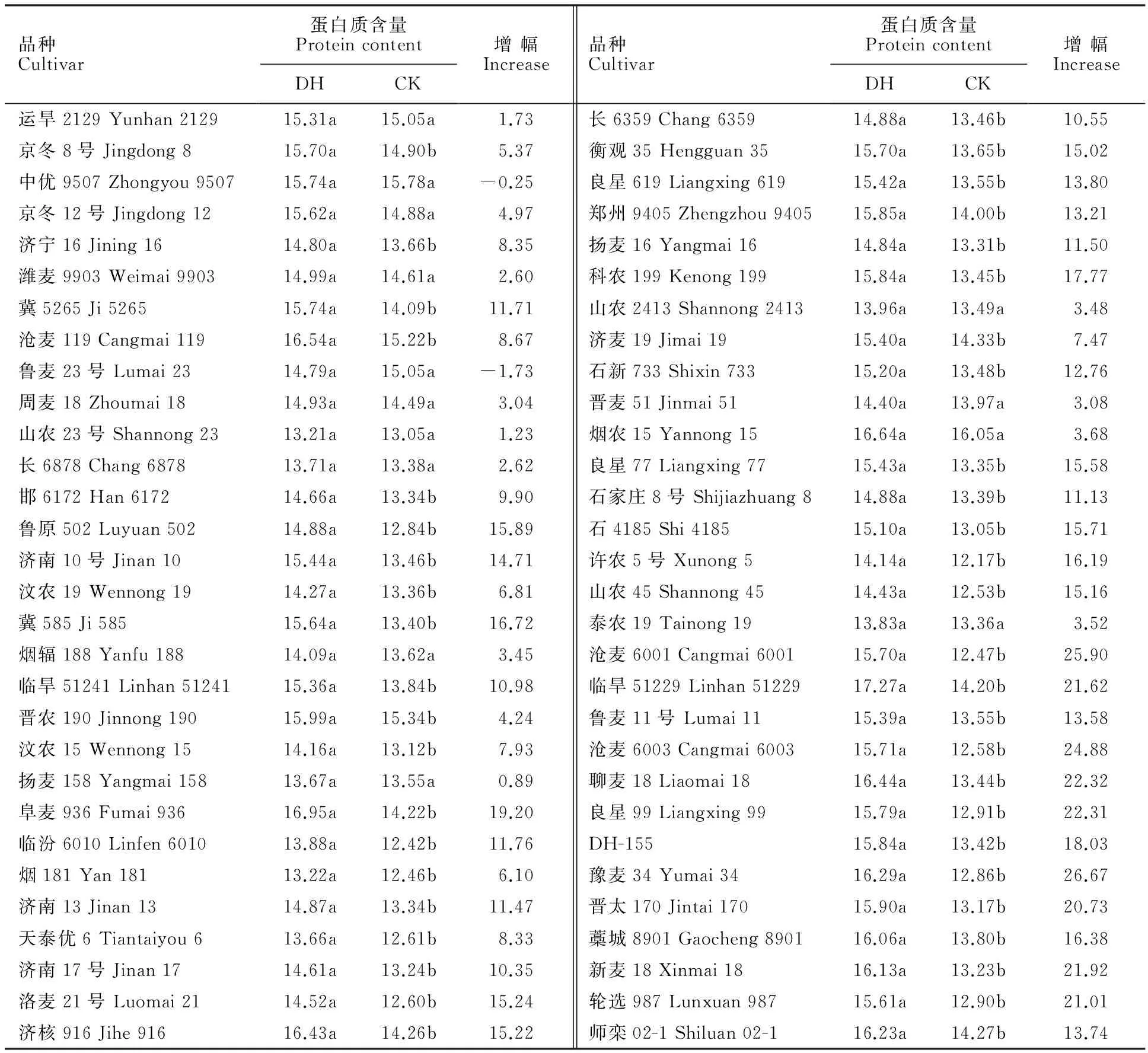
表5 2014年鉴定小麦品种的蛋白质含量Table 5 Protein content of wheat cultivars identified in 2014 %

表6 2015年鉴定小麦品种的蛋白质含量Table 6 Protein content of wheat cultivars identified in 2015 %

表7 2014年鉴定小麦品种的淀粉含量Table 7 Starch content of wheat cultivars identified in 2014 %
2.3.2 干热风对淀粉含量的影响
由表7、表8可知,2014年干热风处理后,小麦籽粒淀粉含量均降低,降幅在0.01%~4.42%之间,其中,高抗(HR)与中抗(R)干热风品种淀粉含量降幅在0.01%~1.93%之间,而热敏感型品种(S)在0.09%~4.42%之间;2015年鉴定小麦品种中,除山农23号等8个品种在干热风处理后淀粉含量不降反升,其余品种籽粒淀粉含量均降低,降幅为-2.47%~4.41%,其中高抗干热风品种(HR)的降幅小于2.5%,而大部分热敏感型品种降幅大于2.5%,豫麦34等品种的降幅高达4%。说明干热风处理后小麦籽粒淀粉含量的降幅与品种的干热风抗性关系密切,干热风抗性越强,干热风处理后淀粉含量降幅越小。对两年鉴定小麦品种的抗逆指数与淀粉含量降幅分别进行相关性分析发现,2014年、2015年的相关系数分别为-0.689与-0.651(P≤0.01),均为极显著负相关。
2.4 高温诱导对不同抗性小麦品种小分子热激蛋白基因表达的影响
2.4.1 高温诱导对 TaHSP16.9基因表达的影响
图2显示,5个小麦品种在苗期经高温38 ℃处理0~4.5 h, TaHSP16.9基因表达水平均迅速上调,泰山9818的上调倍数高达6 000。除周麦18,其余4个品种基因表达上调倍数呈先上升后下降趋势,在高温诱导1.5 h时达到峰值,随后开始下降。在热胁迫过程中,山农23号、周麦18与泰山9818三个抗干热风品种的 TaHSP16.9基因表达上调倍数变化幅度较大,而师栾02-1与济南17号两个热敏感型品种的 TaHSP16.9基因表达变化幅度较平缓,不同时间之间差异较小。
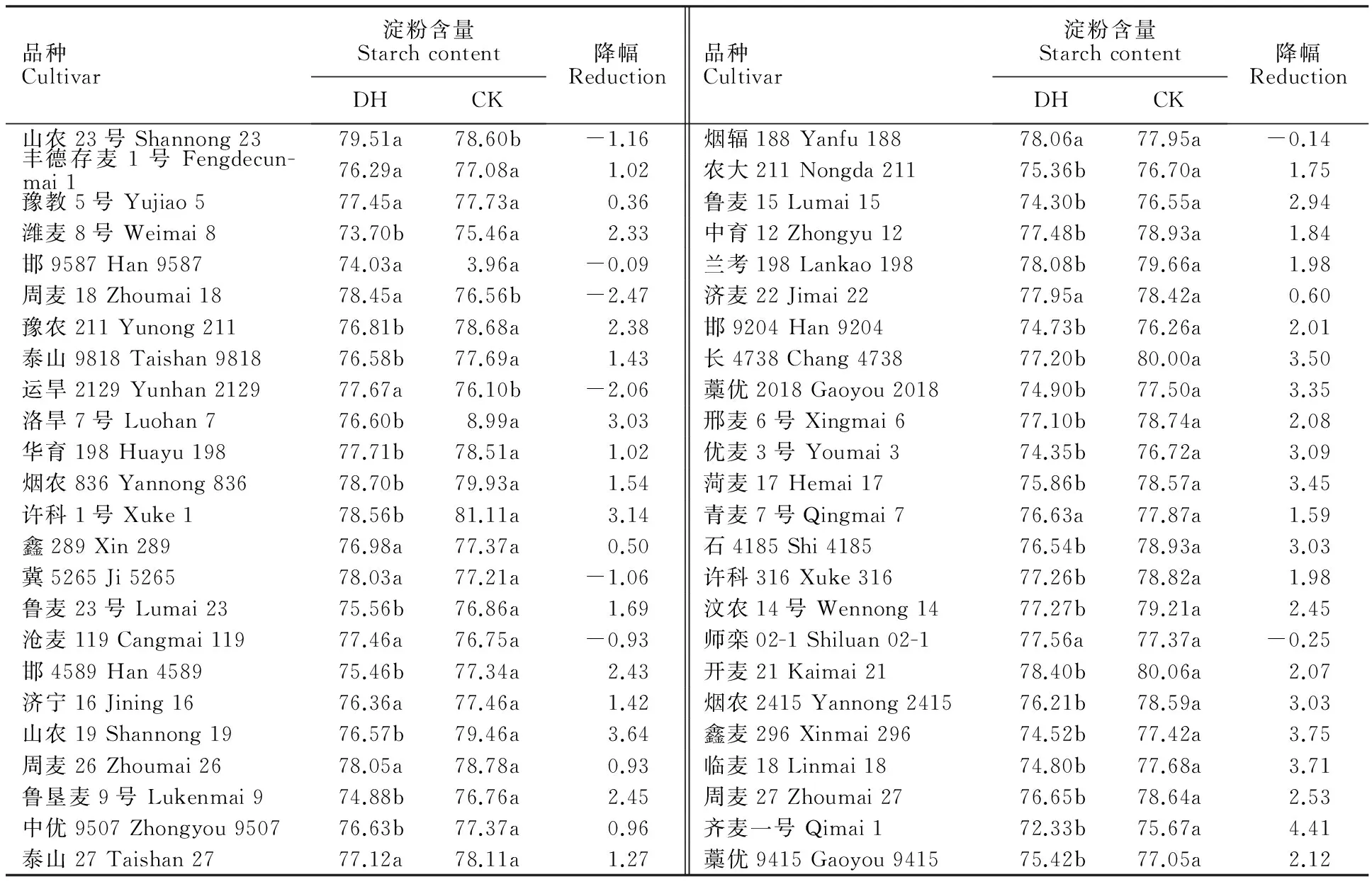
表8 2015年鉴定小麦品种的淀粉含量Table 8 Starch content of wheat cultivars identified in 2015 %
2.4.2 高温诱导对 TaHSP17.8基因表达的影响
图3显示,5个干热风抗性不同的小麦品种在38 ℃高温诱导过程中, TaHSP17.8基因表达均迅速上调,在0.5~1 h内基因上调至峰值,随后开始下降,基因表达上调倍数呈先上升后下降趋势,在2.5 h之后,基因上调倍数均趋于稳定至最低水平。山农23号、周麦18与泰山9818三个抗干热风品种 TaHSP17.8基因对高温的反应迅速,热胁迫0.5 h后,上调倍数分别迅速上升至1 212、1 010与598,而师栾02-1与济南17号两个热敏感型品种 TaHSP17.8基因对高温反应迟缓,热胁迫0.5 h时,基因表达仅上调至304与273倍。

SL02-1:师栾02-1;JN17:济南17;SN23:山农23号;ZM18:周麦18号;TS 9818:泰山9818。下同。
SL02-1:Shiluan 02-1;JN17:Jinan 17;SN23:Shannong 23;ZM18:Zhoumai 18;TS 9818:Taishan 9818.The same in Fig.3-5.
图2 抗、感干热风小麦品种热胁迫不同时间 TaHSP16.9基因的表达差异
Fig.2 Differential expression of TaHSP16.9 in both resistant and susceptible wheat cultivars under high temperature stress

图3 抗、感干热风小麦品种热胁迫不同时间 TaHSP17.8基因的表达差异
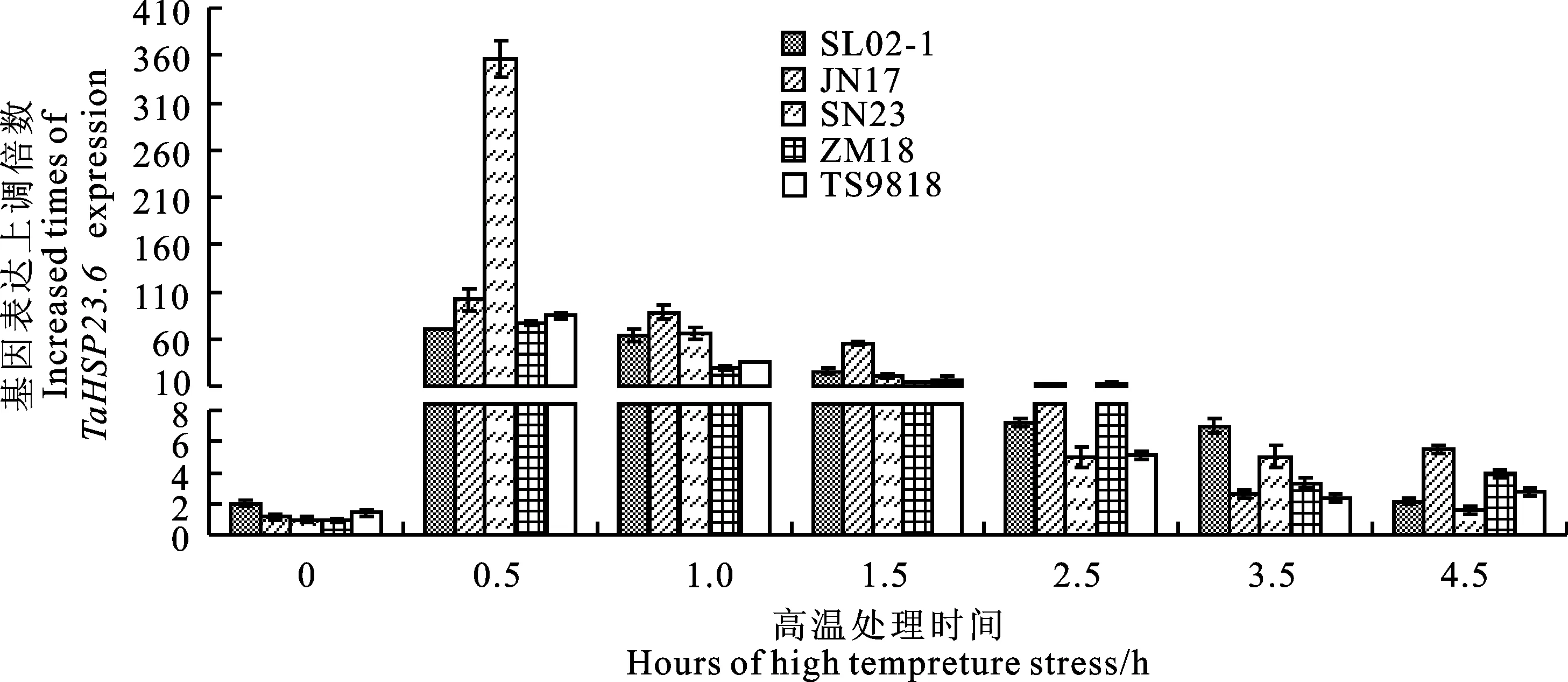
图4 抗、感干热风小麦品种热胁迫不同时间 TaHSP23.6基因的表达差异
2.4.3 高温诱导对 TaHSP23.6基因表达的影响
图4显示,5个干热风抗性不同的小麦品种在高温38 ℃处理0~4.5 h内, TaHSP23.6基因表达上调倍数呈先上升后下降趋势,基因表达上调峰值在热胁迫0.5 h左右出现,随后开始下降,在热胁迫2.5 h之后,基因表达上调倍数趋于稳定至最低水平。5个品种中,山农23号基因表达上调峰值最大,接近400倍,其余品种基因表达上调峰值相对较小,均在100倍以下。
2.4.4 高温诱导对 TaHSP26.6基因表达的影响
图5显示,5个干热风抗性不同的小麦品种在高温38 ℃处理0~4.5 h内, TaHSP26.6基因表达上调倍数为先上升后下降的趋势,热胁迫至1.5~2.5 h出现峰值,较其他小分子热激蛋白基因出现晚,随后开始下降。5个品种中,山农23号与周麦18上调表达峰值最大,高至10 000倍以上,师栾02-1上调表达峰值最小,为6 000倍左右;此外,师栾02-1与济南17号两个热敏感型品种在热胁迫4.5 h时基因表达分别上调至5 829与4 163倍,而山农23号、周麦18与泰山9818三个抗干热风品种上调幅度分别为1 317、2 896、894倍,可见,抗干热风品种在处理后期 TaHSP26.6基因上调表达倍数显著低于热敏感型品种。

图5 抗、感干热风小麦品种热胁迫不同时间 TaHSP26.6基因的表达差异
3 讨 论
3.1 高温对小麦籽粒品质与千粒重的影响
关于干热风对小麦品质的影响前人已做了大量研究。小麦在灌浆后期经历高温,籽粒蛋白的积累速率加快,淀粉含量降低;蛋白质的积累与淀粉形成是两个相互独立又有联系的过程,灌浆期经历高温,籽粒蛋白含量增加是由于淀粉的减少造成的[2,5,20]。仪小梅等[7]研究发现,抗干热风品种在灌浆后期经干热风胁迫后,淀粉含量降低幅度小于热敏感型品种。本研究发现,两年鉴定的98个小麦品种在灌浆期经历干热风后,大部分品种的籽粒蛋白质含量显著提高,淀粉含量显著降低,籽粒蛋白质含量升高的主因是籽粒淀粉含量降低。
Hanft等[21]研究表明,环境对籽粒的发育具有重要作用,小麦灌浆期间经历干热风,必然会严重影响到小麦千粒重。Zhao等[22]研究表明,在灌浆期遭受高温后,蛋白质含量高的小麦品种千粒重高于蛋白质含量低的小麦品种。本研究表明,不同小麦品种经干热风处理后,千粒重均下降,降低幅度为4%~30%。根据小麦千粒重抗逆指数鉴定出的小麦抗性与淀粉、蛋白质含量变化有一定关系,即抗性强的品种,其籽粒的淀粉含量下降幅度与蛋白质含量升高幅度也较低。
3.2 高温对小分子热激蛋白表达的影响
在热激蛋白中,12~45 kD小分子量热激蛋白种类最丰富[23],且其在植物生长的各个阶段都有分布。高温条件下,小分子热激蛋白会大量合成[12,15-16]。热激蛋白的积累可以增强植物耐热性[13]。Xue等[10]对高温诱导拟南芥中 HSP26基因的研究发现,HSP26热激蛋白的积累可以增强植物的耐热性。Zhang等[24]对拟南芥的高温诱导研究结果表明, HSP21.4基因能在短时间内迅速表达,对抵御外界胁迫有关键性作用。Murakami等[25]对水稻中 HSP17.7基因的研究发现,过量表达的 HSP17.7基因,可以提高水稻对高温胁迫的抵抗能力。Park等[26]对高温诱导胡萝卜中 HSP17.7基因表达的研究也表明,高温会在短时间内提高 HSP17.7基因的表达量。本研究表明,小麦中 TaHSP16.9、 TaHSP17.8、 TaHSP23.6、 TaHSP26.6四个小分子热激蛋白基因在高温胁迫下能在短时间内快速大量表达,这与前人研究相一致。此外,本研究还发现,高温诱导小麦幼苗中,小分子热激蛋白基因表达在干热风抗性不同的品种间有差异,抗干热风品种在高温诱导期间, TaHSP16.9基因表达上调变化幅度大于热敏感型品种, TaHSP17.8基因上调表达时间均早于热敏感型品种,山农23号的 TaHSP23.6基因上调表达峰值远高于其他品种,热敏感型品种在热胁迫后期 TaHSP26.6基因的上调倍数高于抗干热风品种,这表明TaHSPs基因的热激反应时间、上调表达幅度、基因表达峰值以及高温诱导后期基因表达水平的维持在干热风抗性不同的品种间有差异。因此,还需进一步明确小麦苗期小分子热激蛋白基因的表达与灌浆期小麦干热风抗性的关系,以期为干热风抗性品种的选育提供更有价值的理论依据。
4 结 论
干热风处理导致干热风抗性有差异的小麦品种千粒重不同程度下降,在两年重复鉴定小麦品种中,山农23号等品种抗性等级均达到高、中抗干热风水平,抗性稳定,而师栾02-1在两年的鉴定中,均为热敏感型品种。干热风处理显著提高籽粒蛋白质含量,降低籽粒淀粉含量和旗叶叶绿素含量,且抗性高的品种蛋白质含量升高幅度与淀粉及叶绿素含量降低幅度较小。在38 ℃高温诱导0~4.5 h的小麦幼苗中, TaHSP16.9、TaHSP17.8、)TaHSP23.6与 TaHSP26.6基因迅速大量表达,且不同品种的表达均为抛物线趋势,但小分子热激蛋白基因上调表达幅度、基因表达峰值以及高温诱导后期基因表达水平的维持方面在干热风抗性不同的品种间有差异。
[1] SHPILER L,BLUM A.Heat tolerance for yield and its components in different wheat cultivars [J].Euphytica,1990,51(3):257.
[2] 赵 辉,荆 奇,戴廷波,等.花后高温和水分逆境对小麦籽粒蛋白质形成及其关键酶活性的影响[J].作物学报,2007,33(12):2021.
ZHAO H,JING Q,DAI Y B,etal.Effects of high temperature during grain filling on key enzymes involved in starch synthesis in two wheat cultivars with different quality types [J].ActaAgronomicaSinica,2007,33(12):2021.
[3] 卢红芳,王晨阳,郭天财,等.灌浆前期高温和干旱胁迫对小麦籽粒蛋白质含量和氮代谢关键酶活性的影响[J].生态学报,2014,34(13):3612.
LU H F,WANG C Y,GUO T C,etal.Effects of high temperature and dry stress on protein concentration enzyme activities in relation to nitrogen metabolism in wheat grains during the early stage of grain filling [J].ActaEcologicaSinica,2014,34(13):3612
[4] 刘 萍,郭文善,浦汉春,等.灌浆期短暂高温对小麦淀粉形成的影响[J].作物学报,2006,32(2):182.
LIU P,GUO W S,PU H C,etal.Effects of transient high temperature during grain filling period on starch formation in wheat(TriticumaestivumL.) [J].ActaAgronomicaSinica,2006,32(2):182.
[5] 李永庚,于振文,张秀杰,等.小麦产量与品质对灌浆不同阶段高温胁迫的响应[J].植物生态学报,2005,29(3):461.
LI Y G,YU Z W,ZHANG X J,etal.Response of yield and quality of wheat to heat stress at different grain filling stress [J].ActaPhytoecologicaSinica,2005,29(3):461.
[6] 闫素辉,尹燕枰,李文阳,等.灌浆期高温对小麦籽粒淀粉的积累、粒度分布及相关酶活性的影响[J].作物学报,2008,34(6):1092.
YAN S H,YIN Y P,LI W Y,etal.Effect of high temperature during gain filling on starch accumulation,starch granule distribution,and activities of related enzymes in wheat [J].ActaAgronomicaSinica,2008,34(6):1092.
[7] 仪小梅,孙爱清,韩晓玉,等.黄淮麦区小麦主推品种(系)干热风抗性鉴定[J].麦类作物学报,2015,35(2):274.
YI X M,SUN A Q,HAN X Y,etal.Identification of dry-hot wind resistance of major wheat cultivars(strains) in Huanghuai wheat region [J].JournalofTriticeaeCrops,2015,35(2):274.
[8] 张英华,杨佑明,曹 莲,等.灌浆期高温对小麦旗叶与非叶器官光合和抗氧化酶活性的影响[J].作物学报,2015,41(1):136.
ZHANG Y H,YANG Y M,CAO L,etal.Effect of high temperature on photosynthetic capability and antioxidant enzyme activity of flag leaf and non-leaf organs in wheat [J].ActaAgronomicaSinica,2015,41(1):136.
[9] RISTIC Z,BUKOVNIK U,PRASAD P V V.Correlation between heat stability of thylakoid membranes and loss of chlorophyll in winter wheat under heat stress [J].CropScience,2007,47(5):2067.
[10] XUE Y,PENG R,XIONG A,etal.Over-expression of heat shock protein gene hsp26 inArabidopsisthalianaenhances heat tolerance [J].BiologiaPlantarum,2010,54(1):105.
[11] KUMAR S,KUMARI P,KUMAR U,etal.Molecular approaches for designing heat tolerant wheat [J].JournalofPlantBiochemistry&Biotechnology,2013,22(4):359.
[12] QIN D D,WU H Y,PENG H R,etal.Heat stress-responsive transcriptome analysis in heat susceptible and tolerant wheat(TriticumaestivumL.) by using wheat genome array [J].BiomedcentralGenomics,2008,9(9):1.
[13] MILLER G,MITTLER R.Could heat shock transcription factors function as hydrogen peroxide sensors in plants [J].AnnalsofBotany,2006,98(2):279.
[14] MOMCILOVIC I,RISTIC Z.Expression of chloroplast protein synthesis elongation factor,EF-Tu,in two lines of maize with contrasting tolerance to heat stress during early stages of plant development[J].JournalofPlantPhysiology,2007,164(1):90.
[15] WAHID A,GELANI S,ASHRAF M,etal.Heat tolerance in plants:An overview[J].Environmental&ExperimentalBotany,2007,61(3):199.
[16] BHARATI P,AMANDEEP K,OM P G,etal.Identification of HSP20 gene family in wheat and barley and their differential expression profiling under heat stress[J].AppliedBiochemistry&Biotechnology,2015,175(5):24276.
[17] 郭秀林,刘子会,赵会嶶,等.热锻炼和高温胁迫下冬小麦热激蛋白与抗氧化酶基因表达[J].华北农学报,2014(4):13.
GUO X L,LIU Z H,ZHAO H W,etal.Gene expression of heat-shock proteins and antioxidant enzymes under heat acclimation and heat stress in winter wheat [J].ActaAgriculturaeBoreali-Sinica,2014(4):13.
[18] LEE S H,LEE K W,LEE D G,etal.Identification and functional characterization of Siberian wild rye(ElymussibiricusL.) small heat shock protein 16.9 gene( EsHsp16.9) conferring diverse stress tolerance in prokaryotic cells [J].BiotechnologyLetters,2015,37(4):1.
[19] ABU-ROMMAN S.Genotypic response to heat stress in durum wheat and the expression of smallHSPgenes [J].RendicontiLinceiScienzeFisicheENaturali,2016,27(2):261.
[20] 戴廷波,赵 辉,荆 奇,等.灌浆期高温和水分逆境对冬小麦籽粒蛋白质和淀粉含量的影响[J].生态学报,2016,27(2):261.
DAI Y B,ZHAO H,JING Q,etal.Effects of high temperature and water stress during grain filling on grain protein and starch formation in winter wheat [J].ActaEcologicaSinica,2016,27(2):261..
[21] HANFT J M,JONES R J,STUMME A B.Dry matter accumulation and carbohydrate concentration patterns of field-grown andinvitrocultured maize kernels from the tip and middle ear positions [J].CropScience,1986,26(3):568.
[22] ZHAO H,DAI T,JING Q,etal.Leaf senescence and grain filling affected by post-anthesis high temperatures in two different wheat cultivars [J].PlantGrowthRegulation,2007,51(2):149.
[23] VIERLING E.The roles of heat shock proteins in plants [J].AnnualReviewofPlantBiology,2003,42(1):579.
[24] LU Z,ZHANG Q,GAO Y,etal.Overexpression of heat shock protein gene PfHSP21.4 inArabidopsisthalianaenhances heat tolerance[J].ActaPhysiologiaePlantarum,2014,36(6):1555.
[25] MURAKAMI T,MATSUBA S,FUNATSUKI H,etal.Over-expression of a small heat shock protein, sHSP17.7,confers both heat tolerance and UV-B resistance to rice plants [J].MolecularBreeding,2004,13(2):165.
[26] PARK H,KO E,JANG E,etal.Expression of DcHsp17.7,a small heat shock protein gene in carrot(DaucuscarotaL.) [J].HorticultureEnvironment&Biotechnology,2013,54(2):121.
Identification of Dry-Hot Wind Resistance of Wheat Cultivars and Gene Expression Analysis ofTaHSPsRelated to Heat Stress
LI Meiling,SUN Aiqing,YANG Min,ZHANG Jiedao,WANG Zhenlin,CHEN Leitai,CHEN Lulu,MA Xueli,YIN Yanping
(College of Agronomy,Shandong Agricultural University/State Key Laboratory of Crop Biology/Shandong Key Laboratory of Crop Biology,Tai’an,Shandong 271018,China)
This study aims to identify dry-hot wind resistance of wheat cultivars and analyze expression of heat shock protein genes(TaHSPs) related to heat stress in resistant and susceptible wheat cultivars. Ninety-eight wheat cultivars were used as materials and treated with simulating dry-hot wind from 10 to 20 days after anthesis. Chlorophyll content,grain quality and thousand-kernel weight were tested,and the effects of dry-hot wind resistance of wheat cultivars were studied. The expression ofTaHSPsin 15-day-old seedling of resistant and susceptible wheat cultivars,which were subjected to continuous heat stress at 38 ℃ for 4.5 h,was tested by real-time quantitative PCR. The results showed that the chlorophyll content in flag leaf of wheat cultivars decreased gradually during the treatment of dry-hot wind and decreased much more in susceptible wheat cultivars than in resistant cultivars. Thousand-kernel weight of all cultivars was reduced after dry-hot wind treatment and some cultivars which were identified showed the same resistance to dry-hot wind in two-year replications,such as Shannong 23 showed steady resistance to dry-hot wind,whereas Shiluan 02-1 was sensitive to dry-hot wind in 2-year replications. Protein content was significantly increased while the starch content was significantly decreased. Besides,the percentage of decreased starch content of wheat cultivars with high adversity resistance index (AI) was lower than those with low AI. Expression analysis ofTaHSPsgenes showed, TaHSP16.9, TaHSP17.7, TaHSP23.6 and TaHSP26.6 in wheat seedling were highly expressed and the expression trends ofTaHSPswere first increasing and then decreasing during heat stress at 38 ℃. In addition,the gene expression patterns ofTaHSPswere different between resistant and susceptible wheat cultivars under heat stress at 1 h.For TaHSP16.9,the up-regulated extent of gene expression in resistant wheat cultivars was greater than that in susceptible wheat cultivars. For TaHSP17.8,the up-regulated times of gene expression in resistant wheat cultivars was higher than that in susceptible wheat cultivars under heat stress at 0.5 h. The up-regulated times of gene expression level in Shannong 23 with heat tolerance was higher than 590,whereas the expression level in Shiluan 02-1 with heat sensitivity only reached 300. For TaHSP23.6,the peak of Shannong 23 with heat tolerance was four times higher than those in other cultivars. For TaHSP26.6,the up-regulated times of gene expression in susceptible wheat cultivars were higher than resistant wheat cultivars under heat stress at 4.5 h. The up-regulated times of TaHSP26.6 in heat susceptible cultivars were higher than 4 000,whereas that in heat tolerant cultivars only reached 3 000.
Wheat; Dry-hot wind; 1 000-kernel weight; Adversity resistance index; Heat shock protein
时间:2017-01-16
2016-04-07
2016-05-23
国家公益性行业(农业)科研专项(201203029)
E-mail:limeiling0602@163.com
尹燕枰(E-mail:ypyinsdau@sina.com)
S512.1;S330
A
1009-1041(2017)02-0162-13
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170116.1833.006.html
