四川小麦品种的遗传多样性及其对条锈病和白粉病的抗性
2017-03-01章振羽姬红丽邝文静倪健英彭云良
徐 志,章振羽,姬红丽,邝文静,2,沈 丽,倪健英,彭云良
(1.四川省农业科学院植物保护研究所/农业部西南作物有害生物综合治理重点实验室,四川成都 610066; 2.四川农业大学,四川雅安 625014; 3.四川省农业厅植物保护站,四川成都 610041)
四川小麦品种的遗传多样性及其对条锈病和白粉病的抗性
徐 志1,章振羽1,姬红丽1,邝文静1,2,沈 丽3,倪健英1,彭云良1
(1.四川省农业科学院植物保护研究所/农业部西南作物有害生物综合治理重点实验室,四川成都 610066; 2.四川农业大学,四川雅安 625014; 3.四川省农业厅植物保护站,四川成都 610041)
小麦条锈病和白粉病是四川小麦生产中的两大主要病害。为系统掌握四川小麦品种的遗传差异性及抗病性水平,以大田样品和近10年审定品种为试验材料,利用SSR分子标记对其进行遗传多样性分析,并对其成株期条锈病和白粉病抗性进行了鉴定。结果显示,115份大田样品和33个审定品种构成的总群体共扩增出38条多态性带,遗传相似系数变化范围为0.62~1。大田样品的观察等位基因数、有效等位基因数、基因多样性指数、信息指数、多态性位点数和多态位点百分率分别为1.868 4、1.422 8、0.253 0、0.386 7、33和86.8%,各项参数值均高于审定品种。聚类结果显示,多数审定品种与大田样品同源且出现于多个采样地点。抗性监测结果表明,四川省生产上大面积种植的小麦品种抗条锈性丧失明显,对白粉病的抗性丧失不明显。
小麦; SSR; 条锈病; 白粉病; 抗病性
农作物遗传多样性是全球生物多样性的重要组成部分,相关研究对于农作物品种选育和推广至关重要。少数产量或其他农艺性状优异品种的大面积推广,引起了作物品种遗传多样性丧失,甚至会导致一些优良基因丢失而阻碍进一步的品种改良[1-2]。栽培品种狭窄的遗传基础已经带来诸如马铃薯晚疫病[3]、玉米小斑病[4]大流行等灾难性后果。因此,对于育成品种,尤其是生产上大面积种植品种遗传多样性及其对病害抗性的监测,对于保障粮食的安全生产和稳定具有重要意义。
小麦是我国最主要的粮食作物之一,四川省是我国小麦的重要产区。小麦条锈病和白粉病是我国乃至世界小麦产区最具威胁的真菌病害,在感病品种普遍存在的情况下如遇适宜的气候条件,病害能在短时间内暴发流行[5-6]。生产上大面积栽培小麦品种抗条锈性和抗白粉性的丧失,在我国已造成条锈病和白粉病反复大流行[7-8]。四川省西部冷凉山区是条锈病菌的重要越夏菌源基地,四川西北地区是我国小麦条锈病菌新生理小种的策源地[9-10]。而白粉病菌在四川既能越夏也能越冬[11],病菌无性和有性交替繁殖,导致病菌能够适应寄主抗性、杀菌剂和温度等因素的变化[12]。因此,对四川生产上大面积种植小麦的遗传多样性及其对条锈病和白粉病的抗性进行监测尤其重要。本研究对四川不同地区大面积种植小麦品种和近十年审定品种的基因组DNA进行SSR分析,并对其条锈病、白粉病的抗性进行监测,以期了解生产上大面积种植和审定品种的遗传多样性及其主要抗病性,为新品种的选育和推广以及条锈病和白粉病的防控提供理论依据。
1 材料与方法
1.1 小麦审定品种
供试的33个四川省近十年审定小麦品种名称见表4,感病对照为铭贤169,均由四川省农业科学院植物保护研究所收集和保存。
1.2 小麦大田样品
2009年12月-2010年1月,在位于四川盆地及周边39个县(市)(表1)进行采样,各县(市)选1~2个乡镇,各乡镇沿公路随机选10~15个田块,无论田块大小,均自田中取一丛(3~6株)小麦,依次编号,共采集615个样品,移栽于郫县(103.85°E,30.81°N),连续浇水3 d保证其存活。2010年12月-2011年1月,采用同样的方法收集了29个县市共计577块田样品,移栽于盐亭(105.35°E,31.23°N)。小麦成熟后,收获各样品种子保存待用。以上两年样品2011年第二次种植,小麦成熟时,对抗病与感病混杂的样品,仅收取抗性单株的单穗继续保存待用。
1.3 SSR引物
从GrainGenes网站(http://wheat.pw.usda.gov/cmap/),选取分布于不同染色体上的SSR引物,共37对(表2),由生工生物工程(上海)有限公司合成。
1.4 遗传多样性分析
将33份四川小麦审定品种,以及经单穗纯化后从各乡镇样点中随机挑选1~2份材料组成的115份大田收集样品,播种于白瓷盘中,一叶一心时,采集其叶片,采用CTAB法提取基因组DNA[13]。选用分布于小麦21条染色体的37对SSR引物分析其遗传多样性,其中SSR-PCR扩增体系20 μL,包括2×TaqPCR MasterMix 10 μL(TIANGEN,北京),Primers(10 μmol·L-1) 2 μL,模板DNA(10 ng·μL-1)2 μL,ddH2O 6 μL。反应程序为:94 ℃ 3 min;94 ℃ 40 s,50~60 ℃ 40 s,72 ℃ 40 s,34个循环;72 ℃ 10 min。扩增产物经8%非变性聚丙烯酰胺凝胶电泳、硝酸银染色后观察。
将SSR标记作为等位基因进行多态性研究。对于每一对引物而言,在特定位置出现扩增条带均作为一个分子标记,记为1,未出现扩增条带记为0,构建SSR谱带0-1二元数据矩阵。采用NTsys-pc 2.01软件[14]进行遗传相似系数的计算。应用PopGene 1.32软件[15]在假定哈丁·温伯格平衡条件下,分别计算以下参数:观察等位基因数(Observed number of alleles)、有效等位基因数(Effective number of alleles)、基因多样性指数(Nei’s gene diversity)、信息指数(Shannon’s information index)、多态性位点数(The number of polymorphic loci)和多态位点百分率(The percentage of polymorphic loci)等,并根据Nei氏遗传距离按UPGMA法对参试材料进行聚类分析。
1.5 抗病性监测
2011年11月,将33份四川小麦审定品种、615份2009年小麦大田生产样品及577份2010年小麦大田生产样品分行播种于盐亭病圃,四周种植铭贤169作诱发和保护行。其中,33份审定品种同时在郫县病圃进行抗性鉴定。次年小麦乳熟期,按0~4级法[16-17]记录各品种和大田样品对条锈病反应型,其中0~2为抗病型,3~4为感病型;按0~9级法[18]调查其对白粉病反应,其中0~4为抗病型,5~9为感病型。2013年11月,将上述材料播种于郫县病圃,四周种植铭贤169做诱发和保护行,次年2月接种包括贵农22致病类群[19-20]的条锈病菌混合菌株。其中,33份审定品种同时在盐亭病圃进行抗性鉴定。小麦乳熟后期,调查其对条锈病和白粉病反应型。
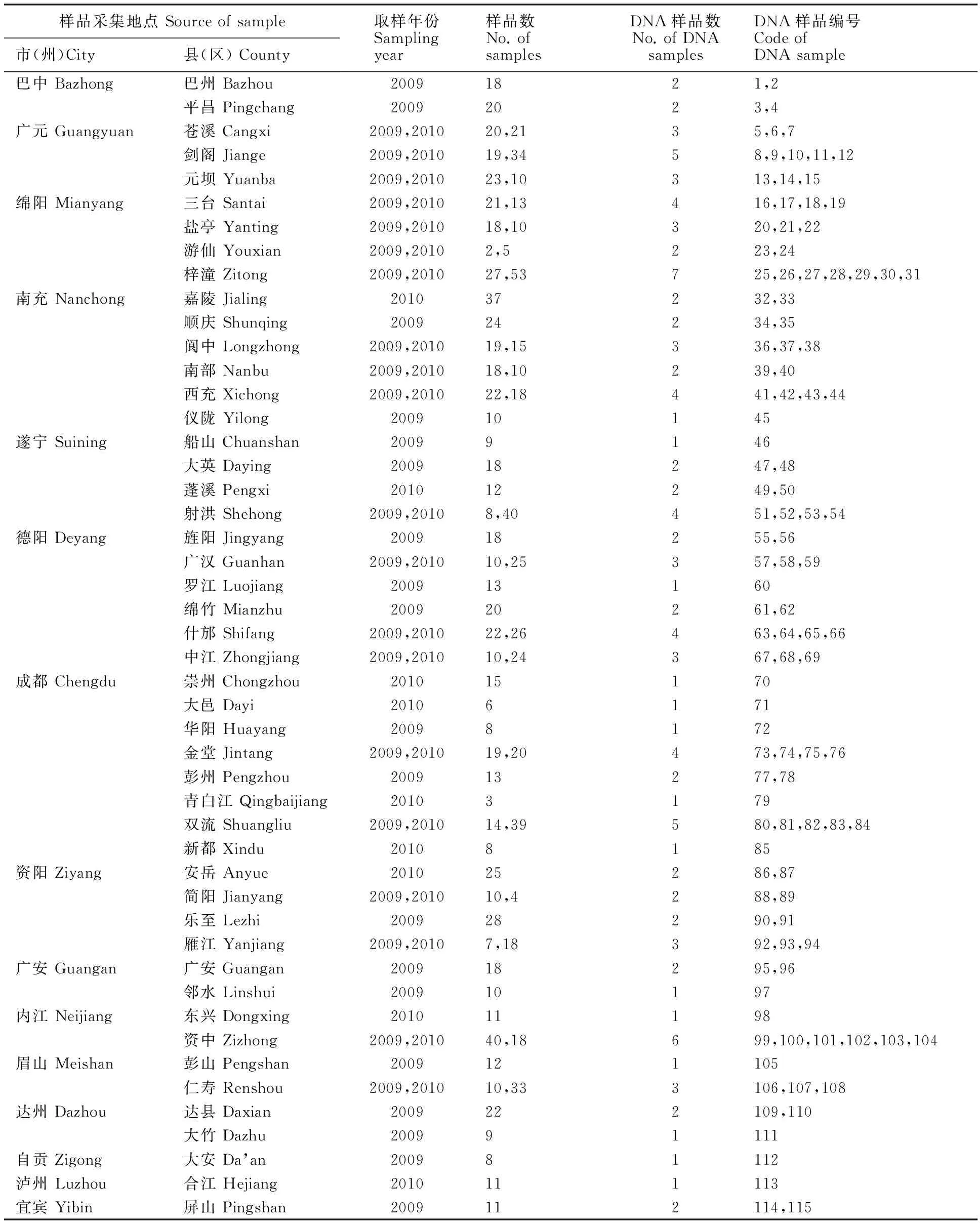
表1 小麦大田样品来源、数量及编号Table 1 Origin,number and code of field wheat samples
2 结果与分析
2.1 供试小麦材料的遗传多样性分析
用8份不同来源的小麦材料对37对SSR引物进行筛选,结果发现10对引物的扩增产物带型清晰、多态性高且重复性好,分别是Xbarc106、Xbarc65、Xbarc196、Xbarc201、Xbarc263、Xbarc349、Xbarc1096、Xgwm161、Xwmc75、Xwmc285。利用这10对引物对148份样本群体进行SSR遗传多态性分析,共得到38个变异位点,平均每对引物检测到3.8个等位变异。
33份审定小麦品种的观察等位基因数、有效等位基因数、基因多样性指数、信息指数、多态性位点数和多态位点百分率分别是1.736 8、1.378 5、0.233 9、0.357 4、28、73.7%(表3)。115份大田样品的观察等位基因数、有效等位基因数、基因多样性指数、信息指数、多态性位点数和多态位点百分率分别是1.868 4、1.422 8、0.253 0、0.386 7、33和86.8%(表3)。相比较而言,大田样品的遗传多样性各项参数均高于参试的审定品种;大田样品中,在盆地条锈病菌冬繁区的遗传多样性高于川东南条锈病春季流行区。
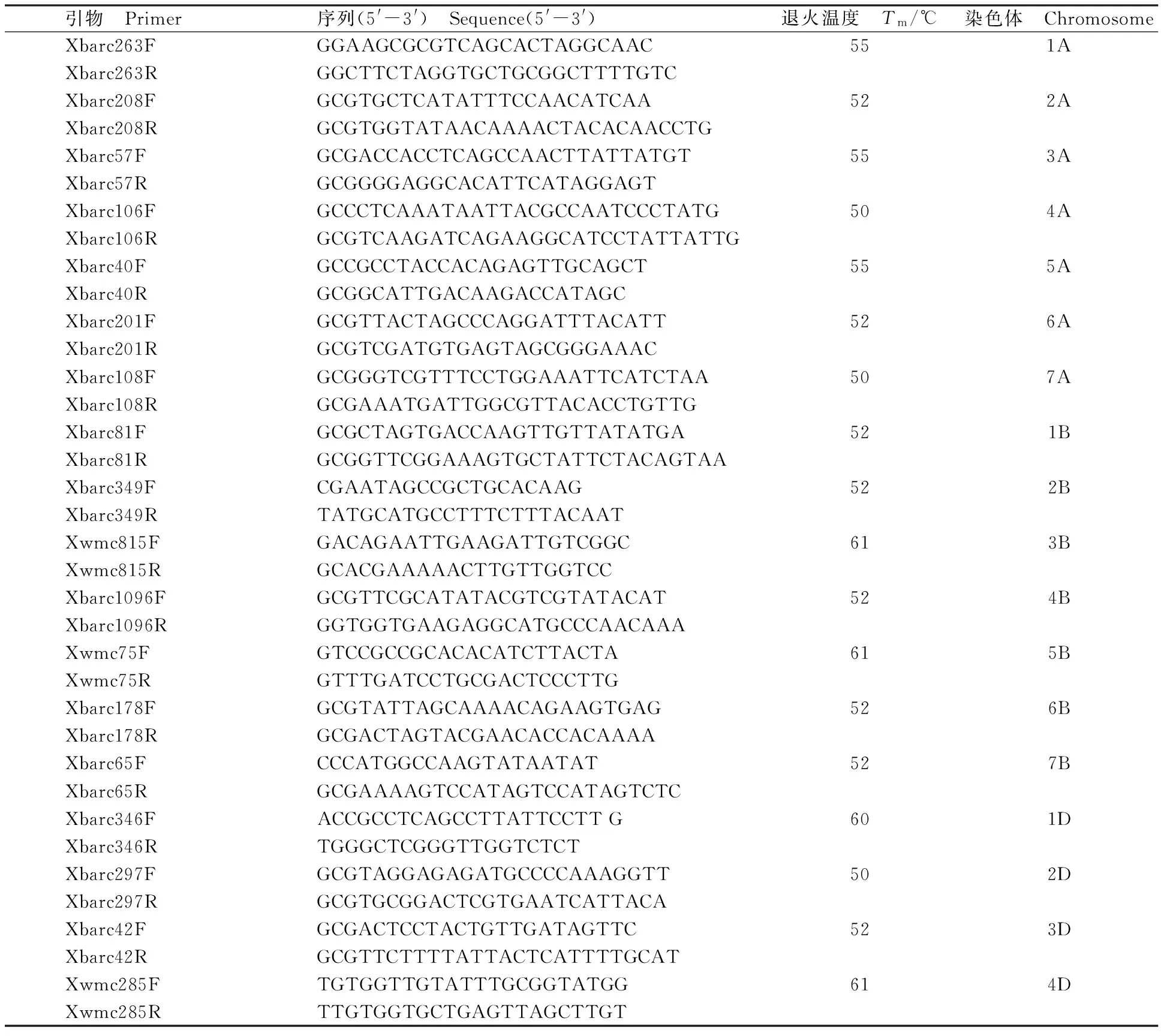
表2 用于SSR遗传多样性分析的37对引物Table 2 Thirty-seven pairs of primers for SSR analysis on genetic diversity
(续表2 Continued table 2)
引物 Primer序列(5'-3') Sequence(5'-3')退火温度 Tm/℃染色体 ChromosomeXbarc286FGCGAAGAAAACATTAGACCAAAA505DXbarc286RGCGATATGTTTCCCGACAACTAXbarc196FGGTGGGTTTTATCGAATAGATTTGCT506DXbarc196RGCGTTTCGTCAAGATTAATGCAGGTTTXwmc506FCACTTCCTCAACATGCCAGA617DXwmc506RCTTTCAATGTGGAAGGCGACXgwm153FGATCTCGTCACCCGGAATTC601BXgwm153RTGGTAGAGAAGGACGGAGAGXgwm642FACGGCGAGAAGGTGCTC601DXgwm642RCATGAAAGGCAAGTTCGTCAXgwm372FAATAGAGCCCTGGGACTGGG602AXgwm372RGAAGGACGACATTCCACCTGXgwm148FGTGAGGCAGCAAGAGAGAAA602BXgwm148RCAAAGCTTGACTCAGACCAAAXgwm102FTCTCCCATCCAACGCCTC602DXgwm102RTGTTGGTGGCTTGACTATTGXgwm389FATCATGTCGATCTCCTTGACG603BXgwm389RTGCCATGCACATTAGCAGATXgwm77FACAAAGGTAAGCAGCACCTG603BXgwm77RACCCTCTTGCCCGTGTTGXgwm161FGATCGAGTGATGGCAGATGG603DXgwm161RTGTGAATTACTTGGACGTGGXgwm160FTTCAATTCAGTCTTGGCTTGG604AXgwm160RCTGCAGGAAAAAAAGTACACCCXgwm368FCCATTTCACCTAATGCCTGC604BXgwm368RAATAAAACCATGAGCTCACTTGCXgwm595FGCATAGCATCGCATATGCAT605AXgwm595RGCCACGCTTGGACAAGATATXgwm291FCATCCCTACGCCACTCTGC605AXgwm291RAATGGTATCTATTCCGACCCGXwmc740FCTTGGTTGCAGACGGGG605BXwmc740RGCTGGGTGCAATGCAGATAGXwmc783FAGGTTGGAGATGCAGGTGGG605BXwmc783RTCTTCCTTCTCCTGCCGCTAXgwm190FGTGCTTGCTGAGCTATGAGTC605DXgwm190RGTGCCACGTGGTACCTTTGXgwm583FTTCACACCCAACCAATAGCA605DXgwm583RTCTAGGCAGACACATGCCTG
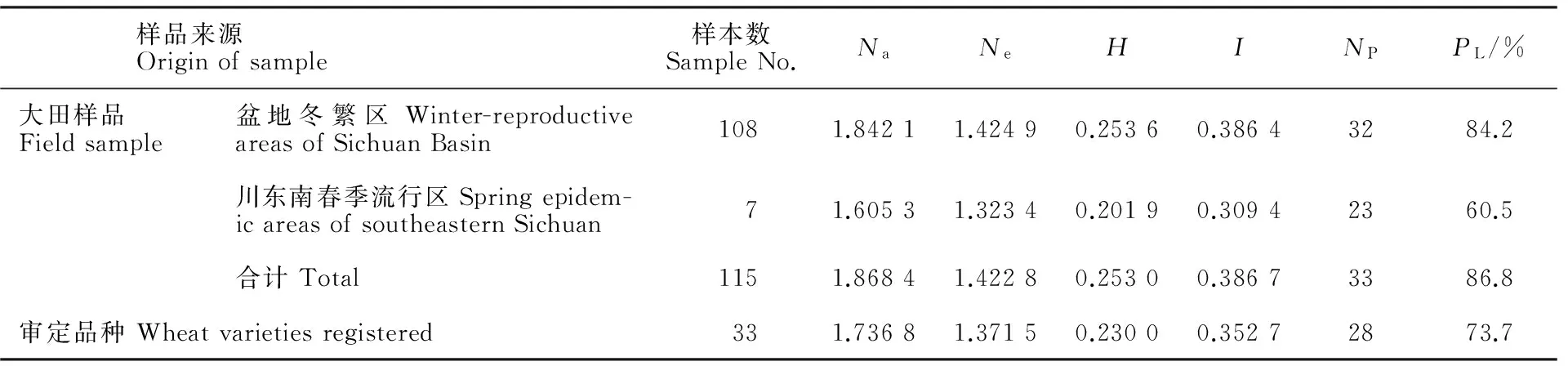
表3 四川省小麦品种的遗传多样性水平Table 3 Genetic diversity of wheat cultivars in Sichuan province
Na:观察等位基因数;Ne:有效等位基因数;H:基因多样性指数;I:信息指数;NP:多态性位点数;PL:多态位点百分率。
Na:Observed number of alleles;Ne:Effective number of alleles;H:Nei’s gene diversity;I:Shannon’s information index;NP:Number of polymorphic loci;PL:Percentage of polymorphic loci.
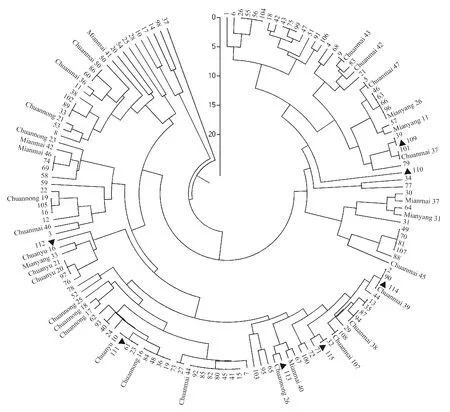
▲代表四川东南春季流行区样品,其余编号样品均来自盆地冬繁区。
▲ means sample from spring epidemic areas in southeastern Sichuan,and the others from winter-reproductive areas in Sichuan Basin.
图1 四川省小麦品种的UPGMA聚类图
Fig.1 UPGMA dendrogram of wheat varieties in Sichuan province
148份样本群体间的SSR遗传相似系数介于0.62~1之间,表明被测样品的遗传差异较大,遗传多样性丰富。PopGene聚类结果(图1)显示,当Nei氏遗传距离为17时,群体可被划分为A、B、C和D四组。
其中,A组包含1份材料,编号为37,样品取自于四川盆地北部阆中地区。B组有4份材料,广元2份(10,剑阁;14,元坝),绵阳1份(17,三台),内江1份(98,东兴)。C组共计93份材料,包括24份审定品种和69份大田样品,占参试材料的62.8%;24份审定品种包括了参试材料中所有的川育、川农系列,以及7个川麦系列和5个绵麦/绵阳系列品种;大田样品有64份来自盆地冬繁区,5份来自川东南春季流行区(自贡、大竹、合江各1份,屏山2份)。D组共包含有50份材料,包括9份审定品种和41份大田样品,占参试材料的33.8%;审定品种分别为绵阳31、绵麦37、川麦42、川麦43、川麦45、川麦37、绵阳11、绵阳26、川麦47;大田样品包括盆地冬繁区样品39份,川东南春季流行区样品2份(达县)。总体来看,相同地区不同样点的样品并未完全聚在同组,不同地区的部分样品也可聚在同组。
部分大田样品与已知审定品种的Nei氏遗传距离为0,即遗传相似性达100%,可能与审定品种同源。在各地检出具同源样品的审定品种为川麦44(7个)、绵阳26(4个)、川育10号(3个)、川麦39(3个)、川麦38(2个)、川麦50(2个)、川农19(2个)、绵麦46(2个)、川麦107(1个)、川麦47(1个)、川麦43(1个)、川麦37(1个)、绵阳11(1个),其同源品种分布于不同地区,说明四川小麦主要审定品种的同源样品在盆地内分布较广。
2.2 供试小麦材料对条锈病的抗性
2012年,33份四川省审定品种在盐亭病圃中,对条锈病表现抗病的品种有22个,但在郫县病圃中表现抗病的品种仅16个,分别为绵麦37、绵麦41、绵麦42、绵麦46、川麦43、川麦45、川麦46、川麦47、川麦50、川农18、川农19、川农23、川农25、川农26、川育20和川育21(表4)。
2014年,33份审定品种在盐亭病圃中,对条锈病表现抗病的品种有15个,在郫县病圃中表现抗病的有9个,在两个病圃同时表现抗病的有7个,分别为绵麦41、川麦45、川麦47、川农19、川农23、川育20和川育21。川农26在盐亭表现感病但在郫县表现抗病。川农18、川麦46、川农25、川麦50、绵麦46、川麦43、绵麦37、绵麦42共8个品种在各病圃中均表现感病。
615份2009年采集的大田样品,2012年在盐亭病圃中完全表现抗条锈病的有298份,有14份田间样品同时具有抗病和感病单株,根据形态特征可判别其为混杂样品,共计有50.7%的样品对条锈病表现抗性反应(图2)。该批样品2013年11月在郫县病圃播种600份,次年乳熟期其抗条锈病样品比例下降至20.8%,差异显著(P<0.01)。
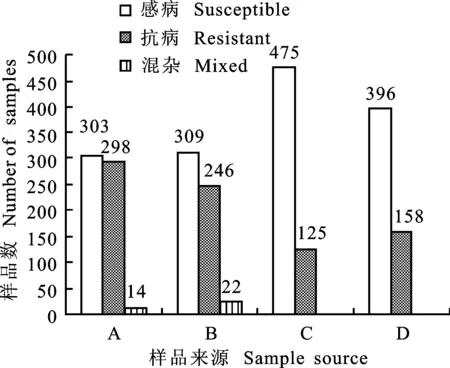
A、B分别为2009年和2010年样品于2012年在盐亭的抗性;C、D分别为2009年和2010年样品于2014年在郫县的抗性。下同。
A and B represent results of resistance evaluation at Yanting in 2012,samples collected in 2009 and 2010,respectively; C and D represent results of resistance evaluation at Pixian in 2014,samples collected in 2009 and 2010,respectively.The same in Fig.3.
图2 四川省小麦大田样品对条锈病的田间抗性
Fig.2 Resistance of wheat cultivars from field to stripe rust in Sichuan province
2010年采集的577份大田样品,2012年在盐亭病圃中完全表现抗条锈病的有246份, 22份样品同时具有抗病和感病单株,其形态特征亦表明其为混杂样品,共计有46.5%样品表现抗性反应(图2),表现抗性样品的比例显著低于2009年样品(P<0.05)。该批样品2013年11月在郫县病圃中播种554份,2014年在乳熟期有158份表现抗条锈病,抗性样品比例下降至28.5%,差异显著(P<0.01),但显著高于2009年大田样品中的抗病比例(P<0.01)。
2.3 供试小麦材料对白粉病的抗性
2012年,33份四川省审定品种中,仅有绵麦37在盐亭和郫县两个病圃均表现抗白粉病,川农16在郫县病圃表现对白粉病免疫,但在盐亭高感白粉病,病害级别为9级(表4)。
2014年,此33份四川省审定品种中,绵阳33、绵麦37和川育20在两个病圃均表现抗白粉病。川麦36、川麦46、川农21、绵麦41、绵麦46共5个品种在郫县病圃表现抗白粉病,但在盐亭病圃中白粉病病级为7~9级。未发现在盐亭表现感病而在郫县表现抗病的品种。
615份2009年大田样品2012年在盐亭病圃中完全表现抗白粉病的有85份,表现抗、感株混杂的样品有8份,即有15.1%的样品表现出抗白粉病反应(图3)。该批样品中在2013年11月有600份播种于郫县病圃,2014年在乳熟期有77份表现抗白粉病,抗性比例降至12.8%,较2012年监测结果无显著差异。
2012年,577份2010年大田样品在盐亭病圃中对白粉病完全表现抗病的有104份,表现抗、感株混杂的样品有11份,即有19.9%样品表现出抗性反应(图3)。该批样品中在2013年11月有554份播种于郫县病圃,2014年在乳熟期有93份表现抗白粉病,抗性比例降至16.8%,较2012年监测结果差异不显著。
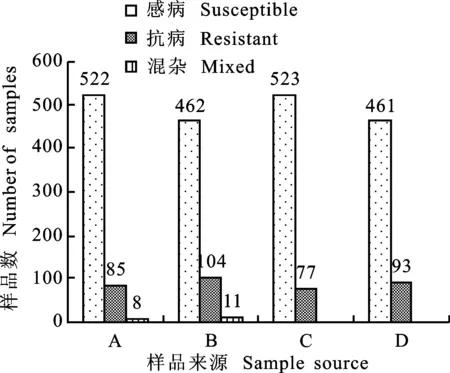
图3 四川省小麦大田样品对白粉病的田间抗性

品种Variety条锈反应型Infectiontypestostriperust2012盐亭Yanting郫县Pixian2014盐亭Yanting郫县Pixian白粉反应型Infectiontypestopowderymildew2012盐亭Yanting郫县Pixian2014盐亭Yanting郫县Pixian川麦36 Chuanmai3633337773川麦107 Chuanmai10733339975绵阳26 Mianyang2634339995绵阳11 Mianyang1133339777绵阳33 Mianyang3334439903绵麦37 Mianmai3700430013绵麦40 Mianmai4013339957川麦44 Chuanmai4434339575川麦43 Chuanmai4310339975川农16 Chuannong1633339075绵阳31 Mianyang3133339997川育16 Chuanyu1633239997川麦37 Chuanmai3723239997川麦38 Chuanmai3823239997川麦39 Chuanmai3934239997川育10号 Chuanyu1044439995川麦46 Chuanmai4600339973绵麦41 Mianmai4100209993绵麦42 Mianmai4200439997川农17 Chuannong1703139975川农18 Chuannong1800239975川农19 Chuannong19000;29975川农21 Chuannong2103339993川农26 Chuannong2600329995川农25 Chuannong2500339995川农23 Chuannong2300129977川麦50 Chuanmai5000339777川育20 Chuanyu2010217700川麦45 Chuanmai451220;9775川育21 Chuanyu2100109975川麦42 Chuanmai4203235575川麦47 Chuanmai4700229977绵麦46 Mianmai4600339993铭贤169 Mingxian16944449997
3 讨 论
小麦遗传多样性研究是小麦种质资源保护及开发利用的基础[21-22]。系统掌握小麦品种遗传多样性及其对条锈病和白粉病的抗性水平,可为小麦抗病育种及品种的合理布局提供参考依据。自从农作物品种生产销售市场化后,管理部门难以掌握生产上大面积种植品种遗传多样性及其对病虫害抗性的变化。本研究通过采用大田取样、病圃移栽、成株期抗性鉴定、样品DNA提取及SSR遗传分析等方法,结合近十年审定品种遗传多样性检测和抗病性监测,明确了当前四川省小麦品种遗传多样性及抗病性水平,其结果将有助于及时、完整地获得抗性种质资源有关信息,为病害流行程度预测、新品种选育和推广提供依据,同时对于其他作物遗传多样性和抗病性监测具有一定借鉴意义。
当前,四川省小麦审定品种较多,主要集中在川麦、川育、川农、绵麦、内麦及西科麦等系列,其抗条锈病品种抗性基因类型较为复杂,但多数品种主要是以贵农系列、南农92R系列、硬粒小麦人工合成种后代以及CIMMYT小麦材料为抗性来源[23-24]。本研究中,33个审定品种主要分成两大类,其中24个被聚类在基于Nei氏遗传距离划分的C组中,参试的川农、川育系列均在此组中,说明其遗传遗传背景较窄。其余9个品种被归在D组,包括川麦37、利用硬粒小麦-节节麦人工合成育种的川麦42及其姊妹系川麦43[25]、川麦47[26]及其亲本绵阳26、川麦45、绵阳11、绵阳31和绵麦37。研究结果表明,目前四川品种大部分与繁六衍生品种绵阳11、绵阳26已有较大的遗传距离。
在各地检出同源样品的审定品种有:绵阳11、绵阳26、川育10号、川麦37、川麦38、川麦39、川麦44、川麦43、川麦47、川麦50、川麦107、川农19、绵麦46、川育20和川育21,其中前6个品种为2004年前审定的品种,在2011年以前对条锈病高抗[27]。2011年前盐亭病圃中,贵农22致病类群未占优势[28]。邝文静等[20]发现,贵农22致病类群对2005年以后四川审定的多个含有 Yr10、 Yr24抗条锈基因的品种具有毒性。2011年接种贵农22类群条锈病菌株的郫县病圃及2014年在四川其他大田中,有14个参试抗病品种对其丧失抗性。总体来看,四川当前小麦品种抗条锈性整体水平在下降,这与条锈菌新致病型小种的出现和流行息息相关,应引起有关小麦育种单位和生产部门注意。
D组成员中,川麦47与川麦42、川麦43均属硬粒小麦×节节麦人工合成种衍生品种,其亲本之一为绵阳26,与川麦42、川麦43遗传距离较大,在川麦42、川麦43丧失抗性后仍表现较好抗条锈性。川麦45的父、母本均含有CIMMYT提供的普通小麦品种血缘,与其他四川小麦品种遗传距离均较大,目前仍保持抗条锈性。从不同遗传背景品种的抗性变化可以看出,选用不同的抗性材料与不同亲本配组,提高后代品种的遗传多样性,有利于减缓病菌生理小种变化引起的品种抗性丧失。由于生产上四川大田种植小麦具有较高的遗传多样性,虽然2014年贵农22致病类型上升为优势类群,但大面积种植样品中仍有20.8%~28.5%田块的品种保持了抗性,说明生产上还存在有一定的抗锈性种质资源,值得挖掘和利用。
白粉病是四川小麦生产中的主要病害,但育种部门对白粉病的重视程度低于对条锈病。参试的33个审定品种中,2012年仅绵麦37在白粉病菌毒性较强的盐亭和郫县病圃中均表现抗性,两年的大田样品在盐亭表现抗病的占15.1%~19.9%,高于审定品种的抗性比例,应加大抗病基因的挖掘。2014年度,参试审定品种中,仅绵阳33、绵麦37和川育20在两个病圃均表现抗白粉病,但与2012年鉴定结果相比,生产上大面积种植样品的抗性比例有所下降,仅为12.8%~16.8%。目前,四川小麦面积急剧减少,小麦主产区主要集中在利于白粉病越夏的盆地北部,生产上对抗白粉病品种有强烈需求,相关部门应重视白粉病抗源筛选及抗病品种选育和推广。
当前四川小麦品种抗条锈性和白粉性整体水平仍较低,形式较为严峻,必须加强病害预测预报和防治,以避免大区流行。今后小麦抗病育种在抗源选用上,应避免主要集中在 Yr24/26、贵农系列、 Pm21等少数抗源上,保持抗源异质性。同时应积极挖掘新的抗病基因,重视抗病基因聚合育种等。
[1] ZHU Y Y,CHEN H R,FAN J H,etal.Genetic diversity and disease control in rice [J].Nature,2000,406:719.
[2] TIAN Q Z,ZHOU R H,JIA J Z.Genetic diversity trend of common wheat(TriticumaestivumL.) in China revealed with AFLP markers [J].GeneticResourcesandCropEvolution,2005,52:326.
[3] PETRA O,CATHERINE C B,RALF S P.A genetic analysis of quantitative resistance to late blight in potato:Towards marker-assisted selection [J].MolecularBreeding,1999,5:400.
[4] WALDEN D B.Maize Breeding and Genetics [M].New York:Wiley-Interscience,1978:284.
[5] HOVMOLLER M S,WALTER S,JUSTESEN A F.Escalating threat of wheat rusts [J].Science,2010,329:369.
[6] BROWN J M,HOVMOLLER M S.Aerial dispersal of pathogens on the global and continental scales and its impact on plant disease [J].Science,2002,297:537.
[7] 吴立人,牛永春.我国小麦条锈病持续控制策略[J].中国农业科学,2000,33(5):1.
WU L R,NIU Y C.Strategies of sustainable control of wheat stripe rust in China [J].ScientiaAgriculturaSinica,2000,33(5):1.
[8] XU Z,DUAN X Y,ZHOU Y L,etal.Population genetic analysis ofBlumeriagraminisf.sp.triticiin Qinghai province,China [J].JournalofIntegrativeAgriculture,2014,13(9):1953.
[9] 陈万权,康振生,马占鸿,等.中国小麦条锈病综合治理理论与实践[J].中国农业科学,2013,46(20):4256.
CHEN W Q,KANG Z S,MA Z H,etal.Integrated management of wheat stripe rust caused byPucciniastriiformisf.sp.triticiin China [J].ScientiaAgriculturaSinica,2013,46(20):4256.
[10] 沈 丽,罗林明,陈万权,等.四川省小麦条锈病流行区划及菌源传播路径分析[J].植物保护学报,2008,35(3):223.
SHEN L,LUO L M,CHEN W Q,etal.Epidemic zones and dispersal routes of wheat stripe rust caused byPucciniastriiformisin Sichuan [J].ActaPhytophylacicaSinica,2008,35(3):223.
[11] LIU N,GONG G S,ZHANG M,etal.Over-summering of wheat powdery mildew in Sichuan province,China [J].CropProtection,2012,34:112.
[12] MCDONALD B A,LINDE C.Pathogen population genetics,evolutionary potential,and durable resistance [J].AnnualReviewofPhytopathology,2002,40:249.
[13] SAGHAI-MAROOF M A,SOLIMAN K M,JORGENSEN R A,etal.Ribosomal DNA spacer-length polymorphisms in barley:Mendelian inheritance,chromosomal location,and population dynamics [J].ProceedingsoftheNationalAcademyofSciences(USA),1984,81:8015.
[14] ADAMS D C,ROHLF F J.Ecological character displacement in Plethodon:Biomechanical differences found from a geometric morphometric study [J].ProceedingsoftheNationalAcademyofScience(USA),2000,97:4106.
[15] YEH F C,YANG R C,BOYLE T B J,etal.POPGENE,the user-friendly shareware for population genetic analysis[EB/OL](2016-05-13)[2014-01-17].http://www.ualberta.ca/~fyeh/popgene_download.html,1st Jan,2014.
[16] LINE R F,QAYOUM A.Virulence,aggressiveness,evolution,and distribution of races ofPucciniastriiformis(the cause of stripe rust of wheat) in North America,1968-1987[J].TechnicalBulletin,1991,1788:44.
[17] MCINTOSH R A,SILK J,THE T T.Cytogenetic studies in wheat XVII.Monosomic analysis and linkage relationships of gene Yr15 for resistance to stripe rust [J].Euphytica,1996,89:397.
[18] 盛宝钦,段霞瑜.对记载小麦成株白粉病“0-9级法”的改进[J].北京农业科学,1991,9(1):38.
SHENG B Q,DUAN X Y.The improvement of grade 0-9 method of powdery mildew in adult wheat plant [J].BeijingAgriculturalSciences,1991,9(1):38.
[19] LIU T G,PENG Y L,CHEN W Q,etal.First detection of virulence inPucciniastriiformisf.sp.triticiin China to resistance genes Yr24(=Yr26) present in wheat cultivar Chuanmai 42 [J].PlantDisease,2010,94(9):1163.
[20] 邝文静,张贵胜,章振羽,等.小麦条锈病菌avrYr10/24/26/ch42突变体的毒性研究[J].西南农业学报,2013,26(6):2323.
KUANG W J,ZHANG G S,ZHANG Z Y,etal.Studies on virulence of avrYr10/24/26/ch42 mutants ofPucciniastriiformisf.sp.tritici[J].SouthwestChinaJournalofAgriculturalSciences,2013,26(6):2323.
[21] 贾继增,张正斌,DEVOS K,等.小麦21条染色体RFLP作图位点遗传多样性分析[J].中国科学(C辑),2001,31(1):14.
JIA J Z,ZHANG Z B,DEVOS K,etal.Genetic diversity analysis of 21 chromosomes RFLP mapping sites on wheat[J].ScienceinChina(SeriesC),2001,31(1):14.
[22] 肖 静,田纪春.小麦(T.aestivumL.)D基因组的研究进展[J].分子植物育种,2008,6(3):538.
XIAO J,TIAN J C.Reviewed on D genome ofT.aestivumL.[J].MolecularPlantBreeding,2008,6(3):538.
[23] 章振羽,姬红丽,沈 丽,等.四川58个小麦品种苗期抗条锈基因推导及成株期抗性表现[J].植物保护学报,2012,39(1):21.
ZHANG Z Y,JI H L,SHEN L,etal.Postulation of resistance genes and evaluation of adult resistance to stripe rust in 58 cultivars from Sichuan [J].ActaPhytophylacicaSinica,2012,39(1):21.
[24] LI J,WAN H S,YANG W Y.Synthetic hexaploid wheat enhances variation and adaptive evolution of bread wheat in breeding processes [J].JournalofSystematicsandEvolution,2014,52(6):740.
[25] 魏会廷,李 俊,杨武云,等.利用SSR 标记分析“川麦42”和“川麦43”的遗传差异[J].西南农业学报,2006,19(2):180.
WEI H T,LI J,YANG W Y,etal.The genetic comparison of ‘Chuanmai 42’ and ‘Chuanmai 43’ revealed by microsatellite marker [J].SouthwestChinaJournalofAgriculturalSciences,2006,19(2):180.
[26] 李 俊,魏会廷,胡晓蓉,等.人工合成小麦衍生品种川麦47的抗条锈病SSR标记定位[J].农业生物技术学报,2005,15(2):320.
LI J,WEI H T,HU X R,etal.Molecular mapping of stripe rust resistance gene in synthetic derivative Chuanmai 47 [J].JournalofAgriculturalBiotechnology,2005,15(2):320.
[27] 章振羽,沈 丽,刘太国,等.不同小麦抗条锈基因及小麦品种在四川的有效性[J].西南农业学报,2010,23(1):19.
ZHANG Z Y,SHEN L,LIU T G,etal.Efficiency of different resistant genes and varieties toPuccinicastriiformisf.sp.triticiin Sichuan province [J].SouthwestChinaJournalofAgriculturalSciences,2010,23(1):19.
[28] LIANG Y,ZHANG Z Y,PENG Y L,etal.Resistance in wild emmer wheat(Trtiticumdicoccoides) from the fertile crescent to yellow rust in China [J].JournalofFood,Agriculture&Environment,2013,11(3&4):1399.
Genetic Diversity and Resistance to Stripe Rust and Powdery Mildew of Wheat Varieties in Sichuan Province
XU Zhi1,ZHANG Zhenyu1,JI Hongli1,KUANG Wenjing1,2,
SHEN Li3,NI Jianying1,PENG Yunliang1
(1.Institute of Plant Protection,Sichuan Academy of Agricultural Sciences/Key Laboratory of Integrated Pest Management of Crops in Southwest China,Ministry of Agriculture,Chengdu,Sichuan 610066,China; 2.Sichuan Agricultural University,Ya’an,Sichuan 625014,China; 3.Plant Protection Station,Sichuan Agricultural Bureau,Chengdu,Sichuan 610041,China)
Stripe rust and powdery mildew are two of the most destructive diseases of wheat in Sichuan province. For the sake of monitoring genetic diversity and resistance breakdown in wheat against the stripe rust and powdery mildew,33 registered varieties were used,and field samples were collected respectively from 615 and 577 plots located at different regions of Sichuan from 2009 to 2011.The results of SSR analysis of 115 field samples and 33 registered varieties showed 38 polymorphic fragments and the genetic similarity coefficients among the tested samples and varieties were 0.6-1.The observed number of alleles,effective number of alleles,Nei’s gene diversity index,Shannon’s information index,number of polymorphic loci,and proportion of polymorphic loci of the 115 field samples were 1.868 4,1.422 8,0.253 0,0.386 7,33 and 86.8%,respectively,which were higher than those of 33 registered varieties. Phylogenic analysis indicated most of registered varieties and field samples were homologous,which were present in different regions.A significant breakdown of resistance to strip rust was monitored in field wheat samples in Sichuan province whereas the breakdown of resistance to powdery mildew was not obvious.
Wheat; SSR; Stripe rust; Powdery mildew; Disease resistance
时间:2017-01-16
2016-05-15
2016-06-17
国家科技支撑计划项目(2012BAD19B04);国家公益性行业(农业)科研专项(200903035,201303016,201503127);四川省育种攻关项目(2011NZ0098-17); 四川省财政专项(2011JYGC06-021,2014CXSF-021)
E-mail:xuzhi0125@163.com(徐 志); zhzhyu1982@163.com(章振羽,与第一作者同等贡献)
彭云良(E-mail:pengyunliang@aliyun.com)
S512.1;S330
A
1009-1041(2017)02-0258-10
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170116.1835.030.html
