陈化烟叶中1株果胶酶高产菌的分离、筛选与鉴定
2017-03-01张耀广杨宗灿刘向真杨永锋李家美
张耀广,杨宗灿,刘向真,杨永锋,梁 慎,李家美*
(1.河南农业大学 生命科学学院,河南 郑州 450002; 2.河南中烟工业有限责任公司技术中心,河南 郑州 450000; 3.河南省农业科学院,河南 郑州 450002)
陈化烟叶中1株果胶酶高产菌的分离、筛选与鉴定
张耀广1,杨宗灿2,刘向真2,杨永锋1,梁 慎3,李家美1*
(1.河南农业大学 生命科学学院,河南 郑州 450002; 2.河南中烟工业有限责任公司技术中心,河南 郑州 450000; 3.河南省农业科学院,河南 郑州 450002)
烤烟中的高果胶含量严重影响烟草吸食品质和陈化速度。为降低烟草中的果胶含量,提高烟草及烟草制品的品质及安全性,从不同年份和不同产地的18份复烤烟草中共分离筛选出有降解果胶能力的细菌38株和真菌9株。其中,XC-8、XC-30、SMXP-57、SMXP-58、SMXP-62共5株细菌具有较高的降解果胶的能力,在发酵时间24 h、发酵温度30 ℃、接种量10%条件下果胶酶活性分别为176、179、143、192、121 U/mL。其中,菌株SMXP-58酶活性最高(192 U/mL),通过16S rDNA序列分析并结合形态、理化特性分析,确定SMXP-58菌株为枯草芽孢杆菌(Bacillussubtilis)。将SMXP-58菌株制成的菌剂(9.6×107个/mL)喷施于100 g烟叶表面,发酵3 d的烟叶评吸总分提高了1.02,进一步优化发酵条件,在发酵时间60 h、菌液量1 mL、水量20 mL的条件下,烟叶中果胶含量最低(7.45%)。
陈化烟叶; 枯草芽孢杆菌; 果胶酶; 酶活性
烟叶陈化是提高烟叶吸食品质、增加香气、降低危害性的重要环节。未经陈化的烤烟中因含有较多的蛋白质、果胶、纤维素、淀粉和高级脂肪酸等大分子物质,在燃烧过程中产生令人不舒服的气味而不能直接吸食。其中,以α-1,4糖苷键聚合形成的聚半乳糖醛酸[1]为基本结构的果胶是烟草中的重要成分。果胶类物质含量过高,会造成烟草燃烧不完全而产生甲醇,甲醇进一步氧化成甲醛、甲酸等,对烟草吸食及安全性产生不利影响。因此,果胶含量已成为评价烟草及烟草制品品质的重要指标,降低烟叶中的果胶含量对提高烟草品质有重要意义[2-4]。
目前,为加速烟草陈化速度,提高烟草吸食质量、安全性及经济效益,人们常利用有益微生物来降解烟叶中大分子物质的含量。在烟叶醇化或发酵中,烟叶表面微生物的种类和数量对醇化效果影响较大[3]。Chen等[4]从醇化多年的烟叶中分离到一株能够有效降低白肋烟、香料烟和津巴布韦烤烟等烟叶烟碱含量的假单胞菌(Pseudomonassp.),该菌的酶液可以改善烟叶吸食品质、减少烟叶刺激性及青杂气;Gong等[5]从烟草栽培土壤中分离到一株能有效降解烟叶烟碱含量的红球菌(Rhodococcussp.);黄静文等[6]从烤烟叶面上分离筛选出一株短小芽孢杆菌(Bacilluspumilus)Van35,将其制成菌液喷施于烟丝上并置于45 ℃、湿度60%条件下发酵处理21 d后,烟丝中纤维素、蛋白质、总氮和烟碱含量均有所下降。谢和等[7]在烤烟发酵过程中施加枯草芽孢杆菌(Bacillussubtilis),经过45 ℃、相对湿度65%条件下发酵8 d,烟叶中总游离氨基酸含量均有不同程度的降低。而在利用产果胶酶微生物降解烟草果胶含量方面,人们也做了很多研究工作。何伟等[8]从片烟样品中筛选得到一株果胶酶高产菌株克雷伯氏杆菌(Klebsiellasp.),并对此菌株的发酵培养基进行了优化。贺兆伟等[9]报道了一株疣孢青霉(Penicilliumverruculosum),能够降解烟草果胶。代同成等[10]以果胶为碳源,对津巴布韦片烟烟叶表面产果胶酶细菌进行了分离和筛选。而在自然陈化中,果胶难以被降解。目前,从陈化烟叶中分离筛选具有较强降解果胶能力的微生物以降解烟叶中果胶的研究较少。鉴于此,本研究以源自河南、云南和福建不同年份的陈化烟叶为研究材料,从中分离筛选出能够高效降解果胶的微生物,用以降解烟叶中果胶质,以进一步提高烟叶的吸食品质,提高烟叶吸食的安全性。
1 材料和方法
1.1 材料
1.1.1 供试烟叶 河南(许昌和三门峡)、福建(三明和南平)、云南(楚雄和临沧)6个产地2011、2012、2013年3 a共18份复烤烟叶样品,粉碎后用于筛选果胶酶产生菌;2015年洛阳复烤烟DBH41用于筛选菌株的应用验证。
1.1.2 培养基 营养琼脂(NA)培养基:胰蛋白胨10 g、牛肉膏3 g、NaCl 5 g、H2O 1 000 mL、琼脂粉 12 g,pH值 7.0,121 ℃灭菌20 min。液体NA培养基不加琼脂粉,该培养基用于细菌的分离与培养。
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯 200 g、葡萄糖 20 g、琼脂粉 12 g、H2O 1 000 mL,用于烟叶表面真菌的分离与筛选。
果胶酶产生菌选择培养基:果胶 4 g、K2HPO40.1 g、MgSO40.5 g、NaNO33 g、FeSO4·7H2O 0.01 g、刚果红0.4 g、琼脂粉12 g、H2O 1 000 mL,pH 值7.0,121 ℃灭菌20 min,用于筛选降解果胶的微生物。
产果胶酶培养基:桔皮粉1 g、K2HPO40.1 g、MgSO40.5 g、NaNO33 g、FeSO4·7H2O 0.01 g、H2O 1 000 mL,用于微生物果胶酶诱导培养。
1.2 方法
1.2.1 烟叶中微生物的初步分离 称取1 g烟叶粉末,加入含有9 mL无菌水的试管中,250 r/min振荡15 min后,静置5 min。采用2层无菌擦镜纸过滤。取此菌悬液1 mL于9 mL无菌水中,依次配制10-2和10-3稀释度的菌悬液;并吸取10-2、10-3稀释度的菌悬液100 μL,分别涂布于NA和PDA培养基平板上,并分别置于37 ℃和28 ℃条件下培养过夜。
1.2.2 产果胶酶微生物的筛选 将上述分离获得的细菌、真菌依次接种到果胶酶产生菌选择培养基上,细菌在37 ℃条件下培养,真菌在28 ℃条件下培养。观察并计算透明圈直径与菌落直径的比值和透明圈明显程度。
将能够在果胶酶产生菌选择培养基上产生透明圈的菌株接种到含有5 mL液体NA的18 mm×180 mm的试管中,30 ℃下150 r/min培养过夜,按照10%的接种量接入含50 mL产果胶酶培养基的锥形瓶中,30 ℃下150 r/min培养24 h。取发酵24 h的菌液,于3 500 r/min条件下离心10 min后测其果胶酶活性。
1.2.3 烟叶中果胶酶产生菌的果胶酶活性测定 采用DNS法[11]测定果胶酶活性,利用3,5-二硝基水杨酸与醛糖共热产生棕红色的氨基化合物,其颜色浅深在一定范围内与还原糖含量成正比的原理,于540 nm处测其吸光度,根据还原糖标准曲线计算出果胶酶活性。在含桔皮粉的产果胶酶培养基中进行菌株果胶酶诱导培养,并测其酶活性。定义1 mL酶液在30 ℃条件下,1 h分解果胶产生1 mg半乳糖醛酸为一个酶活性单位。酶活性计算公式:X=[(A-A0)×D×5]/(K×t),式中,A为酶液吸光度,A0为空白样的吸光度,K为标准曲线的斜率,D为稀释倍数(1 000倍),t为反应时间(h)。
1.2.4 果胶酶产生菌SMXP-58的16S rDNA分析 以FP(5’-AGAGTTTGATCCTGGCTCAG -3’)和RP(5’-GGTTACCTTGTTACGACTT-3’)为引物,对筛选得到的果胶酶产生菌SMXP-58进行PCR扩增。PCR反应体系为50 μL:TaKaRa LATaq(5 U/μL)0.5 μL、10×LATaqbuffer 5 μL、dNTP mixture 2 μL、模板 0.5 μg、FP (10 μmol/L)2 μL、RP(10 μmol/L)2 μL,加ddH2O至50 μL。PCR扩增条件:94 ℃ 2 min;94 ℃ 30 s、56 ℃ 45 s、72 ℃ 80 s,30个循环;72 ℃ 10 min。将获得的PCR扩增产物进行测序。
下载同源性较高的14种菌株[蜡状芽孢杆菌(Bacilluscereus)、简单芽孢杆菌(Bacillussimplex)、枯草芽孢杆菌(Bacillussubtilis)、嗜硼芽孢杆菌(Bacillusboroniphilus)、梭形芽孢杆菌(Bacillusfusiformis)、巨大芽孢杆菌(Bacillusmegaterium)、短小芽孢杆菌(Bacilluspumilus)等]的16S rDNA序列,将测得序列与14种菌株通过DNAMAN软件进行序列比对分析。
1.2.5 果胶酶产生菌SMXP-58的形态学与理化性质鉴定 将SMXP-58接种在NA固体培养基上,于37 ℃条件下培养24~72 h后,观察菌落外部形态特征;使用显微镜观察真菌形态,油镜观察细菌形态[12-13]。
参考朱大恒等[14]的方法,对果胶酶产生菌SMXP-58分别进行革兰氏染色、V-P、过氧化氢酶、甲基红试验以及抗生素反应试验。
1.2.6 果胶酶产生菌SMXP-58在烟叶发酵中的应用
1.2.6.1 SMXP-58菌剂的制备 将保存备用的菌株SMXP-58移入LB平板上,置于生化气候箱中37 ℃培养1~2 d,于超净工作台中刮取少量菌体,加入到含有5 mL液体LB的18 mm×180 mm的试管中,30 ℃、150 r/min条件下于摇床中培养过夜,将1 mL菌悬液接种于含100 mL LB培养基的250 mL锥形瓶(已灭菌)中,30 ℃、150 r/min条件下于摇床中培养,至菌悬液OD540值为2时,3 600 r/min离心10 min,弃上清液,加入等体积的无菌水,即得液态菌剂(9.6×107个/mL)。
1.2.6.2 SMXP-58菌剂发酵不同时间对烟叶感官品质的影响 取100 g 2015年洛阳复烤烟DBH41,施用菌剂量为1 mL、水量为20 mL,同时以不施加菌剂和水为CK,分别发酵1(T1)、2(T2)、3(T3)、4(T4)、5(T5)、6(T6) d,于30 ℃暗处发酵。发酵完成后,再将烟叶80 ℃处理30 min,然后45 ℃烘干,平衡水分后制成卷烟并进行评吸。
1.2.6.3 SMXP-58菌剂发酵烟叶条件的正交试验 根据1.2.6.2的结果,进一步优化SMXP-58菌剂发酵烟叶的条件:取100 g 2015年洛阳复烤烟DBH41,以发酵时间(A)、菌液量(B)、水量(C)为试验因素,设计三因素三水平(表1)正交试验,优化SMXP-58菌株有效降解烟叶果胶的适宜条件。
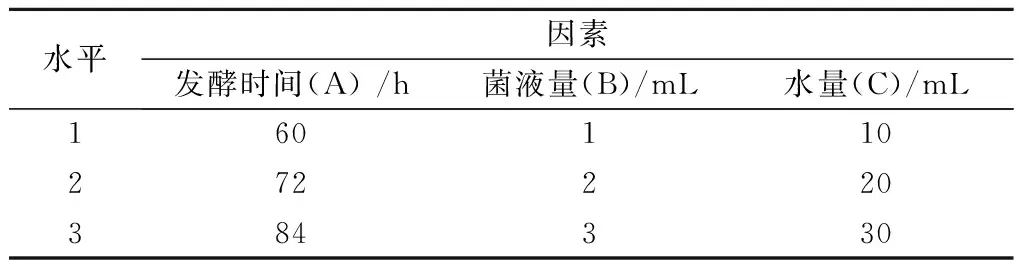
表1 菌株SMXP-58降解烟叶中果胶的正交试验因素和水平
烟叶中果胶含量采用咔唑硫酸分光光度法测定[15],根据不同烟叶样品中半乳糖醛酸(GA)的含量,换算出相应烟叶中的果胶含量。GA=[C×50/(5×50)]/(W×106)×100%,其中,C为从标准曲线查得的所测果胶液中GA的浓度(mg/L),W为烟叶样品粉末质量(g)。
2 结果与分析
2.1 陈化烟叶中果胶酶产生菌的初筛结果
以河南(许昌和三门峡)、福建(三明和南平)、云南(楚雄和临沧)6个产地2011、2012、2013年3个年份共计18份复烤烟叶样品为材料,经菌落大小、颜色、形态分析,共分离获得细菌123株、真菌9株。这些细菌、真菌经果胶酶产生菌选择培养基筛选,获得能够产生果胶降解透明圈的细菌38株、真菌9株。将透明圈/菌落直径较大的5株细菌分别命名为XC-8、XC-30、SMX-57、SMXP-58、SMX-62,透明圈/菌落直径分别为1.9、1.8、1.6、2.5、1.6,其中SMXP-58菌株透明圈与菌落直径比值最大、最明显。然后,对此5株细菌进行了果胶酶活性测定。
2.2 陈化烟叶中高产果胶酶产生菌的复筛结果
将初筛的 5个菌株接种于产果胶酶培养基中,于30 ℃下150 r/min振荡培养24 h后,测定OD540并计算果胶酶活性(表2)。由表2可见,菌株SMXP-58具有最高的果胶酶活性(192 U/mL),可以作为烟叶中高果胶酶产生菌候选菌株。

表2 烟叶中果胶酶产生菌的果胶酶活性 U/mL
2.3 果胶酶产生菌SMXP-58的16S rDNA序列分析
采用16S rDNA基因片段通用引物FP/RP对SMXP-58进行PCR扩增,并进行测序,目的片段为1 416 bp,使用DNAMAN软件,选取同源性较高的14种模式细菌菌株进行系统进化分析,结果显示,菌株SMXP-58与枯草芽孢杆菌(Bacillussubtilis)的同源性最高,达99%,表明SMXP-58与枯草芽孢杆菌的亲缘关系最近(图1)。

图1 菌株SMXP-58与相关菌株基于16S rDNA序列构建的系统发育进化树
2.4 果胶酶产生菌SMXP-58的形态学观察
在30 ℃条件下培养48 h后,SMXP-58菌落直径为2~5 mm,乳白色,无光泽,不透明,表面平整或出现不规则褶皱凸起,菌落近圆形或不规则,菌落边缘呈不规则细波状。菌株个体呈杆状,很少呈链状,菌体大小为(0.7~1.0) μm×(1.4~2.0)μm(图2)。

图2 菌株SMXP-58的形态(×100)
2.5 果胶酶产生菌SMXP-58的理化鉴定
经试验分析发现,菌株SMXP-58革兰氏染色呈阳性,过氧化氢酶试验呈阳性,甲基红试验呈阳性,V-P试验呈阳性,酪素水解试验呈阳性。抗生素(30 μg/mL)试验表明,该菌对链霉素、氨苄青霉素有抗性,对头孢菌素、卡那霉素敏感(表3)。
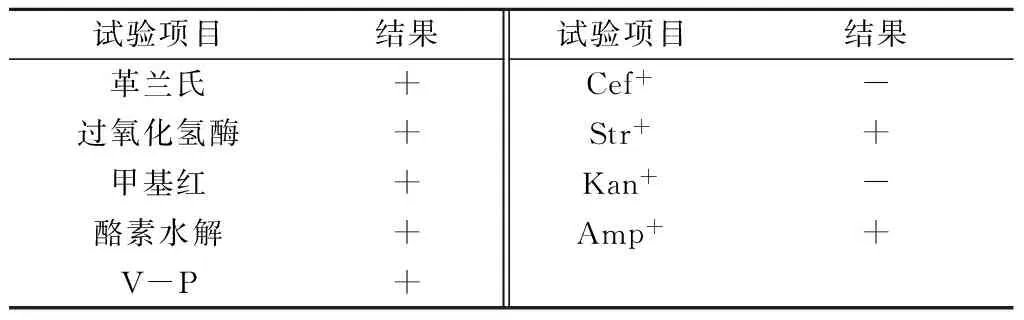
表3 菌株SMXP-58的部分生理生化特性
注:+表示阳性,-表示阴性;Cef+、Str+、Kan+、Amp+分别为头孢菌素、链霉素、卡那霉素、氨苄青霉素。
2.6 SMXP-58菌剂发酵不同时间对烟叶感官品质的影响
由表4可见,施用SMXP-58菌剂后发酵1、2、3、4、5、6 d,烟叶的评吸总分较CK有所提升,以发酵3 d的评吸总分最高,为59.51,较CK提升1.02分。可见,最佳发酵时间在3 d左右,故进一步进行发酵条件优化时在3 d(72 h)的基础上各±12 h,将发酵时间分别设为60、72、84 h。

表4 经SMXP-58菌剂发酵烟叶的评吸总分
2.7 SMXP-58菌剂发酵烟叶条件的正交试验结果
由于在一定范围内,烟叶果胶含量越低越好。由表5可见,最优水平组合为A1B1C2,即发酵时间为60 h,菌液量为1 mL(100 g烟叶),水量为20 mL(100 g烟叶),在此条件下发酵效果最好,果胶含量最低;比较R值可知RB>RC>RA,可见,菌液量对发酵效果的影响最大,其次是水量,而发酵时间的影响最小。
对优化处理方案进行了验证试验,将由菌株SMXP-58制成的菌剂喷施于100 g烟叶表面,按发酵时间60 h、菌液量1 mL、水量20 mL对烟叶进行发酵后,烟叶中的果胶含量为7.45%,低于表5中结果。

表5 菌株SMXP-58优化降解烟叶中果胶的正交试验结果
3 结论与讨论
本研究分离出123株细菌和9株真菌,总体数量较少。韩锦峰等[16]认为,烟叶中某些成分会抑制细菌的生长,且烟叶烘烤的高温杀死了大量不耐高温的微生物。其中,具有果胶酶分泌特性的微生物包括38株细菌(占总体细菌的30.9%)以及9株真菌,对果胶酶产生菌进行初筛时,5个菌株计算得出的透明圈/菌落直径与复筛时测得的果胶酶活性有一定的相关性,透明圈/菌落直径大的菌株果胶酶活性也较高,根据透明圈/菌落直径大小可简化筛选果胶酶产生菌的过程。其中,菌株SMXP-58表现出透明圈较大、透明度高、果胶酶活性高的特点。
16S rDNA序列分析结果显示,SMXP-58菌株与枯草芽孢杆菌(Bacillussubtilis)的同源性高达99%,亲缘关系最近,结合形态学与理化鉴定,参考《伯杰细菌鉴定手册》[12],确定菌株SMXP-58为枯草芽孢杆菌(Bacillussubtilis)。
将由菌株SMXP-58制成的菌剂(9.6×107个/mL)喷施于100 g烟叶表面,在发酵时间60 h、菌液量1 mL、水量20 mL的条件下,烟叶中果胶含量可降低至7.45%,有效加速了烟叶中果胶的降解并改善烟叶品质。
[1] 赵铭钦,汪耀富,杜长彬,等.陈化期间烟叶香气成分消长规律的研究[J].中国农业大学学报,1997,2(3):73-77.
[2] 朱大恒,韩锦峰,张爱萍,等.自然醇化与人工发酵对烤烟化学成分变化的影响比较研究[J].烟草科技,1999(1):3-5.
[3] 杨金奎,段焰青,陈春梅,等.醇化烟叶表面可培养微生物的鉴定和系统发育分析[J].烟草科技,2008(11):51-55.
[4] Chen C M,Li X E,Yang J K,etal.Isolation of nicotine-degrading bacteriumPseudomonassp.Nic22,and its potential application in tobacco processing[J].International Biodeterioration & Biodegradation,2008,62(3):226-231.
[5] Gong X W,Yang J K,Duan Y Q,etal.Isolation and characterization ofRhodococcussp.Y22 and its potential application to tobacco processing[J].Research in Microbiology,2009,160(3):200-204.
[6] 黄静文,段焰青,者为,等.短小芽孢杆菌改善烟叶品质的研究[J].烟草科技,2010(8):61-64.
[7] 谢和,韩忠礼,赵维娜.微生物发酵对烤烟内在品质的影响[J].山地农业生物学报,1999,18(4):227-230.
[8] 何伟,付相敏,王金华,等.一株从片烟中分离的果胶酶菌株培养条件优化[J].湖北工业大学学报,2015,30(5):16-19,41.
[9] 贺兆伟,奚家勤,邓宾玲,等.烟叶中高产果胶酶菌株的筛选及酶学性质[J].烟草科技,2013(5):72-76.
[10] 代同成,范坚强,郑湖南,等.片烟产果胶酶细菌的鉴定及酶活测定[J].微生物学通报,2011,38(6):816-824.
[11] 张飞,岳田利,费坚,等.果胶酶活力的测定方法研究[J].西北农业学报,2004,13(4):134-137.
[12] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:274-442.
[13] 李振高,骆永明,滕应.土壤与微生物研究法[M].北京:科学出版社,2008:162-163.
[14] 朱大恒,李彩霞.烟气有害成分与烟叶化学成分的关系[J].烟草科技,1999(4):25-27.
[15] 张小玲.果胶的咔唑硫酸分光光度测定法研究[J].甘肃农业大学学报,1999,34(1):75-78.
[16] 韩锦峰,朱大恒,刘卫群,等.陈化发酵期间烤烟叶面微生物活性及其应用研究[J].中国烟草科学,1997(4):13-14.
Isolation,Screening and Identification of A High Pectinase-producing Bacterial Strain from Aging Tobacco Leaf
ZHANG Yaoguang1,YANG Zongcan2,LIU Xiangzhen2,YANG Yongfeng1,LIANG Shen3,LI Jiamei1*
(1.College of Life Sciences,Henan Agricultural University,Zhengzhou 450002,China; 2.Technology Center of China Tobacco Henan Industrial Co.,Ltd.,Zhengzhou 450000,China; 3.Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
The amount of pectin in flue-cured tobacco seriously influences the qulity and aging speed of tobacco.In order to decrease the pectin content in flue-cured tobacco,improve the quality and safety of flue-cured tobacco,38 bacterial strains and 9 fungi strains which could degrading the pectin were isolated from 18 kinds of flue-cured tobacco from different years and different origins.The bacterial strains XC-8,XC-30,SMXP-57,SMXP-58,SMXP-62 possessed higher ability of degrading pectin substance,and their enzymatic activity were 176,179,143,192,121 U/mL when the culture period was 24 h at the temperature of 30 ℃ and innoculation amount of 10%.Strain SMXP-58 possessed the highest enzymatic activity(192 U/mL),which was identified asBacillussubtilisbased on 16S rDNA sequence analysis and morphological,physichemical characters analysis.Total score of smoking increased by 1.02 after spraying the bacterial agent(9.6×107bacteria per milliliter) made from SMXP-58 on the 100 g tabacco.Tobacc pectin was the least with 7.45% under the conditions of fermenting 60 h,bacterial agent 1 mL,water 20 mL.
aging tobacco leaf;Bacillussubtilis; pectinase; enzymatic activity
2015-08-15
河南中烟工业有限责任公司技术开发项目(30800675)
张耀广(1990-),男,河南漯河人,在读硕士研究生,研究方向:烟叶陈化。E-mail:ygzhanghn@sina.com
*通讯作者:李家美(1969-),男,河南信阳人,副教授,博士,主要从事植物资源保护研究。E-mail:jmli@ibcas.ac.cn
TS41+4
A
1004-3268(2017)02-0143-05
