猪源大肠埃希菌超广谱β-内酰胺酶的检测及其耐药性分析
2017-03-01赵凤菊李井春
赵凤菊,曹 东,李井春,魏 澍
(辽宁省动物疫病预防控制中心,辽宁 沈阳 110164)
猪源大肠埃希菌超广谱β-内酰胺酶的检测及其耐药性分析
赵凤菊,曹 东,李井春,魏 澍
(辽宁省动物疫病预防控制中心,辽宁 沈阳 110164)
为了解辽宁地区猪源大肠埃希菌产超广谱β-内酰胺酶(ESBLs)情况及耐药情况,采用纸片扩散法对从辽宁地区分离到的65株大肠埃希菌进行ESBLs检测及耐药性分析,并用PCR方法对确证的产ESBLs大肠埃希菌进行TEM、CTX-M、OXA和SHV基因型检测。结果发现,在65株大肠埃希菌中,20株大肠埃希菌产ESBLs,阳性率为30.77%;在20株产ESBLs大肠埃希菌中,9株为TEM型,1株为CTX-M型,8株为同时携带TEM型和CTX-M型,1株为同时携带TEM型和OXA型,1株为同时携带TEM型、CTX-M型和OXA型。药敏试验结果表明,产ESBLs菌株的耐药率明显高于非产ESBLS菌株,且产ESBLs菌株均为多重耐药菌株。可见,辽宁地区产ESBLs猪源大肠埃希菌的检出率较高,流行的主要基因型为TEM型和TEM+CTX-M型。
大肠埃希菌; 超广谱β-内酰胺酶; 基因型; 耐药性
肠杆菌科细菌抗β-内酰胺类抗生素主要是由β-内酰胺酶介导的抗生素水解[1],β-内酰胺酶包括青霉素酶、超广谱β-内酰胺酶(extended spectrum beta-lactamase,ESBLs)、碳青霉烯酶和头孢菌素酶[2]。其中,ESBLs能水解所有的青霉素类和头孢菌素类抗生素,包括广谱头孢菌素,如头孢噻肟或头孢他啶,但对头霉素、碳青霉烯类抗生素及酶抑制剂敏感[3-4]。ESBLs是以肠杆菌科细菌为代表的革兰氏阴性菌对β-内酰胺类抗生素耐药的主要原因之一[5],主要见于大肠埃希菌和克雷伯菌[6]。ESBLs通常位于质粒上,能通过结合、转化和转导形式在菌株和菌种间扩散,产ESBLs 菌耐药谱广,表现出多重耐药性,给临床疾病治疗带来严峻的挑战[7-9]。通过国内外相关研究可知,随着兽医临床上抗生素的广泛使用,大肠埃希菌的耐药情况越来越严峻,多重耐药现象普遍存在。不仅严重影响到畜牧业的健康发展,同时也严重威胁着人类健康。因此,有必要掌握动物源大肠埃希菌的耐药情况、ESBLs的分布情况及主要流行的ESBLs基因型,为猪大肠埃希菌病的综合防治提供科学依据。
为查明辽宁地区猪源大肠埃希菌产ESBLs情况、ESBLs主要基因型及产ESBLs大肠埃希菌的耐药情况,对分离到的65株菌进行了ESBLs的检测,并对产ESBLs菌株进行了基因型检测,分析了产ESBLs菌株与非产ESBLs菌株的耐药情况。为进一步研究猪源大肠埃希菌的耐药机制奠定基础,也为辽宁地区猪大肠埃希菌病的综合防控提供科学依据。
1 材料和方法
1.1 材料
1.1.1 菌株 菌株是从辽宁沈阳(A)、鞍山(C)、抚顺(D)、本溪(E)、锦州(G)、营口(H)、辽阳(K)、铁岭(M)、朝阳(N)、葫芦岛(P)10个不同地区病死猪或患病猪的组织脏器、活猪粪便中分离得到,共65株。全部菌株由辽宁省动物疫病预防控制中心实验室保存。质控菌株大肠埃希氏菌ATCC25922购自杭州市天和微生物试剂有限公司。
1.1.2 培养基及试剂 营养琼脂培养基、麦康凯培养基(生产批号分别为20130608、20130708)购自北京奥博星生物技术有限公司;头孢曲松(CRO,30 μg/片)、头孢噻肟(CTX,30 μg/片)、水解酪蛋白琼脂培养基(MH)、超广谱β-内酰胺酶检测试剂盒双纸片试条[头孢噻肟(CTX,30 μg/片),头孢噻肟/棒酸(CTX/CA,30 μg/片)]、头孢他啶(CAZ,30 μg/片)、头孢他啶/棒酸(CAZ/CA,30 μg/片)(生产批号分别为140506、140506、140509/141028)均购自杭州市天和微生物试剂有限公司;DNAzol基因组DNA提取试剂购自Invitrogen公司;Prime STAR®HS DNA Polymerase with GD Buffer、ExTaqDNA聚合酶、10×ExTaqBuffer、2.5 mmol/L dNTPs、DL2000 DNA Marker、溴化乙锭均购自大连宝生物科技有限公司。其他为实验室常规试剂。
1.1.3 引物设计 根据GenBank上登录的TEM、CTX-M、OXA和SHV基因序列,利用Primer Premier 5.0软件设计了4对特异性引物(表1),并由上海生工生物工程技术服务有限公司合成。
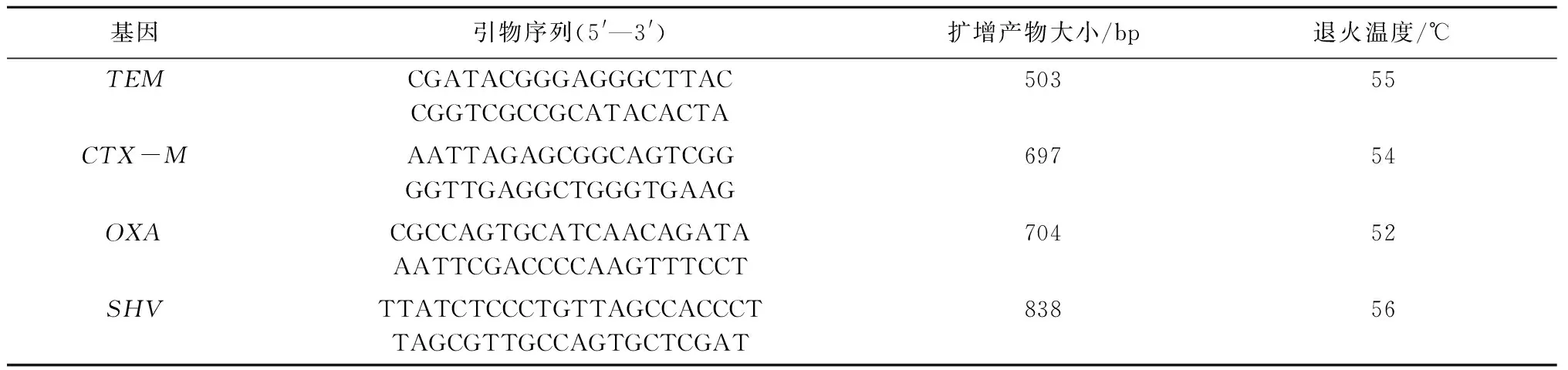
表1 ESBLs 4种基因型的PCR扩增引物
1.2 方法
1.2.1 ESBLs的检测
1.2.1.1 菌悬液的制备 将待检菌培养18~24 h后,挑取纯培养菌落置于无菌生理盐水中,制成相当于0.5麦氏单位的菌悬液,用灭菌棉签蘸取适量均匀涂抹到MH琼脂培养基表面,贴好纸片后,在35 ℃恒温培养箱中培养16~18 h,测量药敏试纸在平板中产生的抑菌环直径,检测结果根据NCCLS标准进行判定。
1.2.1.2 ESBLs初步筛选 采用纸片扩散法,筛选试验选用CRO和CTX 2种药敏纸片。若CRO抑菌环直径≤25 mm或CTX抑菌环直径≤27 mm,则提示试验菌株可能产生ESBLs,需进一步作表型确证试验来加以确定。
1.2.1.3 ESBLs表型确证 确证试验按ESBLs检测试剂盒双纸片试条操作说明进行。若确证试验时含棒酸纸片的抑菌环直径大于不加棒酸纸片的抑菌环5 mm以上,则判定产生ESBLs。
1.2.2 ESBLs基因型检测
1.2.2.1 细菌培养及菌液的DNA模板制备 将大肠埃希菌划线接种于麦康凯培养基于37 ℃培养18~24 h后,挑选典型菌落,用1 mL无菌生理盐水制备成一定浓度的菌悬液。吸取200 μL菌悬液至1.5 mL Eppendorf管中,加入800 μL DNAzol提取试剂,混匀后4 ℃、 12 000 r/min离心10 min。吸取900 μL上清,置于新的1.5 mL Eppendorf管中,加入500 μL无水乙醇,混匀后4 ℃、12 000 r/min离心5 min。吸弃上清,用无菌水配制的75%乙醇洗涤2次,干燥后用40 μL无菌水溶解沉淀,-20 ℃保存备用。
1.2.2.2 ESBLs基因型检测反应体系 采用25 μL反应体系,10×PCR Buffer 2.500 μL,2.5 mmol/L dNTP 2.000 μL,上、下游引物(20 μmol/L)各1.000 μL,ExTaq酶0.125 μL,灭菌水16.375 μL,模板2.000 μL。
1.2.2.3 ESBLs基因型测序反应体系 采用50 μL反应体系,Prime STAR HS DNA Polymerase 0.5 μL,2×Prime STAR GD Buffer(Mg2+plus)25.0 μL, dNTP Mixture(2.5 mmol/L each)8.0 μL,上、下游引物各1.0 μL(引物浓度为20 μmol/L),模板5.0 μL,灭菌水补至50.0 μL。
1.2.2.4 产ESBLs大肠埃希菌基因型检测 应用建立的基因型检测方法对确证产ESBLs的大肠埃希菌进行基因型检测。
1.2.2.5 扩增产物的序列测定 各选2株TEM和OXA基因型PCR产物及5株CTX-M基因型PCR产物直接送上海生工生物工程技术服务有限公司进行序列测定,并与NCBI基因库进行序列同源性比较。
1.2.3 药敏试验 采用常规药敏纸片扩散法,挑取18~24 h的培养物制备成0.5麦氏单位的菌悬液,均匀涂布于MH琼脂培养基表面,培养18~16 h,测量抑菌环直径。药敏结果根据NCCLS标准按敏感(S)、中介(I)、耐药(R)进行判定。
2 结果与分析
2.1 ESBLs筛选试验结果
质控菌株大肠埃希氏菌ATCC25922对头孢曲松和头孢噻肟2种药物的抑菌环直径均在质控范围内。通过初步筛选试验可知,65株大肠埃希菌中有32株可判定为疑似产ESBLs菌株。
2.2 ESBLs确证试验结果
通过对32株判定为疑似产ESBLs菌株进行的表型确证试验可知,20株大肠埃希氏菌被确定为产ESBLs菌株,阳性率为30.77%(表2)。
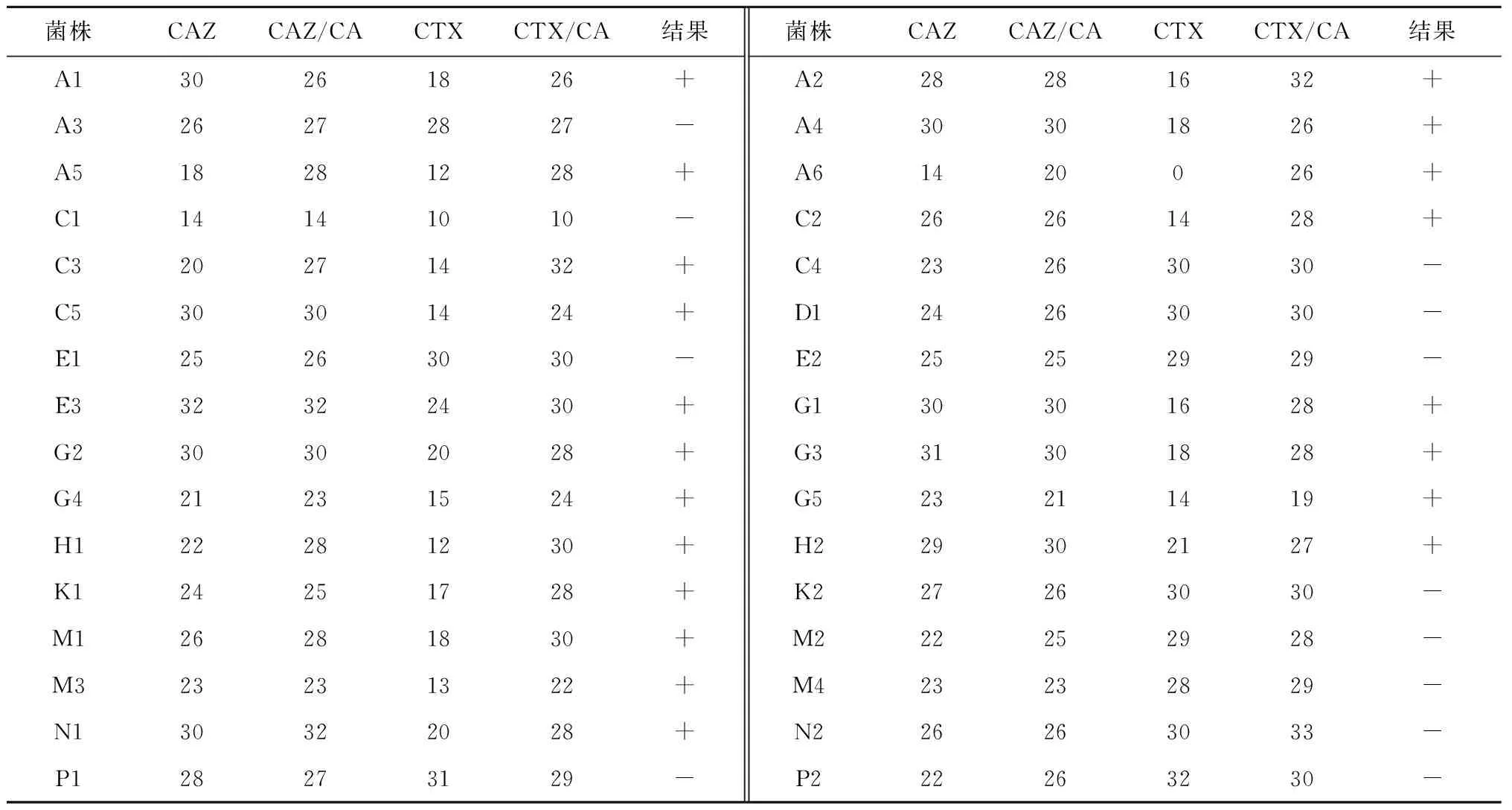
表2 32株可能产ESBLs菌株的确证试验结果 mm
注:+为阳性;-为阴性,下同。
2.3 产ESBLs与非产ESBLs菌株药敏对比结果
采用纸片扩散法,对20株产ESBLs与45株非产ESBLs大肠埃希菌进行13种抗菌药物的药敏试验(表3)。分析结果表明,产ESBLs菌株对所选13种抗菌药物的耐药率明显高于非产ESBLs菌株;且产ESBLs菌株均表现为多重耐药性,其中,65%(13/20)为9~11重耐药菌,20%(4/20)为7~8重耐药菌,15%(3/20)为4~6重耐药菌。

表3 产与非产ESBLs大肠埃希菌药敏试验比较结果
2.4 产ESBLs大肠埃希菌基因型检测结果
通过设计的4对特异性引物对确证的20株产ESBLs大肠埃希菌进行了基因型试验。试验结果表明,在20株产ESBLs大肠埃希菌中,9株为TEM型,占45%;1株为CTX-M型,占5%;8株为TEM+CTX-M型,占40%;1株为TEM+OXA型,占5%;1株为TEM+CTX-M+OXA型,占5%;未检测出携带SHV型的菌株(表4)。
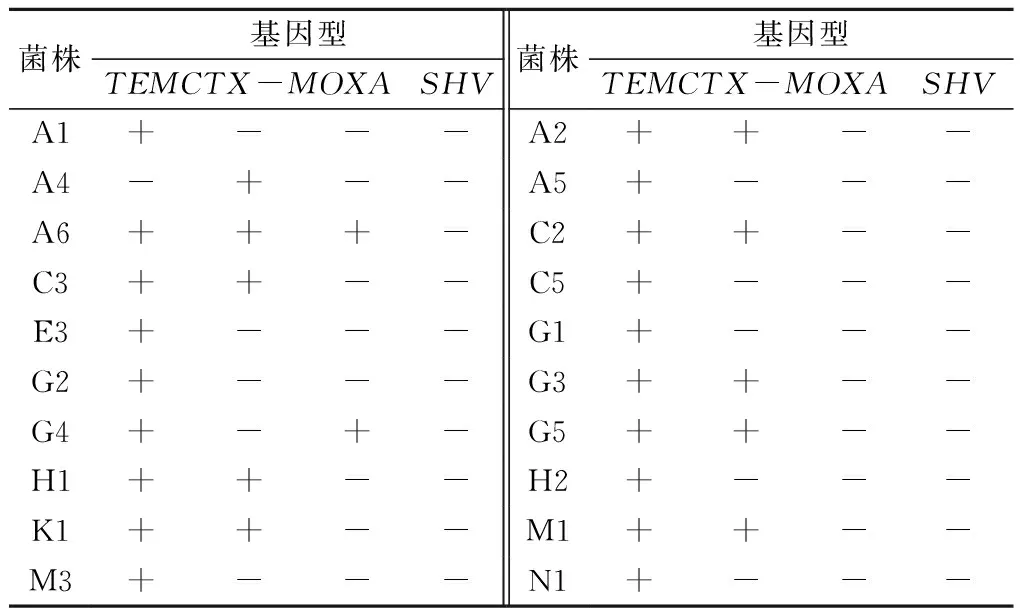
表4 20株产ESBLs菌株基因型检测结果
2.5 ESBLs阳性扩增产物的序列测定结果
2株TEM基因PCR产物测序结果显示:A6、G4样品与NCBI基因库中TEM基因的同源性均为100%。2株OXA基因PCR产物测序结果显示,A6、G4样品与NCBI基因库中OXA基因的同源性均为99%。A2、A6、C2、C3、H1样品与NCBI基因库中CTX-M基因的同源性均为99%。
3 结论与讨论
虽然各种抗生素和化学合成药物在人类与动物各种疾病的防控中发挥了重要而积极的作用,但由于近年来抗菌药物的不合理使用导致多种病原菌对各种抗菌药物的耐药性日趋严峻,尤其是多重耐药菌株的不断出现严重威胁着人类健康,也给养殖业造成巨大的经济损失[10-15]。ESBLs的产生是导致细菌产生多重耐药性的主要原因之一,目前超过200多种的ESBLs已经在各种肠杆菌科的物种和其他非肠道微生物中被发现[1],且产ESBLs细菌在世界范围内越来越普遍[16],携带ESBLs的肠杆菌科细菌已成为重要的病原菌[1]。虽然大肠埃希菌耐药基因的传播能够通过多种途径进行,但动物源食品是人类ESBLs阳性菌株的主要来源,对人类健康造成潜在危胁[17]。因此,掌握动物源大肠埃希菌ESBLs的产生、分布情况及其主要基因特点对人类健康具有重要意义。在对辽宁地区猪源大肠埃希菌ESBLs的检测中发现,ESBLs的阳性率为30.77%,除抚顺、葫芦岛外,其他8个市(区)均分离到产ESBLs的大肠埃希菌,说明辽宁地区猪源大肠埃希菌中ESBLs的检出率很高,且分布范围很广。在产与非产ESBLs菌株的耐药性比较中也发现,产ESBLs菌株的耐药率明显高于非产ESBLs菌株;且产ESBLs菌株耐药谱广,主要为9~11重耐药,占65%。由此可见,ESBLs的产生是导致猪源大肠埃希菌多重耐药出现的主要原因。
由于第3代头孢菌素的频繁使用,在1983年首次报道了能够水解广谱头孢菌素的由质粒编码的β-内酰胺酶[18],这些ESBLs大多数是TEM、SHV或CTX-M型成员[19]。最近,CTX-M型ESBLs的检出率越来越高,尤其是在产ESBLs大肠埃希菌中[20]。为明确辽宁地区猪源大肠埃希菌中ESBLs的基因型,建立了针对TEM、CTX-M、OXA和SHV基因型的PCR检测方法,并对确证产ESBLs的菌株进行了基因型鉴定。通过对TEM、CTX-M和OXA基因扩增阳性PCR产物的序列测定与分析,证明本研究所建立的PCR方法可以准确地对产ESBLs菌株进行基因型鉴定。通过用所建立的基因型检测方法对20株产ESBLs菌株进行检测发现,辽宁地区ESBLs主要为TEM基因型,其次为TEM+CTX-M型,同时辽宁地区还检出携带TEM+OXA型和TEM+CTX-M+OXA型的菌株,未检测出携带SHV型的菌株。
在过去60 a里,β-内酰胺类抗生素对细菌性感染的治疗一直是最成功的药物[21]。由于目前使用的抗生素超过一半为β-内酰胺类抗生素,β-内酰胺类耐药菌的出现使其临床效果严重受限[22]。在抗生素选择性压力不断增大的情况下,新的ESBLs不断出现[23],使得细菌病的临床治疗难以奏效。因此,有必要定期对动物群体进行耐药性及ESBLs检测,科学指导临床用药,为细菌病的防治提供理论依据。
[1] Hijazi S M,Fawzi M A,Ali F M,etal.Prevalence and characterization of extended-spectrum beta-lactamases producingEnterobacteriaceaein healthy children and associated risk factors[J].Ann Clin Microbiol Antimicrob,2016,15:3.
[2] Bush K.Alarming β-lactamase-mediated resistance in multidrug-resistantEnterobacteriaceae[J].Curr Opin Microbiol,2010,13(5):558-564.
[3] Livermore D M.Current epidemiology and growing resistance of gram-negative pathogens[J].Korean J Intern Med,2012,27(2):128-142.
[4] 刘玉华,王琳琳,方向红,等.鸡源大肠杆菌超广谱β-内酰胺酶的检测及耐药性分析[J].中国畜牧兽医,2014,41(12):271-275.
[5] 陈体,伍勇.整合子介导超广谱β-内酰胺酶的研究进展[J].实验与检验医学,2009,27(3):297-299,311.
[6] Oliver A,Perez-Diaz J C,Coque T M,etal.Nucleotide sequence and characterization of a novel cefotaxime-hydrolyzing β-lactamase(CTX-M-10) isolated in Spain[J].Antimicrob Agents Chemother,2001,45(2):616-620.
[7] Shayan S,Bokaeian M.Detection of ESBL- and AmpC-producingE.coliisolates from urinary tract infections [J].Adv Biomed Res,2015,4:220.DOI:10.1155/2015/309478.
[8] 刘雅妮,商军,郭士博.猪源分离大肠埃希菌产ESBLs的基因型及耐药性分析[J].中国兽药杂志,2011,45(9):19-22.
[9] Sharma J,Sharma M,Ray P.Detection ofTEMandSHVgenes inEscherichiacoliandKlebsiellapneumoniaeisolates in a tertiary care hospital from India[J].Indian J Med Res,2010,132:332-336.
[10] 司红彬,吴永继,黄丽云,等.黄柏与抗菌药联合抗耐药大肠杆菌的作用研究[J].河南农业科学,2015,44(2):123-126.
[11] 石玉祥,王绥华,张永英,等.规模化鸡场空气致病性大肠杆菌分离鉴定及其耐药性观察[J].河南农业科学,2014,43(2):126-128.
[12] 贾艳华,李凤娟,刘建华,等.鸡源大肠杆菌生物被膜的耐药性分析[J].华北农学报,2008,23(2):191-197.
[13] 李红丽,詹丽娥,王彩先,等.山西省猪致病性大肠杆菌血清型调查及耐药性监测[J].山西农业科学,2012,40(11):1226-1330.
[14] 王冠玉,谭艾娟,吕世明,等.贵州鸡源大肠杆菌的分离鉴定及耐药性测定[J].天津农业科学,2013,19(2):26-28.
[15] 毛福超,郁川,韩璐,等.豫西地区禽源大肠杆菌的分离鉴定与耐药性分析[J].河南农业科学,2016,45(1):127-130.
[16] Moissenet D,Salauze B,Clermont O,etal.Meningitis caused byEscherichiacoliproducing TEM-52 extended-spectrum beta-lactamase within an extensive outbreak in a neonatal ward:Epidemiological investigation and characterization of the strain[J].J Clin Microbiol,2010,48:2459-2463.
[17] Leverstein-van Hall M A,Dierikx C M,Cohen Stuart J,etal.Dutch patients,retail chicken meat and poultry share the same ESBL genes,plasmids and strains[J].Clin Microbiol Infect,2011,17:873-880.
[18] Alyamani E J,Khiyami M A,Booq R Y,etal.Molecular characterization of extended spectrum beta lactamases (ESBLs) produced by clinical isolates ofAcinetobacterbaumanniiin Saudi Arabia[J].Ann Clin Microbiol Antimicrob,2015,14:38.
[19] Bush K,Jacoby G A.Updated functional classi cation of β-lactamases[J].Antimicrob Agents Chemother,2010,54(3):969-976.
[20] Rezai M S,Salehifar E,Rafiei A,etal.Characterization of multidrug resistant extended-spectrum beta-lactamase-producingEscherichiacoliamong uropathogens of pediatrics in north of Iran[J].Biomed Res Int,2015,2015:309478.
[21] Coleman K.Diazabicyclooctanes(DBOs):A potent new class of non-β-lactam β-lactamase inhibitors[J].Curr Opin Microbiol,2011,14:550-555.
[22] Abdallah H M,Reuland E A,Wintermans B B,etal.Extended-spectrum β-lactamases and/or carbapenemases-producing enterobacteriaceae isolated from retail chicken meat in Zagazig,Egypt[J].PLoS One,2015,10(8):e0136052.
[23] Vignoli R,Varela G,Mota M I,etal.EnteropathogenicEscherichiacolistrains carrying genes encoding the PER-2 and TEM-116 extended-spectrum beta-lactamases isolated from children with diarrhea in Uruguay[J].J Clin Microbiol,2005,43(6):2940-2943.
Detection and Analysis of Drug Resistance of ESBLs in Escherichia coli Strains Isolated from Swine
ZHAO Fengju,CAO Dong,LI Jingchun,WEI Shu
(Prevention and Control Center of Liaoning Province Animal Epidemic Disease,Shenyang 110164,China)
In order to investigate extended spectrum beta-lactamase(ESBLs) production and drug resistance ofEscherichiacolistrains isolated from swines in Liaoning areas,65 strains ofE.coliisolates were tested.ESBLs was detected by K-B,and the genotypes ofTEM,CTX-M,OXAandSHVwere detected by PCR.The results indicated that 20 strains were producing ESBLs in 65 strains ofE.coli,and the positive rate was 30.77%.Nine strains wereTEMtype,one strain wasCTX-Mtype,eight strains wereTEMandCTX-Mtype,one strain wasTEMandOXAtype,one strain wasTEM,CTX-MandOXAtype.The drug resistance rate of ESBLs producing strain was higher than that of non-ESBLs strains,and all of them were multiple drug resistance strains.This study showed that the detection rate of ESBLs strains was higher,TEMtype,TEMandCTX-Mtype were predominant genotypes in Liaoning areas.
Escherichiacoli; ESBLs; genotype; drug resistance
2016-08-10
辽宁省自然科学基金项目(201402573, 2130106)
赵凤菊(1978-),女,河北廊坊人,高级兽医师,硕士,主要从事动物人畜共患病的防控与研究。 E-mail:fengjuzhao2003@163.com
S855.1
A
1004-3268(2017)02-0111-05
