O型口蹄疫病毒VP0和VP1蛋白的可溶性表达与反应原性分析
2017-03-01赵宝磊刘运超陈玉梅姬鹏超王聚财杨素珍张改平
赵宝磊,刘运超,陈玉梅,姬鹏超,王聚财,刘 畅,杨素珍,张改平,*
(1.河南农业大学 牧医工程学院,河南 郑州 450002;2.河南省农业科学院 动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002)
O型口蹄疫病毒VP0和VP1蛋白的可溶性表达与反应原性分析
赵宝磊1,刘运超2,陈玉梅2,姬鹏超2,王聚财1,刘 畅2,杨素珍2,张改平1,2*
(1.河南农业大学 牧医工程学院,河南 郑州 450002;2.河南省农业科学院 动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002)
为了高效可溶性表达O型口蹄疫病毒(FMDV)VP0、VP1结构蛋白,根据大肠杆菌密码子的偏爱性优化合成VP0和VP1基因片段,并将其克隆到pE-SUMO载体中,构建重组质粒SUMO-VP0和SUMO-VP1,将重组质粒转化到大肠杆菌BL21(DE3)感受态细胞中进行诱导表达,并优化诱导温度、时间和IPTG浓度等表达条件。结果显示, SUMO-VP0可溶性蛋白表达的最佳条件为:20 ℃条件下,0.1 mmol/L IPTG诱导表达8 h;SUMO-VP1可溶性蛋白表达的最佳条件为:37 ℃条件下,0.1 mmol/L IPTG诱导表达12 h。 SDS-PAGE电泳和Western blot结果表明,表达的SUMO-VP0、SUMO-VP1可溶性蛋白能够被抗FMDV的阳性血清识别,具有很好的反应原性。
口蹄疫病毒; VP0、VP1结构蛋白; 可溶性表达; SUMO标签
口蹄疫病(foot and mouth disease,FMD)是一种急性、热性、高度接触性传染病,由口蹄疫病毒(foot and mouth disease virus,FMDV)引起,主要感染牛、猪、羊等多种偶蹄动物[1]。血清学试验和交叉保护性试验研究发现,FMDV主要存在7个血清型:A型、C型、O型、亚洲Ⅰ型、南非Ⅰ型、南非Ⅱ型、南非Ⅲ型。这7个血清型之间没有交叉保护,且遗传变异频率非常高,流行范围非常广泛,给世界上许多国家的畜牧业生产造成了巨大的经济损失[2]。目前,免疫接种疫苗是防控该病的主要措施,接种的主要疫苗是弱毒苗和灭活苗,虽然这些疫苗具有很好的保护效果,但是制备成本高,还存在灭活不完全导致病毒暴发流行的危险。因此,对这2种疫苗的使用存在争议,迫切需要研究一种安全、高效、廉价的新型基因工程亚单位疫苗[3]。
FMDV为单股正链小RNA病毒,基因组全长有8 500个核苷酸,基因分为3个主要区域:5′UTR区、ORF区和3′UTR区。ORF区大约有7 000 nt,主要编码L蛋白、P1结构蛋白和P2、P3非结构蛋白。P1结构蛋白在后期的病毒翻译和修饰过程中被3Cpro蛋白酶裂解为3个主要的病毒结构蛋白VP0、VP1和VP3。在病毒粒子的装配过程中,VP0、VP1和VP3先形成5S聚集体再形成14S颗粒体,最后由12个14S颗粒体组装成75S病毒的空壳蛋白体。VP1高度保守区的G-H环(140—160位)包含有精氨酸-甘氨酸-天门冬氨酸序列(RGD),这些序列暴露在病毒粒子表面,构成病毒的细胞吸附位点[4]。VP0被3Cpro蛋白酶进一步裂解为VP2和VP4,VP4位于衣壳内部主要与核心RNA相连,是决定病毒抗原性的主要成分。另外,VP2和VP4经细胞激酶磷酸化后使FMDV的衣壳不稳定有利于核酸脱壳。VP2和VP1蛋白上含有多种具有免疫原性的抗原决定簇,是机体内中和性抗体结合病毒的靶标。因此,VP0和VP1结构蛋白成为亚单位疫苗研究的热点,但目前关于体外可溶性表达具有生物学活性的VP0和VP1结构蛋白的报道较少。
pE-SUMO载体是一种原核表达载体,主要用于促进重组蛋白质的正确折叠和增加蛋白质的水溶性。载体内含组氨酸标签和SUMO蛋白标签,这2种标签与目的蛋白融合表达不仅可以增加蛋白质的可溶性,还可以增加蛋白质的折叠效率[5-6]。鉴于此,采用pE-SUMO原核表达载体对FMDV VP0和VP1蛋白进行融合表达,以期获得表达量较高的可溶性重组蛋白SUMO-VP0和SUMO-VP1,为FMDV VP0和VP1蛋白的结构和功能及FMDV动物疫苗的研究奠定基础。
1 材料和方法
1.1 载体、质粒和菌株
大肠杆菌感受态细胞JM109和BL21(DE3)基因工程菌均购自TaKaRa公司。pE-SUMO原核表达载体和抗FMDV的阳性血清由河南省农业科学院动物免疫学重点实验室保存。
1.2 主要试剂
核酸Marker DL2000、ExTaqDNA聚合酶、标准分子质量蛋白质Marker和T4 DNA连接酶等为TaKaRa公司产品;胶回收试剂盒、质粒提取试剂盒等购自OMEGA公司;限制性内切酶XhoⅠ和BsaⅠ购自NEB公司;抗组氨酸标签单抗、HRP标记的羊抗鼠二抗及HRP标记的羊抗猪二抗均购自Abcam公司;IPTG购自INALCO公司;AEC显色试剂盒购自中杉公司;其他常规试剂均为国产分析纯。
1.3 引物设计与FMDVVP0和VP1基因合成
猪O型FMDV结构蛋白VP0和VP1基因序列经优化后由生工生物工程(上海)股份有限公司合成,设计引物(表1)并由生工生物工程(上海)股份有限公司合成上述基因。
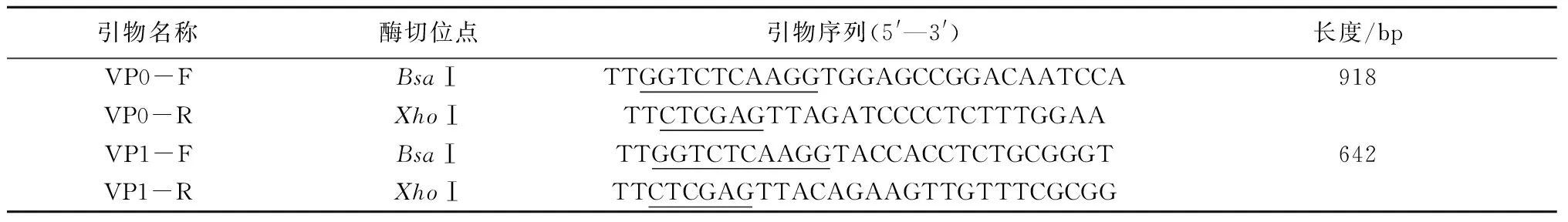
表1 VP0和VP1基因的PCR扩增引物
注:下划线位置为酶切位点。
1.4 重组质粒的构建与鉴定
以合成的O型FMDV的VP0和VP1基因为模板进行PCR扩增,PCR反应体系为25 μL:ExTaq12.5 μL,上、下游引物各1 μL,DNA模板1 μL,加灭菌水补齐25 μL。PCR反应程序如下:95 ℃预变性5 min;95 ℃变性30 s、56 ℃退火30 s、72 ℃延伸1 min,循环32次;72 ℃延伸10 min。用1%琼脂糖凝胶电泳检测扩增结果,通过胶回收试剂盒回收目的基因。用BsaⅠ和XhoⅠ对目的基因VP0、VP1和pE-SUMO载体进行双酶切并回收,随后用T4 DNA连接酶16 ℃连接过夜。采用CaCl2转化法将连接产物转入到感受态细胞JM109中,对经菌液PCR鉴定为阳性的重组质粒进行测序。将测序正确的阳性质粒命名为SUMO-VP0和SUMO-VP1,并转入感受态细胞BL21中用于重组蛋白的表达。
1.5 重组蛋白的诱导表达与Western blot鉴定
分别将SUMO-VP0和SUMO-VP1阳性重组表达菌按1∶100的比例接种到含有Amp+的LB液体培养基中,37 ℃振荡培养菌体,当菌液的OD600=0.6时加入终浓度为0.1 mmol/L的诱导剂IPTG,转至25 ℃振荡培养8 h。12 000 r/min离心15 min,弃上清,菌体沉淀用PBS缓冲液重悬后用超声波破碎仪进行破碎。破碎后的液体12 000 r/min离心20 min。分别取40 μL的沉淀和上清,加入10 μL的5×SDS-PAGE上样缓冲液煮沸10 min,煮沸后的样品用12%的SDS-PAGE检测。通过电转仪将蛋白质转移到硝酸纤维素膜(NC膜)上进行Western blot检测。转移后的NC膜置于5%脱脂奶中,4 ℃封闭过夜,用抗组氨酸标签单抗(1∶5 000)37 ℃孵育1 h,再用1∶1 000稀释的HRP标记的羊抗鼠二抗37 ℃孵育45 min,最后用AEC显色试剂盒显色并观察分析显色结果。
1.6 重组蛋白诱导表达条件的优化
分别将SUMO-VP0和SUMO-VP1的阳性菌接种于含Amp+的LB液体培养基中,37 ℃、220 r/min振荡培养,分别对诱导表达时间、诱导剂IPTG的浓度和诱导表达温度等进行优化。当OD600=0.6时,加入终浓度为0.5 mmol/L的IPTG诱导剂,在25 ℃条件下进行诱导表达,分别在诱导后的4、6、8、10、12 h收集菌液;在诱导温度25 ℃条件下,分别在0.1、0.3、0.5、0.7、0.9、1.0 mmol/L IPTG条件下诱导8 h收集菌液;在诱导剂浓度为0.5 mmol/L时,分别在16、20、25、37 ℃条件下诱导表达8 h收集菌液。分别将上述收集的菌液经12 000 r/min离心5 min,弃上清,菌体沉淀用PBS缓冲液重悬后用超声波破碎仪进行破碎。破碎后的液体12 000 r/min离心20 min,分离沉淀和上清,分别用12% SDS-PAGE进行电泳鉴定。通过对各种条件的优化,选择最佳的诱导表达条件。
1.7 Western blot检测重组蛋白的反应原性
将诱导表达得到的重组蛋白电泳后转移到NC膜上,在5%的脱脂奶中4 ℃封闭过夜。用抗O型FMDV的阳性血清以1∶200稀释后作为一抗,37 ℃孵育1 h,再用1∶2 000稀释的HRP标记的羊抗猪二抗37 ℃孵育45 min,用AEC显色试剂盒显色并观察显色结果。
2 结果与分析
2.1VP0和VP1基因的PCR扩增
分别用VP0-F/R和VP1-F/R引物扩增VP0和VP1基因,结果显示,分别在934 bp和668 bp处出现扩增条带,与预期目的条带大小一致(图1)。
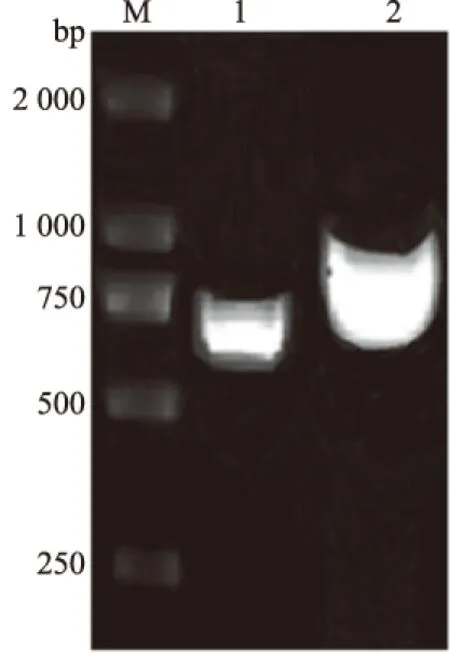
M.DL2000 DNA Marker; 1.引物VP1-F/R扩增产物; 2.引物VP0-F/R扩增产物图1 VP1和VP0基因PCR扩增产物电泳结果
2.2 SUMO-VP0和SUMO-VP1重组质粒的构建
分别对PCR扩增后的VP0、VP1基因和pE-SUMO空载体质粒用BsaⅠ和XhoⅠ进行酶切,酶切后用T4 DNA连接酶连接,并转入到大肠杆菌JM109中。pE-SUMO载体经过双酶切后,酶切位点BsaⅠ对应的核苷酸序列发生变化,所以不能用BsaⅠ和XhoⅠ对重组的质粒进行双酶切鉴定。通过菌液PCR方法对挑选的单克隆进行鉴定,电泳结果显示,分别在934 bp和668 bp处出现阳性条带(图2)。对鉴定结果为阳性的质粒进行测序,测序结果与合成的序列相一致,表明成功构建SUMO-VP0和SUMO-VP1重组质粒。
2.3 SUMO-VP0和SUMO-VP1重组蛋白的诱导表达及可溶性分析
从图3可以看出,在约53 ku和43 ku处各有1条特异性的条带,与预测的SUMO-VP0和SUMO-VP1重组蛋白的大小相一致,且目的蛋白大部分以可溶性的形式存在。Western blot结果显示,SUMO-VP0和SUMO-VP1重组蛋白可以与抗组氨酸标签单抗发生特异性结合(图3)。
2.4 SUMO-VP0和SUMO-VP1重组蛋白诱导表达条件的优化
分别对重组蛋白的诱导表达时间、诱导剂IPTG浓度和诱导表达温度等进行优化。从图4可以看出,不同表达时间对SUMO-VP0的表达量影响比较大,在诱导12 h后表达量达到最高;而对SUMO-VP1影响较小,在8 h和12 h时表达量无明显差别,故选用诱导时间为8 h。

M.DL2000 DNA Marker; 1—4均为SUMO-VP0菌液; 5—8均为SUMO-VP1菌液图2 重组质粒的菌液PCR鉴定结果
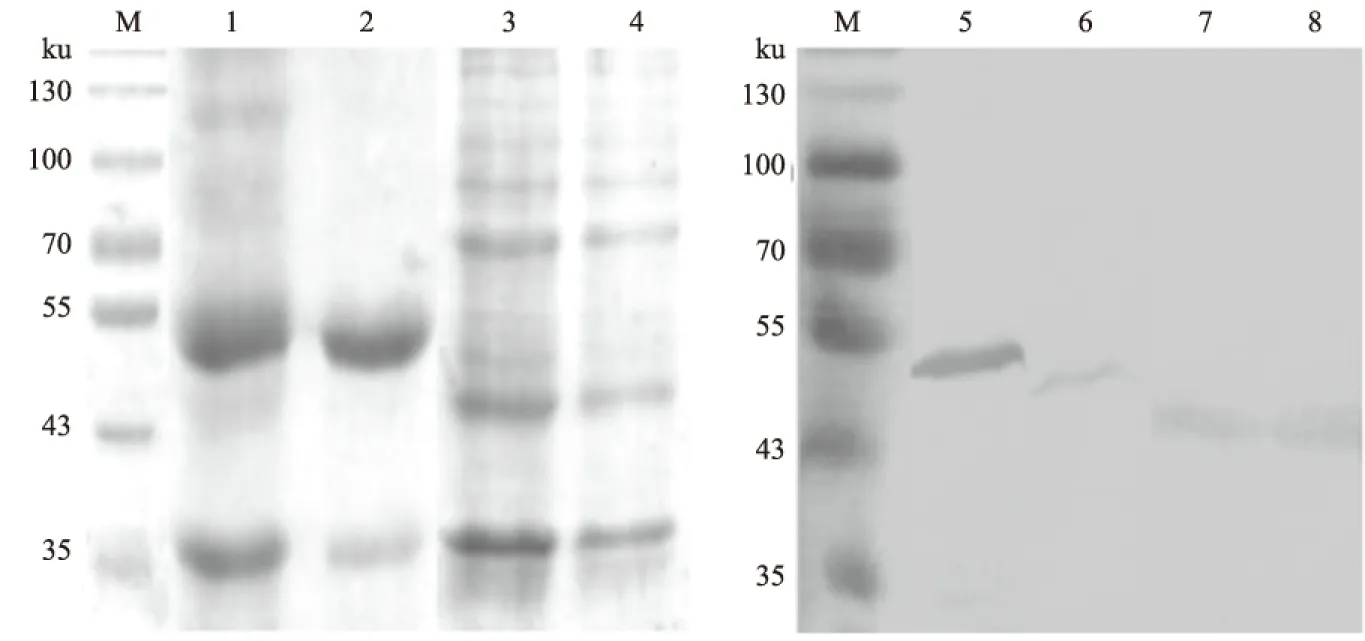
M.蛋白质Marker; 1、2和5、6分别为SUMO-VP0超声后的沉淀和上清;3、4和7、8分别为SUMO-VP1超声后的沉淀和上清图3 重组蛋白SUMO-VP0和SUMO-VP1的SDS-PAGE分析和Western blot检测结果
M.蛋白质Marker; 1—5和6—10分别是4、6、8、10、12 h诱导表达的SUMO-VP0和SUMO-VP1图4 重组蛋白SUMO-VP0和SUMO-VP1经不同时间的诱导表达情况
由图5可以看出,不同浓度IPTG对重组蛋白SUMO-VP0和SUMO-VP1的表达并没有明显影响,在0.1 mmol/LIPTG诱导条件下,2种重组蛋白的表达量已经达到最高。由图6可知,重组蛋白SUMO-VP0在25 ℃条件下,可溶性表达量达到最高;在37 ℃条件下,重组蛋白的可溶性表达量和总体表达量均达到最低。因此,重组蛋白SUMO-VP0的最佳诱导温度为25 ℃。重组蛋白SUMO-VP1在不同温度条件下表达情况与SUMO-VP0相反,随着温度的升高,重组蛋白SUMO-VP1的表达量不断增加,在37 ℃条件下,可溶性蛋白表达量达到最高,说明37 ℃适合重组蛋白SUMO-VP1的可溶性表达。因此,SUMO-VP0可溶性蛋白的最佳表达条件为:20 ℃条件下,0.1 mmol/L IPTG诱导表达12 h;SUMO-VP1可溶性蛋白的最佳表达条件为:37 ℃条件下,0.1 mmol/L IPTG诱导表达8 h。
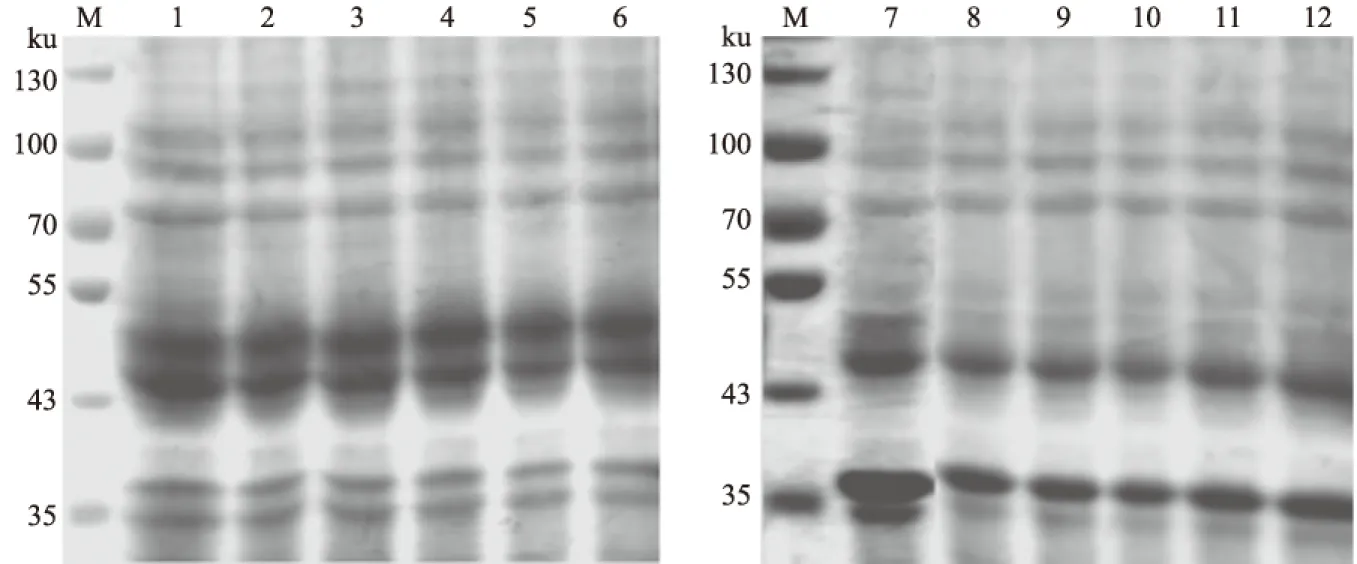
M.蛋白质Marker; 1—6和7—12分别为经0.1、0.3、0.5、0.7、0.9、1.0 mmol/L的IPTG诱导表达的SUMO-VP0和SUMO-VP1图5 重组蛋白SUMO-VP0和SUMO-VP1在不同IPTG浓度下的诱导表达情况
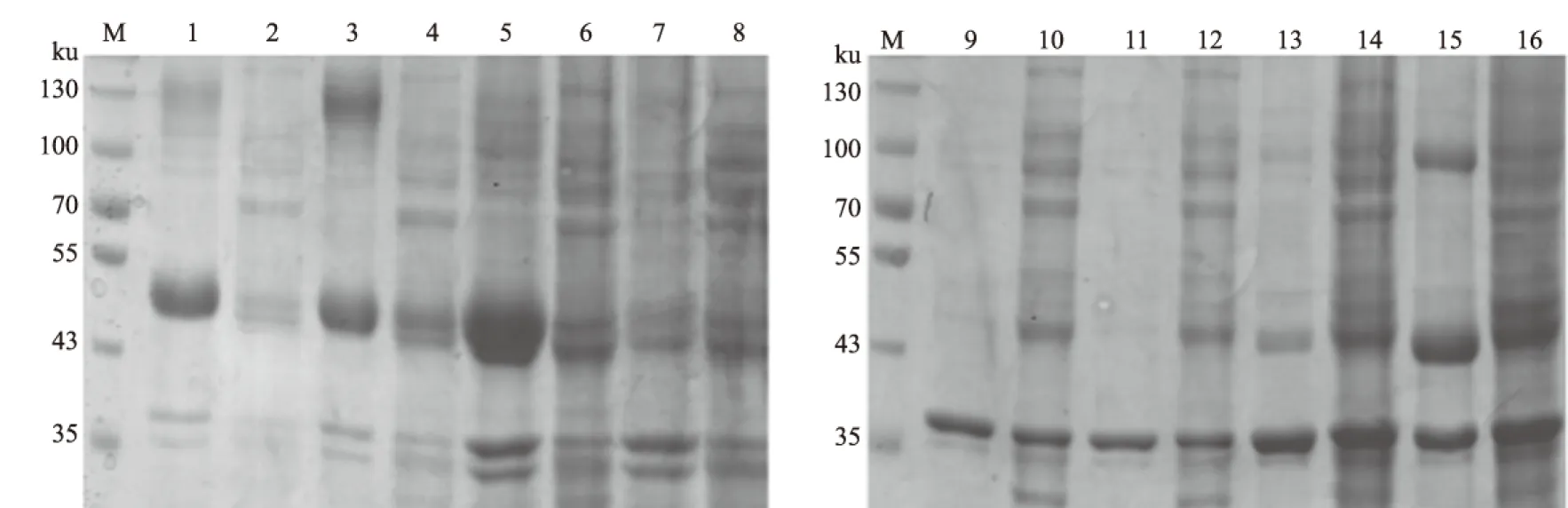
M.蛋白质Marker; 1、3、5、7和2、4、6、8分别为SUMO-VP0在16、20、25、37 ℃条件下表达超声后的沉淀和上清;9、11、13、15和10、12、14、16 分别为SUMO-VP1在16、20、25、37 ℃条件下表达超声后的沉淀和上清图6 重组蛋白SUMO-VP0和SUMO-VP1在不同温度条件下可溶性蛋白表达量检测结果
2.5 2种重组蛋白的反应原性检测结果
用抗O型FMDV的阳性血清通过Western blot检测重组蛋白SUMO-VP0和SUMO-VP1的反应原性,结果(图7)表明,分别在53 ku和43 ku位置处的特异性条带能够被抗O型FMDV的阳性血清所识别,与抗组氨酸标签单抗检测结果相一致,说明获得的重组蛋白SUMO-VP0和SUMO-VP1均具有很好的反应原性。
M.蛋白质Marker; 1和2分别为SUMO-VP0的超声沉淀和上清; 3和4分别为SUMO-VP1的超声沉淀和上清图7 重组蛋白SUMO-VP0和SUMO-VP1的反应原性分析
3 结论与讨论
SUMO是一种小分子泛素类修饰蛋白,在细胞凋亡、信号转导和蛋白质的核质运输中发挥着重要作用[7-8]。最近研究发现,SUMO可以作为分子伴侣与重组蛋白融合表达,这种融合表达不仅可以抵抗蛋白酶水解重组蛋白,还可以促进蛋白质的正确折叠,提高蛋白质的表达量,增加蛋白质的可溶性和稳定性[5-6]。SUMO标签可以通过SUMO蛋白酶酶切,切割之后不会留有残余氨基酸。姜媛媛等[9]将SUMO融合表达系统与pET-32a表达系统进行对比,结果表明,通过SUMO融合表达系统可以获得纯度较高的可溶性成熟蛋白,而目的蛋白在pET-32a表达系统中的表达量极低,几乎检测不到。曲栗等[10]利用SUMO表达系统高效表达鸡传染性法氏囊病毒的VP3基因,并且用SUMO蛋白酶酶切,得到的VP3蛋白通过Western blot鉴定具有很好的抗原性。总之,SUMO表达系统可以作为一种高效的原核表达系统以获得可溶性好、纯度高的目的蛋白。
本研究利用pE-SUMO作为表达载体,该表达载体含有6×组氨酸标签和SUMO标签,这2种标签都可以增加目的蛋白的可溶性表达。另外,6×组氨酸蛋白可与镍柱结合,因此,可以利用亲和层析技术对融合表达的重组蛋白进行纯化。据报道,组氨酸融合标签由6个带有较强正电荷的碱性氨基酸组成,在SDS-PAGE电泳中移动速度降低,会造成分子质量比实际偏大[11]。本试验通过SDS-PAGE电泳检测发现,2个重组蛋白的分子质量确实比理论值偏大,这符合预期的结果。pE-SUMO载体上含有BsaⅠ限制性内切酶酶切位点,酶切位点在SUMO标签蛋白与目的蛋白之间,可以利用SUMO蛋白酶实现N端无残留切割,从而得到纯净的目的蛋白。Western blot检测结果说明,表达得到的重组蛋白能够被抗O型FMDV的阳性血清识别,说明表达的重组蛋白具有很好的反应原性,可以用于后期的免疫试验。
目前,预防口蹄疫的主要措施是注射灭活疫苗,但灭活疫苗存在灭活不完全引起疫病暴发的危险,基因工程疫苗成为研究的热点。由于VP1蛋白主要暴露在FMDV病毒颗粒的表面,是诱导机体产生中和抗体的主要结构蛋白,因此,FMDV基因工程疫苗主要是以VP1蛋白为研究热点[12-13]。据报道称,VP1结构蛋白不能单独形成病毒样颗粒,需要将FMDV的VP0、VP1和VP3三种蛋白质共表达,在合适的条件下装配才能够形成病毒样颗粒[14]。Guo等[15]用SUMO表达系统高效表达了可溶性的VP0、VP1和VP3重组蛋白,并用SUMO蛋白酶将SUMO标签切除,在合适的条件下发现,VP0、VP1和VP3三种蛋白质能够自我组装形成病毒样颗粒,这种病毒样颗粒在形状和结构上与FMDV病毒颗粒一致。将这种病毒样颗粒与佐剂结合后免疫猪,通过病毒中和试验能够检测到中和性抗体,通过T细胞增殖试验和对γ干扰素的检测发现,病毒样颗粒能够使机体产生很好的免疫效果。本研究利用SUMO表达载体高效表达FMDV的VP0和VP1结构蛋白,并通过对多种表达条件的优化,获得了这2种结构蛋白最佳的诱导表达条件,并且用抗FMDV的阳性血清检测发现,表达的重组蛋白有很好的反应原性。本研究为FMDV病毒样颗粒的进一步研究奠定了基础,同时也为FMDV基因工程亚单位疫苗的研究提供了理论指导和技术支持。
[1] León E A.Foot-and-mouth disease in pigs:Current epidemiological situation and control methods[J].Transboundary and Emerging Diseases,2012,59(S1):36-49.
[2] Grubman M J,Baxt B.Foot-and-mouth disease[J].Clin Microbiol Rev,2004,86(22):465-493.
[3] 曹轶梅,卢曾军,田飞鹏,等.口蹄疫新型疫苗研究进展[J].微生物学通报,2009,36(11):1750-1757.
[4] Acharya R,Fry E,Stuart D,etal.The structure of foot-and-mouth disease virus:Implications for its physical and biological properties[J].Veterinary Microbiology,1990,23(1/2/3/4):21-34.
[5] Wang Z,Li N,Wang Y,etal.Ubiquitin-intein and SUMO2-intein fusion systems for enhanced protein production and purification[J].Protein Expression & Purification,2012,82(1):174-178.
[6] Panavas T,Sanders C,Butt T R.SUMO fusion technology for enhanced protein production in prokaryotic and eukaryotic expression systems[J].Methods in Molecular Biology,2009,49(7):303-317.
[7] Hay R T.Protein modification by SUMO[J].Annual Review of Biochemistry,2004,73(1):355-382.
[8] Dohmen R J.SUMO protein modification[J].Biochimica Et Biophysica Acta Molecular Cell Research,2004,1695(3):113.
[9] 姜媛媛,尹成凯,李晋南,等.利用SUMO融合系统高效表达可溶性重组蛋白的研究[J].东北农业大学学报,2008,39(10):57-62.
[10] 曲栗,尹杰超,李宁,等.利用SUMO表达系统高效可溶性表达鸡传染性法氏囊病病毒VP3基因[J].中国预防兽医学报,2011,33(3):199-202.
[11] Tang W.The cause of deviation made in determining the molecular weight of his-tag fusion proteins by SDS-PAGE[J].Acta Photophysiologica Sinica,2000,26(1):64-68.
[12] Ruppert A,Arnold N,Hobom G.OmpA-FMDV VP1 fusion proteins:Production,cell surface exposure and immune responses to the major antigenic domain of foot-and-mouth disease virus[J].Vaccine,1994,12(6):492-508.
[13] Challa S,Barrette R,Rood D,etal.Non-toxicPseudomonasaeruginosaexotoxin A expressing the FMDV VP1 G-H loop for mucosal vaccination of swine against foot and mouth disease virus[J].Vaccine,2007,25(17):3328-3337.
[14] Lee C D,Yan Y P,Liang S M,etal.Production of FMDV virus-like particles by a SUMO fusion protein approach inEscherichiacoli[J].Journal of Biomedical Science,2009,16(1):69.
[15] Guo H C,Sun S Q,Jin Y,etal.Foot-and-mouth disease virus-like particles produced by a SUMO fusion protein system inEscherichiacoli,induce potent protective immune responses in guinea pigs,swine and cattle[J].Veterinary Research,2013,44:48.
Soluble Expression and Immuneoreactivity Analysis of FMDV VP0 and VP1 Protein
ZHAO Baolei1,LIU Yunchao2,CHEN Yumei2,JI Pengchao2,WANG Jucai1,LIU Chang2,YANG Suzhen2,ZHANG Gaiping1,2*
(1.College of Animal Husbandry and Veterinary Medicine,Henan Agricultural Universitey,Zhengzhou 450002,China; 2.Key Laboratory of Animal Immunology of Ministry of Agriculture/Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
To obtain efficient soluble expressive VP0 and VP1 protein of O-type foot-and-mouth disease virus (FMDV).We optimizedVP0 andVP1 gene according to the preference codon usage ofE.Coli.The FMDV structural proteinVP0 andVP1 genes were synthesized and cloned into pE-SUMO vector.These two recombinant plasmids,SUMO-VP0 and SUMO-VP1 were transformed intoE.coliBL21(DE3) competent cells.Through optimizing the inducing temperature,time and the concentration of IPTG,we got that the optimized expression conditions of SUMO-VP1 was induced by 0.1 mmol/L IPTG,and induced at 20 ℃ for 8 h .The best inducing conditions of SUMO-VP0 was induced by 0.1 mmol/L IPTG,and expressed 12 h at 37 ℃.SDS-PAGE and Western blot analysis showed that the soluble protein could be identified by standard positive serum of FMDV,which confirmed that the fusion protein had good responsiveness.
FMDV; structural protein VP0 and VP1; soluble protein expression; SUMO tag
2016-09-06
国家重点研发计划项目(2016YFD0500704);河南省基础与前沿技术研究计划项目(152300410238);河南省科技创新基础前瞻类项目(20141644);河南省重大科技专项(141100110100)
赵宝磊(1990-),男,河南许昌人,在读硕士研究生,研究方向:动物疫病与疫苗。E-mail:baoleizhao2010@163.com
*通讯作者:张改平(1960-),男,河南内黄人,研究员,博士,主要从事动物疫病免疫机制与疫苗研究。 E-mail:zhanggaiping2003@163.com
S855.3
A
1004-3268(2017)02-0105-06
