枯草芽孢杆菌J-4菌株产抑菌物质发酵条件优化
2017-03-01翟玉洁邓祖丽颖姜军坡王世英
翟玉洁,邓祖丽颖,姜军坡,王世英*
(1.河北农业大学 生命科学学院,河北 保定 071001; 2.郑州幼儿师范高等专科学校,河南 郑州 450000)
枯草芽孢杆菌J-4菌株产抑菌物质发酵条件优化
翟玉洁1,邓祖丽颖2,姜军坡1,王世英1*
(1.河北农业大学 生命科学学院,河北 保定 071001; 2.郑州幼儿师范高等专科学校,河南 郑州 450000)
为了提高枯草芽孢杆菌J-4菌株发酵液中抑菌物质的含量,采用单因素试验和正交试验相结合的方法,对基础发酵培养基的组成(碳源、氮源、无机盐含量)和发酵条件(发酵时间、装液量、发酵温度、接种量)进行优化。优化后的培养基组成为葡萄糖1.00%、黄豆饼粉1.00%、MgSO40.15%、Na2HPO40.10%、NaH2PO40.10%;发酵条件为发酵时间36 h、装液量100 mL(250 mL)、发酵温度37 ℃、摇瓶接种量5%。在此条件下,枯草芽孢杆菌J-4菌株抑菌圈面积提高50.25%。
枯草芽孢杆菌; 抑菌物质; 优化; 正交试验
枯草芽孢杆菌具有生物夺氧、拮抗致病微生物、增强动物体免疫功能、产生多种消化酶等作用[1]。枯草芽孢杆菌J-4菌株是从健康青年鸡粪便中分离筛选出的具有体外抗大肠杆菌活性的优良菌株[2];饲料中添加0.1%的J-4菌剂,可使肉鸡的平均日增体质量提高11.99%,料重比降低11.03%[3]。研究发现,J-4菌株胞外产生的抑菌物质可以被60%饱和度硫酸铵所沉淀,并可被胃蛋白酶和胰蛋白酶所降解,故初步推测该菌株所分泌的抗菌物质为肽类物质。目前,关于枯草芽孢杆菌J-4菌株产抑菌物质的发酵条件研究较少。为此,以抑菌圈面积为指标,利用琼脂打孔扩散法[4],设计单因素试验和正交试验,研究枯草芽孢杆菌J-4菌株产抑菌物质的适宜发酵条件,以期为该菌株产抑菌物质的分离纯化和抑菌机制研究奠定基础。
1 材料和方法
1.1 菌种
枯草芽孢杆菌(Bacillussubtilis)J-4菌株筛选自健康肉鸡粪便;大肠杆菌(Escherichiacoli)由河北农业大学生命科学学院制药工程系实验室保藏。
1.2 培养基
NA培养基、NB培养基的组成及配制方法参见文献[5]。
基础发酵培养基组成:蔗糖1.00%、蛋白胨1.00%、Na2HPO40.20%、NaH2PO40.20%、MgSO40.05%、CaCl20.02%,pH值7.0~7.2。
1.3 J-4菌株种子液的制备
将活化好的J-4菌株用灭菌竹签刮取斜面菌苔接种到含有100 mL种子培养基的250 mL三角瓶中,37 ℃、180 r/min摇床培养12 h,备用。
1.4 J-4菌株产抑菌物活性测定
1.4.1 病原指示菌平板的制备 将5 mL无菌水加入活化好的大肠杆菌的斜面试管中,用灭菌竹签刮取大肠杆菌菌苔后倒入另一支灭菌试管中,在漩涡振荡器上振荡30~60 s,制成均匀的单细胞菌悬液。按照5%的接种量将菌悬液加入55 ℃的NA培养基中,摇匀,立即倒平板。
1.4.2 抑菌物质活性测定 在病原菌平板上用打孔器按一定间距均匀打孔。将发酵液5 000 r/min离心10 min,取上清液50 μL,加入到以上平板的孔中,然后水平放置37 ℃恒温箱中,24 h后观察测定抑菌圈的面积。
1.5 J-4菌株产抑菌物质培养条件的优化
采用基础发酵培养基进行培养,每组试验设3个重复,分别测量并记录抑菌圈面积。基础发酵条件:培养时间48 h、装液量50 mL(250 mL)、接种量2%、温度37 ℃、摇床转速180 r/min、pH值7.0。
1.5.1 摇瓶装液量 利用基础发酵培养基,装液量分别为25 mL(250 mL)、50 mL(250 mL)、75 mL(250 mL)、100 mL(250 mL)、125 mL(250 mL)、150 mL(250 mL),其余发酵条件同基础发酵。
1.5.2 摇瓶温度 利用基础发酵培养基和最优装液量,分别于25、28、31、34、37、40、43 ℃下进行培养,其余条件同基础发酵。
1.5.3 接种量 利用基础发酵培养基、最优装液量和最优培养温度,分别接入1%、3%、5%、7%、9%、11%的J-4菌株的种子液,其余条件同基础发酵。
1.5.4 发酵时间 利用基础发酵培养基和以上最优条件,分别发酵12、18、24、30、36、42、48、54、60 h,其余条件同基础发酵。
1.6 发酵培养基组成的优化
1.6.1 单因素试验 采用上述优化的发酵条件,每个因素进行3个重复试验,分别测量J-4菌株产抑菌物质的抑菌圈面积。
1.6.1.1 碳源种类 分别用葡萄糖、糊精、玉米粉、淀粉、乳糖、甘露醇代替基础发酵培养基中的蔗糖,加入比例均为1.00%,其余成分不变。
1.6.1.2 氮源种类 用酵母粉、黄豆饼粉、尿素、胰蛋白胨、硝酸钠、硫酸铵、牛肉膏代替基础发酵培养基中的蛋白胨,加入比例均为1.00%,碳源为依据试验确定的最适碳源,含量均为1.00%,其余成分不变。
1.6.1.3 无机盐种类 用MgSO4、CaCl2、MnSO4、FeSO4、ZnSO4、CuSO4代替基础发酵培养基中的MgSO4,加入比例均为0.10%,依据试验确定出的最适碳源和氮源,含量均为1.00%,其余成分不变。
1.6.2 正交试验 根据上述单因素试验结果,对碳源、氮源、无机盐及作为缓冲对的Na2HPO4-NaH2PO4(1∶1)进行四因素三水平正交试验,采用1.5优化后的培养条件进行发酵,以抑菌圈面积为指标,比较不同配比组合对抑菌能力的影响。正交试验设计见表1。

表1 培养基组成的正交试验设计 %
2 结果与分析
2.1 J-4菌株发酵产抑菌物质培养条件的单因素试验结果
2.1.1 摇瓶装液量 从图1可以看出,摇瓶装液量在25 mL(250 mL)~100 mL(250 mL)时,抑菌圈面积随装液量增加逐渐增大;当装液量为100 mL(250 mL)时,抑菌圈面积最大;当装液量大于100 mL(250 mL)时,抑菌圈面积随装液量增加逐渐减少。因此,确定该菌株摇瓶发酵产抑菌物质的最适装液量为100 mL(250 mL)。

图1 不同摇瓶装液量对抑菌圈面积的影响
2.1.2 摇瓶温度 从图2可以看出,当发酵温度小于37 ℃时,随着发酵温度的升高,抑菌圈面积不断增大;当发酵温度大于37 ℃时,随着发酵温度的升高,抑菌圈面积反而减小;当发酵温度为37 ℃时,抑菌圈面积达到最大,故37 ℃为最适发酵温度。
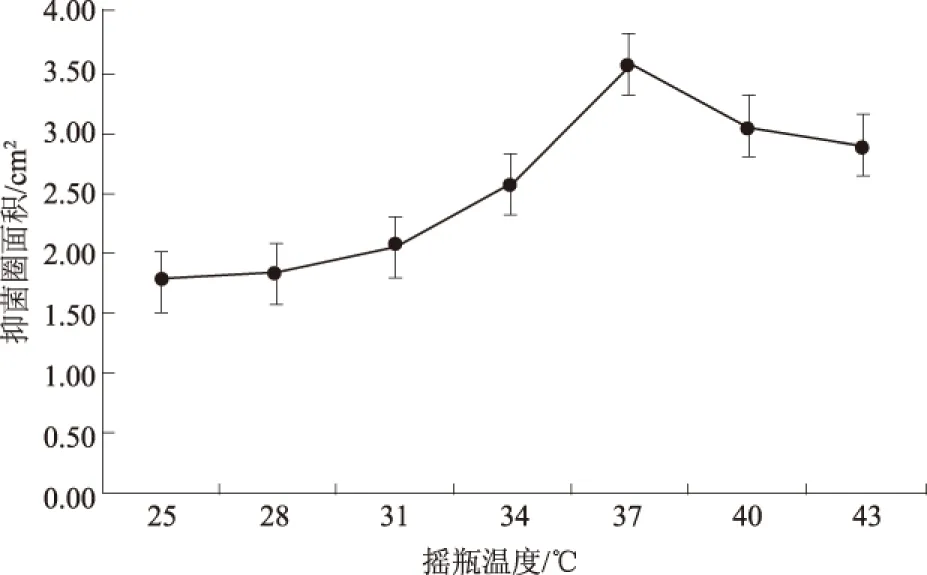
图2 不同摇瓶温度对抑菌圈面积的影响
2.1.3 接种量 从图3可以看出,接种量在1%~5%时,随接种量增加,抑菌圈面积逐渐增加;接种量在5%~12%时,随接种量增加,抑菌圈面积逐渐减小,最终趋于平稳;接种量为5%时,抑菌圈面积最大。因此,以接种量5%作为最佳接种量。

图3 不同接种量对抑菌圈面积的影响
2.1.4 发酵时间 从图4可以看出,在0~36 h,随发酵时间增加,抑菌圈面积逐渐增大,36 h对应的抑菌圈面积最大,为4.32 cm2,36 h后抑菌圈面积逐渐减小,说明36 h的发酵效果最好。故选择36 h为最佳发酵时间。

图4 不同发酵时间对抑菌圈面积的影响
2.2 发酵培养基组成的优化结果
2.2.1 单因素试验
2.2.1.1 碳源 由图5可知,供试的7种碳源中葡萄糖为碳源时所产生的抑菌圈面积最大,且价格低廉,适于发酵生产。因此,确定葡萄糖为最适碳源。

图5 不同碳源对抑菌圈面积的影响
2.2.1.2 氮源 由图6可知,以尿素为氮源时无抑菌圈,说明该菌株不能利用无机氮源,在所有供试氮源中,以黄豆饼粉的效果最好,抑菌圈面积最大。因此,选择黄豆饼粉为最适氮源。

图6 不同氮源对抑菌圈面积的影响
2.2.1.3 无机盐 由图7可知,供试的5种无机盐均可产生透明的抑菌圈,MgSO4产生的抑菌圈面积最大。因此,选择MgSO4为最适无机盐。

图7 不同无机盐对抑菌圈面积的影响
2.2.2 正交试验
2.2.2.1 正交试验结果及分析 由表2可知,4种因素对抑菌圈面积的影响大小为:C>A>B>D,即MgSO4>葡萄糖>黄豆饼粉>缓冲对。其最优组合为A3B3C3D1,即葡萄糖1.50%、黄豆饼粉1.50%、MgSO40.15%、Na2HPO4-NaH2PO40.30%。
2.2.2.2 正交试验结果验证 将正交试验的最优结果A3B3C3D1与正交表中抑菌圈面积最大组合A2B2C3D1
进行比较,结果见表3。由表3可知,正交试验最优培养基A3B3C3D1对应的平均抑菌圈面积为5.74 cm2,而A2B2C3D1组合的平均抑菌圈面积为5.95 cm2,故最佳培养基配方为A2B2C3D1,即葡萄糖1.00%、黄豆饼粉1.00%、MgSO40.15%、Na2HPO4-NaH2PO40.10%。基础发酵培养基对应的抑菌圈面积为3.96 cm2,最佳培养基对应的抑菌圈面积增加了1.99 cm2,比基础发酵培养基提高50.25%。

表2 发酵培养基组成的正交试验结果

表3 正交试验最优培养基发酵产抑菌物质能力的验证结果
3 结论与讨论
由于抑菌圈面积与胞外抑菌物质含量的对数值呈线性关系[6],所以通过培养基组成和发酵条件的优化极大地提高了J-4菌株胞外抑菌物质的产量。不同培养基营养成分和发酵条件均可影响抑菌物质的产量。宋浩等[7]发现,用优化后培养基对W10菌株进行优化培养,比优化前抑菌率提高22.3%。洪鹏等[8]在最佳发酵培养基和培养条件下,菌株HF-01的抑菌能力提高37.3%;25 ℃条件下,优化后所得发酵滤液处理柑橘果实4 d后,发病率为31.7%,病斑直径为25.9 mm,显著低于优化前对应的发病率(56.7%)、病斑直径(48.1 mm)。孙沙沙等[9]发现,优化培养条件后,CG24菌株代谢产物活性作用增强,抑菌圈直径比优化前提高了25.72%。
本试验中发现,MgSO4含量的变化会影响发酵物对应的抑菌圈面积,这可能与Mg、S元素在抑菌物质合成中起重要作用有关。其他研究人员也有类似的发现,如吴艳[10]研究表明,当发酵培养基中MgSO4含量为0.2 g/L时,芽孢杆菌菌株BCL-8对立枯丝核菌抑菌效价达833 UI;魏娇洋[11]发现,当培养基中MgSO4含量为0.5%时,内生解淀粉芽孢杆菌X-278发酵液对棉花黄萎病的抑菌圈直径为33.4 mm;王瑞霞[12]发现,当MgSO4含量为0.05%时,枯草芽孢杆菌B-903菌株产抑菌物质的量最多。
本试验利用单因素试验和正交试验对枯草芽孢杆菌J-4菌株产抑菌物质条件进行优化,最终确定发酵培养基组成为葡萄糖1.00%、黄豆饼粉1.00%、MgSO40.15%、Na2HPO4-NaH2PO40.10%;优化培养条件为发酵时间36 h、装液量100 mL(250 mL)、发酵温度37 ℃、接种量5%。培养基优化后,J-4菌株产抑菌物质对应的抑菌圈面积比基础发酵培养基对应的抑菌圈面积增大50.25%。通过培养基组成和发酵条件的优化,极大地提高了胞外抗菌物质的产量,为枯草芽孢杆菌J-4菌株的抑菌机制研究及抑菌物质的分离纯化奠定了基础。
[1] 戴晋军,罗毅,周小辉.禽用枯草芽孢杆菌对白羽肉鸡生长性能的影响[J].饲料研究,2009(8):30-32.
[2] 王选.鸡源抗腹泻芽孢益生菌J-4菌株的筛选、鉴定、发酵条件优化及动物饲喂试验[D].保定:河北农业大学,2011.
[3] 刘涛,张冬冬,姜军坡,等.枯草芽孢杆菌J-4制剂对肉鸡肠道酶活力及消化性能的影响[J].河南农业科学,2013,42(10):133-136.
[4] 顾菊根,刘莉.抗生素微生物检定中抑菌圈测量法的改进[J].现代应用药学,1997(3):32-33.
[5] 周德庆,徐德强.微生物学实验教程[M].3版.北京:高等教育出版社,2013.
[6] 国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社,2005.
[7] 宋浩,纪兆林,陈夕军,等.地衣芽孢杆菌W10菌株发酵培养基优化[J].扬州大学学报(农业与生命科学版),2015,36(1):87-91.
[8] 洪鹏,安国栋,胡美英,等.解淀粉芽孢杆菌HF-01发酵条件优化[J].中国生物防治学报,2013,11(4):569-578.
[9] 孙沙沙,夏振远,吴德喜.枯草芽孢杆菌CG24发酵条件优化[J].云南农业大学学报,2013,28(1):36-43.
[10] 吴艳.芽孢杆菌组合BCL-8发酵条件优化及抗菌蛋白的初步分离[D].石河子:石河子大学,2007.
[11] 魏娇洋.解淀粉芽孢杆菌X-278生物片剂的研制及田间试验[D].保定:河北农业大学,2014.
[12] 王瑞霞.枯草芽孢杆菌B-903菌株的发酵条件及所产抗生素的研究[D].郑州:河南农业大学,2003.
Optimization of Fermentation Conditions for Producing Antibacterial
Substance fromBacillussubtilisStrain J-4
ZHAI Yujie1,DENGZU Liying2,JIANG Junpo1,WANG Shiying1*
(1.College of Life Science,Hebei Agricultural University,Baoding 071001,China;2.Zhengzhou Infant Normal School,Zhengzhou 450000,China)
In order to improve the content of antibacterial substance in the fermentation broth ofBacillussubtilisstrain J-4,the combined method of single factor test and orthogonal test was used to optimize the factors,such as carbon source,nitrogen source,inorganic salts,fermentation time,media amount,fermentation temperature and inoculation amount.The medium composition and fermentation conditions after optimization were as follows:glucose 1%,soybean cake powder 1%,MgSO40.15%,Na2HPO40.10%,NaH2PO40.10%,fermentation time 36 h,media amount 100 mL(250 mL),fermentation temperature 37 ℃,inoculation amount 5%.The inhibition area after optimization increased by 50.25% compared with the inhibition area when using the basal fermentation medium.
Bacillussubtilis; antibacterial substance; optimization; orthogonal test
2016-08-18
石家庄市科学技术研究与发展计划项目(151500062A)
翟玉洁(1990-),女,河北保定人,在读硕士研究生,研究方向:饲用益生菌及其应用。 E-mail:zhaiyujie901118@126.com
*通讯作者:王世英(1963-),男,河北安平县人,教授,主要从事农牧微生物研究。E-mail:wsy99999@126.com
S816.7
A
1004-3268(2017)02-0131-05
