规律运动对增龄大鼠比目鱼肌细胞凋亡与自噬及PGC-1α信号调控的影响
2017-03-01刘文锋魏霞张冰侠印大中汤长发唐利花陈宗平
刘文锋魏霞张冰侠印大中汤长发唐利花陈宗平
1湖南师范大学体适能与运动康复湖南省重点实验室(湖南长沙 410012)2湖南师范大学蛋白质化学与发育生物学教育部重点实验室(湖南长沙 410081)
规律运动对增龄大鼠比目鱼肌细胞凋亡与自噬及PGC-1α信号调控的影响
刘文锋1,2魏霞1张冰侠1印大中1,2汤长发1唐利花1陈宗平1
1湖南师范大学体适能与运动康复湖南省重点实验室(湖南长沙 410012)2湖南师范大学蛋白质化学与发育生物学教育部重点实验室(湖南长沙 410081)
目的:探讨规律性运动对骨骼肌肌纤维增龄性老化过程中的细胞凋亡与细胞自噬及PGC-1α信号调控的作用机制。方法:选用SPF级健康雄性3月龄(青年,n=20)、13月龄(中年,n=24)和22月龄(老年,n=24)大鼠,按体重随机分为青年对照组(Y-SED)、青年运动组(Y-EX);中年对照组(M-SED)、中年运动组(M-EX);老年对照组(O-SED)和老年运动组(O-EX)。对照组3组静息,运动组3组实施10周规律的递增负荷中等强度有氧运动。采用HE染色检测肌纤维纵横两个面的形态学变化,免疫印迹法检测SOD表达水平、TUNEL法检测凋亡,免疫印迹法等检测自噬及PGC-1α通路的蛋白质表达水平。结果:(1)HE染色显示规律有氧运动提高了增龄性大鼠比目鱼肌肌纤维的成束性和紧密性,而免疫印迹结果显示其提高了SOD表达水平。(2)各年龄对照组大鼠比目鱼肌细胞凋亡的增加呈现增龄性趋势,而规律有氧运动各年龄大鼠凋亡指数分别增加了7.55%、20.26%(Ρ<0.05)和14.52%(Ρ<0.05)。(3)各年龄对照组大鼠自噬基因LC-Ⅲ呈现增龄性降低趋势,规律有氧运动各年龄大鼠的LC-Ⅲ均显著上升(Ρ<0.01),各年龄运动组自身LC-Ⅲ却呈现增龄性上升趋势。(4)与相对应的对照组相比较,规律有氧运动各年龄大鼠自噬因子Beclin1表达均显著上升(Ρ<0.05),其中Y-EX组上升最显著(Ρ<0.01),各年龄运动组自身Be⁃clin1的表达水平却呈现增龄性降低趋势。(5)与Y-SED组相比,M-SED组的PGC-1α表达水平增加,但OSED组比Y-SED和M-SED两组的PGC-1α表达水平显著下降(Ρ<0.01)。与安静对照组相比较,Y-EX和M-EX两组PGC-1α表达水平均呈现上升趋势,其中与O-SED组相比,O-EX组PGC-1α表达水平显著上升(Ρ<0.01,Ρ<0.05)。结论:自噬与凋亡两者之间的平衡稳定关系影响着比目鱼肌增龄性老化的发生发展,规律有氧运动对增龄性老化大鼠比目鱼肌细胞自噬与凋亡的影响出现增龄性变化,其机制是通过激发Beclin1和PGC-1α信号通路参与调控而达到调节比目鱼肌的生物学功能与改善骨骼肌老化。
规律有氧运动;细胞凋亡;细胞自噬;过氧化物酶体增殖物激活受体γ辅激活因子1α
骨骼肌的形态结构、生理功能、收缩力量及生理生化环境等都会影响到人体的运动能力,骨骼肌等组织细胞凋亡是细胞接受某种信号或受到某种因素刺激后,为了维持内环境稳定而发生的一种主动性消亡过程,涉及到人类生长、发育和衰老,更涉及到多种现代病的发病机理。同时,研究表明自噬在维持骨骼肌内环境稳态中起重要作用,自噬缺陷与多种骨骼肌疾病相关[1]。Garber[2]提出运动训练对机体代谢的良性效应可利用自噬现象来解释,使细胞自噬成为运动科学领域的研究热点。He等[3]研究发现,从骨骼肌糖代谢的角度显示,自噬是运动锻炼促进机体健康的重要生理机制,自噬缺陷还会引起骨骼肌糖、脂代谢异常,胰岛素抵抗,造成耐力运动能力下降。通过自噬使降解后的氨基酸和代谢物得以循环利用是生物体的一种自我修复过程[4]。
有研究表明,在增龄性衰老进程中,机体异常细胞器增多,大自噬途径超负荷,消耗了必要大自噬体;增龄性衰老过程中的氧化应激造成大自噬失能;以及老化引起的溶酶体内蛋白水解酶活性进行性下降都可造成老年个体自噬的失代偿[5,6]。活性氧(reactive oxy⁃ gen species,ROS)作为胞内的一种信号分子参与II型程序性细胞死亡[7]。如果过度激活自噬则可以导致细胞内大量必要分子和细胞器被分解,从而诱导细胞死亡[8]。有氧运动产生适量的ROS通过机体抗逆锻炼(hormesis or the hardness exercise)重建或加强了机体稳态的缓冲能力(allostasis buffering capacity,ABC),即为一种抗逆锻炼机制[9-11]。氧化-抗氧化的内稳态(oxidant-antioxidant homeostasis,OAH)可调控 ROS在一定水平[12]。长期规律性有氧运动本身是一种应激刺激,有氧运动这一应激因子对机体的作用非常符合抗逆锻炼的基本特征,即适量的体育运动有益于增强体质,而过度的体育运动则对机体有害。体育运动增强体质和改善骨骼肌功能的过程是否为这样的一种机制呢?本文探讨规律性运动对骨骼肌肌纤维增龄性老化过程中的细胞凋亡与细胞自噬及其信号调控的作用机制,为老年性肌力衰退的防治提供研究资料。
1 材料与方法
1.1 实验对象及分组
选取健康雄性SD(Sprague-Dawley)大鼠,3月龄20只(体重481.25± 22.17 g)、13月龄24只(体重547.75± 21.94 g)、22月龄24只(体重693.21± 68.85 g),均为SPF(Specific pathogen Free,SPF)级动物,动物许可证号:SCXK(湘)2009-0012。以国家标准啮齿类动物饲料饲养,等级为A级。实验期间室温保持20~24℃,相对湿度为45%~55%。大鼠自由饮用烧开冷却的自来水,并保持每天换饮水和适当添加饲料。实验过程中对动物的处置符合实验动物管理条例等规定。
每个年龄组大鼠按体重随机分组,分为青年对照组(young sedentary control group,Y-SED,n=10)、青年运动组(young aerobic exercise runner group,Y-EX,n=10);中年对照组(middle age sedentary control group,M-SED,n=12)、中年运动组(middle age aero⁃bic exercise runner group,M-EX,n=12);老年对照组(old age sedentary control group,O-SED,n=12)和老年运动组(old age aerobic exercise runner group,OEX,n=12)。经过10周规律有氧运动后,大鼠实际年龄分别为6月龄、16龄和25月龄。
1.2 运动训练方案
所有SD大鼠在实验动物房内适应性饲养2周后,采用杭州立泰科技有限公司研制的PT动物电动跑台进行3天5~10 min适应性训练,坡度0,速度10 m/min。中等强度规律有氧运动模型:参考本实验前期动物实验[13],以及国内张勇等研究报道[14],以中年大鼠运动负荷为依据,运动强度相当于最大摄氧量(Maxi⁃mum oxygen consumption,VO2max)60%~65%逐渐递增到70%~75%,采用PT动物电动跑台,坡度0,实验动物运动时间为期10周。青年、中年和老年大鼠的运动负荷均从每天速度以15 m/min跑台运动15 min开始,第2周15 m/min速度不变,运动时间递增5 min,第3周适当递增运动强度速度增加3 m/min并延长时间5 min,第4周18 m/min速度不变运动时间递增5 min。根据增龄性因素,第5周从速度和时间两方面考虑递增延续到第6周作为运动负荷固定的过渡运动期,前6周每周运动6天。后4周固定运动强度:青年组以25 m/min速度跑台运动45 min,中年组以22 m/min速度跑台运动40 min,老年组以20 m/min速度跑台运动35 min,每周运动5天。
1.3 实验取材与样本制备
实验方案结束后,腹腔注射10%水合氯醛溶液,按0.5 ml/100 g麻醉大鼠,使大鼠呈仰卧位于手术台上,暴露胸腔。升主动脉灌注:生理盐水(37℃)快速灌注5 min(60 ml)左右以移除血液,直到肝脏发白(防止残留的血液导致非特异性染色)。取出大鼠比目鱼肌,经过液氮速冻后置于-80℃冰箱保存,用于免疫印迹等测试。
每组至少取3只大鼠用于石蜡切片样本制作:上述升主动脉灌注完生理盐水后,用4%多聚甲醛0.1 M磷酸缓冲液(pH 7.4)(4℃)400~500 ml灌注固定。取组织继续保存在4%多聚甲醛0.1 M磷酸缓冲液中4℃冰箱过夜(不要超过24 h),第2天转移至30%蔗糖脱水,然后常规脱水、透明、进蜡、石蜡包埋。
1.4 苏木精--伊红HHEE(Haematoxylin and easin,HE)染色
常规脱蜡水化、苏木素染色、1%的盐酸酒精分色、5%的伊红染色、梯度酒精脱水、二甲苯透明、中性树胶封片和镜检。
1.5 TTUUNNEELL细胞凋亡检测程序(In situ cell death de⁃tection kit--PPOODD法)ple PCI显微图像分析软件测试每100个细胞中的平均阳性凋亡细胞数,即凋亡指数(Apoptosis Index,AI)。
1.6 超氧化物歧化酶(superoxide dismutase,SSOODD)、轻链蛋白--IIIIII(light chhaaiinn,LLCC--Ⅲ)、自噬基因Beecclliinn 11和PPGGCC-- 11 α的免疫印迹测定
使用北京康为世纪科技有限公司动物细胞(组织)总蛋白抽提试剂盒(NO.CW0891),按照1︰99比例加入蛋白酶抑制剂混合物,按组织重量1︰10(g/ml)的比例加入组织蛋白抽提试剂并作冰上F6/10-6G型超细匀浆器匀浆处理;采用Bradford法测定蛋白含量,具体详细参考说明书。
根据蛋白Marker、内参为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和目的蛋白分子量大小,尽量用一块分离胶来完成检测。采用碧云天生物技术研究所的Western blot试剂盒配分离胶和配浓缩胶。经样品制备、电泳、转膜和封闭后一抗孵育:用封闭液稀释一抗,每张PVDF膜添加
应用TdT进行的末端反应即脱氧核糖核苷酸末端转移酶介导的缺口末端标记技术(TdT-mediated dUTP nick end labeling,TUNEL)检测组织细胞在凋亡早期过程中细胞核DNA的断裂情况。按原位细胞凋亡检测试剂盒(In Situ Cell Death Detection Kit,POD)说明书操作。在普通光学显微镜下观察,阳性凋亡细胞表现为细胞核呈棕黄色或棕褐色着染,部分胞浆也可因胞核DNA碎片溢出而呈阳性着染;正常非凋亡细胞和阴性对照细胞核被苏木素复染成蓝色,核相对较大,形态大小一致。根据下列标准确定着色阳性细胞为凋亡细胞:单个散在分布;具有凋亡的核形态;周围无炎症反应。对于缺乏凋亡核形态的阳性细胞,除非染色强度与背景有鲜明对比,且呈单个分布,否则不认为是凋亡细胞。光学显微镜(×400)下每张切片随机观察6个视野,每个视野至少500个细胞水平。以Sim⁃2 ml Abcam公司的SOD(~25 kDa,NO.ab13533,1︰2000)和PGC-1α(~105 kDa,NO.ab54481,1︰2000)一抗;美国Proteintech Group公司的LC-Ⅲ(~16 kDa,NO.12135-1-AP,1︰2000)和Beclin1(~60 kDa,NO.11306-1-AP,1︰2000);内参GAPDH一抗(~36 kDa,NO.10494-1-AP,1︰10000,购自美国 Proteintech Group公司)。二抗孵育:每张PVDF膜添加3 ml的Goat anti-Rabbit IgG(H&L)-HRP和Goat anti-Rat IgG(H&L)-HRP二抗(1︰50000,NO.10285-1-AP,美国Proteintech Group公司),室温振摇2 h。化学发光与扫描:Western实验中,HRP标记在二抗上,与一抗-靶蛋白复合物结合,再用SuperSignal底物进行发光检测(Thermo公司提供,NO.32209),用天能5500化学发光凝胶成像系统扫描拍照。图象分析:采用美国国立卫生研究院(National Institutes of Health,NIH)开发的Image J对Western blot条带进行灰度分析。
1.7 统计学分析
所有数据均用SPSS16.0统计学软件处理。所有数据用平均值±标准差表示;两组内比较采用t检验,显著性水平为α=0.05,即Ρ<0.05为具有显著性差异,Ρ<0.01为具有非常显著性差异。
2 结果
2.1 增龄大鼠比目鱼肌HHEE染色与细胞凋亡结果
2.1.1 HHEE染色
从图1可以看出,从比目鱼肌纵切面图像来看,YSED和Y-EX两组的肌纤维间隙和排列整齐相当;MSED排列基本整齐,肌纤维间隙较大,而M-EX肌纤维间隙比较匀称,但略显疏松,细胞核的分布明显增多;O-SED组大鼠肌纤维的间隔大于O-EX组,O-EX的细胞核数量明显增多。从比目鱼肌横切面来看,Y-SED和Y-EX两组的肌纤维排列成束分布,Y-EX组成束排列紧密;M-SED组肌纤维排列比较凌乱,成束不明显,而M-EX组肌纤维成束比M-SED组规则;O-EX组大鼠肌纤维成束明显比O-SED组好,排列整齐规则。这表明规律有氧运动提高了增龄性大鼠比目鱼肌肌纤维的成束和紧密程度。

图1 各组大鼠比目鱼肌HE染色显微图像
2.1.2 TTUUNNEELL结果
从图2来看,骨骼肌肌纤维形态与HE染色呈现的一致,增龄对照与运动组的各组大鼠比目鱼肌均出现阳性棕褐色或者棕黄色的细胞凋亡核,而正常细胞核被苏木素染成蓝色。
表1显示各组大鼠比目鱼肌凋亡发生率为100%。与Y-SED相比较,M-SED细胞凋亡指数增加了10.56%(Ρ<0.05),而O-SED细胞凋亡指数增加了25.92%(Ρ<0.01);与M-SED相比较,O-SED增加了13.89%(Ρ<0.05)。实施规律有氧运动后,各年龄运动组大鼠比目鱼肌细胞凋亡指数显著增加,分别增加了7.55%(Ρ>0.05)、20.26%(Ρ<0.05)和14.52%(Ρ<0.05)。
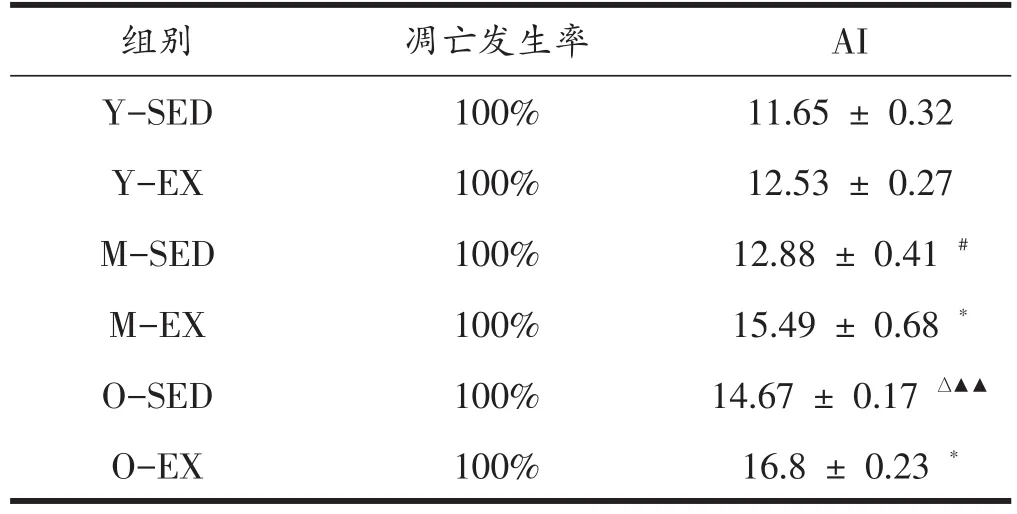
表1 各组大鼠比目鱼肌细胞凋亡发生率和凋亡指数比较

图2 各组大鼠比目鱼肌细胞凋亡TUNEL染色显微图像
2.2 各组大鼠比目鱼肌SSOODD表达水平检测结果
图3显示,与Y-SED组相比,M-SED组的SOD/GAPDH值显著上升8%(Ρ<0.05),而O-SED组的SOD/GAPDH值却显著低于Y-SED组(Ρ<0.01)和MSED组(Ρ<0.05)。实施规律有氧运动的M-EX组比M-SED组上升17.85%、O-EX组比O-SED组的SOD/GAPDH值显著上升9%(Ρ<0.05),但Y-EX组SOD/GAPDH比Y-SED组上升4%(Ρ>0.05)。
2.3 各组大鼠比目鱼肌细胞自噬因子Beecclliinn 11和LLCC--Ⅲ的检测结果
图4显示,与Y-SED组相比,M-SED组的LC-Ⅲ/GAPDH值下降10%,O-SED组的LC-III/GAPDH值也下降46%,呈现增龄性降低趋势,但均无统计学意义(Ρ>0.05)。与安静对照组相比较,实施规律有氧运动的各组LC-Ⅲ/GAPDH值均显著上升,分别Y-EX上升70%、M-EX上升1.43倍、O-EX上升1.93倍(Ρ<0.01),运动各组的LC-Ⅲ/GAPDH值呈现增龄性上升趋势。

图3 各组大鼠比目鱼肌免疫印迹SOD/GAPDH结果比较
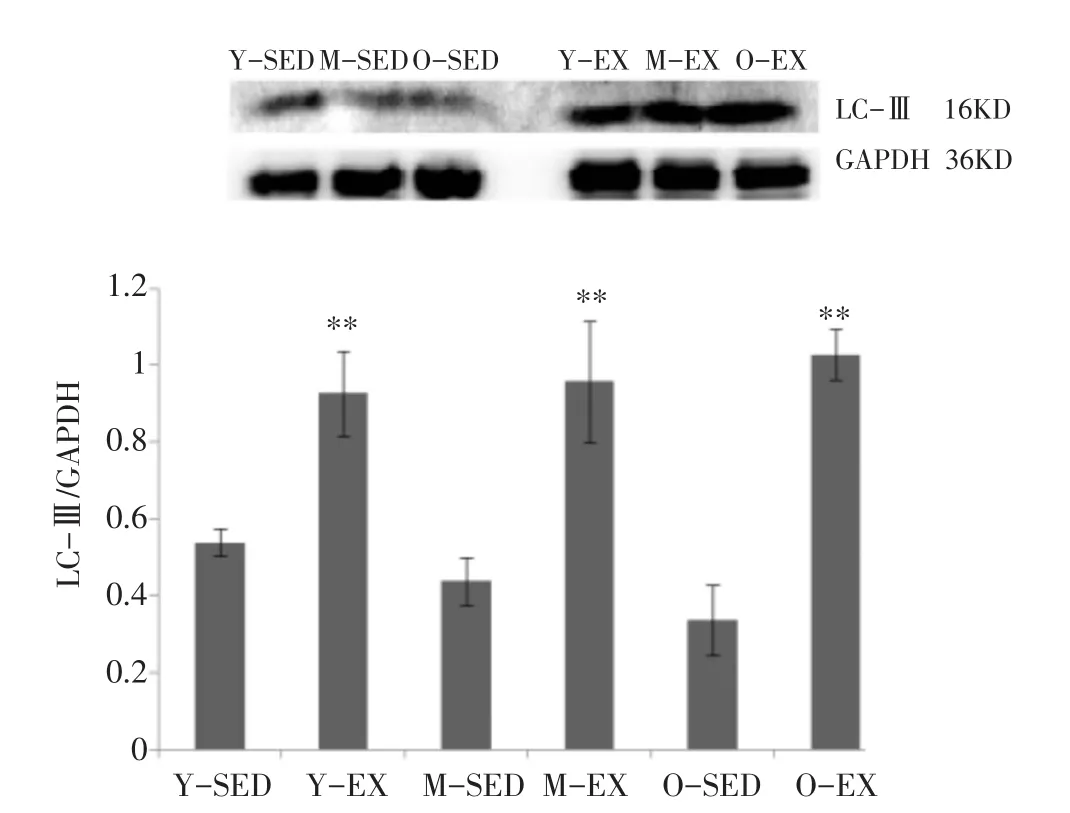
图4 各组大鼠比目鱼肌免疫印迹LC-Ⅲ/GAPDH结果比较
图5显示,与Y-SED组相比,M-SED组的Beclin1/GAPDH值显著上升3.37倍(Ρ<0.01),O-SED组的Be⁃clin1/GAPDH值也显著上升1.05倍(Ρ<0.01),却OSED组比M-SED组显著下降37.5%(Ρ<0.05)。实施规律有氧运动的各组均显著上升,其中Y-EX组比YSED组Beclin1/GAPDH值显著上升2.75倍(Ρ<0.01),而M-EX组比M-SED组上升19.04%、O-EX组比OSED组的Beclin1/GAPDH值显著上升35.29%(Ρ<0.05),运动各组的Beclin1/GAPDH值呈现增龄性降低趋势。

图5 各组大鼠比目鱼肌免疫印迹Beclin1/GAPDH结果比较
2.4 各组大鼠比目鱼肌PPGGCC-- 11 α信号转导结果
图6显示,与Y-SED组相比,M-SED组PGC-1α/GAPDH值显著上升20%(Ρ<0.05),但O-SED组比YSED组和M-SED组的PGC-1α/GAPDH值分别显著下降316%、500%(Ρ<0.01)。与安静对照组相比较,实施规律有氧运动的各组PGC-1α/GAPDH值均呈现上升趋势,M-EX组与M-SED组相比PGC-1α/GAPDH值显著上升9%(Ρ<0.05),而O-EX组与O-SED组相比PGC-1α/GAPDH值显著上升3.79倍(Ρ<0.01)。

图6 各组大鼠比目鱼肌免疫印迹PGC-1α/GAPDH结果比较
3 讨论
本实验结果显示各年龄安静组大鼠比目鱼肌细胞凋亡的增加呈现增龄性趋势,而实施规律有氧运动后,各年龄运动组大鼠比目鱼肌细胞凋亡指数显著增加,分别增加了7.55%、20.26%和14.52%。课题组汤长发等[15]前期研究发现,骨骼肌细胞的凋亡不但与运动强度有关,而且与肌纤维类型相关;细胞内线粒体钙离子浓度变化是运动诱发骨骼肌细胞凋亡的可能途径。Boffi等[16]对纯种马进行了3个月的跑台训练,在肌肉活检中发现,运动训练组的肌细胞凋亡显著性高于控制组(P<0.001),并推测正是这一新生的更具生命力的细胞不断代替凋亡的异常肌细胞的过程,是训练导致体能增长的机制。老化的调节因子可通过调控自噬基因来延缓老化和延长寿命,自噬很可能是动物老化调控机制的关键因素[17,18]。本实验结果显示,LC-III呈现增龄性降低趋势,而与安静对照组相比较,实施规律有氧运动的各组LC-III均显著上升(Ρ<0.01),运动各组的LC-III/GAPDH值亦呈现增龄性上升趋势。适宜运动诱导的细胞自噬可以清除细胞内受损的物质及细胞器,避免受损线粒体促凋亡因子蛋白的释放,从而抑制细胞凋亡;细胞自噬可以为细胞提供能源物质,促进机体运动能力的提高,有利于减少细胞凋亡而使其存活,从而使肌纤维数量得以维持,防止骨骼肌质量因肌纤维数目减少而下降,对Sarcopenia的防治具有重要意义[19]。Lira等[20]进一步研究了自噬与运动适应的关系,指出运动诱导的骨骼肌适应和运动表现的提高需要自噬,基础状态下在氧化能力强的慢肌纤维自噬水平明显比混合型肌纤维和快肌纤维高。
本实验结果显示,实施规律有氧运动的M-EX组比M-SED组、O-EX组比O-SED组的SOD/GAPDH值显著上升。骨骼肌是体内主要的氧化应激组织,在骨骼肌尤其是慢肌纤维内线粒体含量丰富,而线粒体是主要的ROS来源。细胞通过自身抗氧化系统,如SOD、过氧化氢酶及时清除ROS,可保护线粒体不受损伤,SOD2基因(Mn-SOD)高表达或化学ROS清除剂能够降低自噬水平[21]。本实验结果显示,大鼠比目鱼肌MSED组Beclin1表达水平最显著,实施规律有氧运动的各组Beclin1表达均显著上升,运动各组Beclin1的表达水平呈现增龄性降低趋势。Pattingre等[22,23]研究表明,Beclinl可通过与B淋巴细胞瘤-2基因(B-cell lympho⁃ma-2,Bcl-2)、紫外线辐射耐受相关基因(UV radia⁃tion resistance associated,UVRAG)、mVps34基因(The mammalian homologue of yeast vacuolar protein sort⁃ing defective 34)等因子组成复合物,在自噬诱导阶段发挥关键作用;当细胞能量缺乏或受到氧化应激信号刺激时,Beclin l能通过减少与Bcl-2的相互作用,提高自噬水平。Furuya等[24]研究发现Beclin1可通过增强半胱氨酸天冬氨酸蛋白酶-9(caspase-9)的活性加强化疗药物CDDP诱导的人胃癌细胞MKN28发生凋亡,说明Beclin1作为自噬重要调控基因也参与了细胞凋亡的调控。但自噬活性过强则会过多降解胞浆中的蛋白质与细胞器,从而导致II型程序性细胞死亡,甚至可能导致一系列疾病的产生。钱帅伟等[25]通过建立急性递增负荷运动的时相性模型,检测骨骼肌细胞自噬启动阶段关键基因Beclin1、膜螯合关键基因自噬相关基因-9(autophagy related gene 9,ATG9)、自噬泡延伸阶段关键基因ATG7和LC-III表达的动态变化,探讨自噬发生不同阶段的关键基因在运动中的适应性情况。
本实验结果显示,与Y-SED组相比,M-SED组的PGC-1α表达水平显著上升,但O-SED组比Y-SED和M-SED组的PGC-1α表达水平显著下降(Ρ<0.01)。与安静对照组相比较,实施规律有氧运动的各组PGC-1α表达水平均呈现上升趋势。研究发现,过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activat⁃ed receptorγ,PPARγ)是能量代谢过程中的关键转录因子,其辅激活因子1(peroxisome proliferator activated receptor γ coactivator-1,PGC-1)可能在运动诱导骨骼肌的适应机制中起着重要作用,其已成为探索运动耐力提升的新的分子靶点[26]。Brault等[27]研究证明,PGC-1α的过表达能够增加线粒体含量并且抑制肌萎缩;运动能够增加线粒体的合成,提高线粒体功能,并且其产生的许多有益效应是通过PGC-1α来发挥作用的。漆正堂等[28]报道除ROS、一氧化氮(nitric oxide,NO)之外,线粒体还通过线粒体膜渗透性转换孔(mitochondri⁃al permeability transition pore,mPTP)释放细胞色素C启动细胞凋亡程序,通过H+/Ca2+交换调节胞浆内钙信号通路,通过蛋白输入机制易位p53、PGC-1α、维生素D受体、Bax/Bad、信号转导和转录活化蛋白-5(signal transduction and activator of transcription 5,Stat5)等信号蛋白激活或抑制细胞的某些生理过程。
4 小结
自噬与凋亡两者之间的平衡稳定关系影响着比目鱼肌增龄性老化的发生发展,规律有氧运动对增龄性老化大鼠比目鱼肌细胞自噬与凋亡的影响出现增龄性变化,其机制是通过激发Beclin1和PGC-1α信号通路参与调控而达到调节比目鱼肌的生物学功能与改善骨骼肌老化。
[1]Holton JL,Beesley C,Jackson M,et al.Autophagic vacuo⁃lar myopathy in twin girls[J].Neuropathol Appl Neurobi⁃ol,2006,32(3):253-259.
[2]Garber K.Autophagy.Explaining exercise[J].Science,2012,335(6066):281.
[3]HeC,BassikMC,MoresiV,etal.Exercise-induced BCL2-regulated autophagy is required for muscle glu⁃cose homeostasis[J].Nature,2012,481(7382):511-515.
[4]Eskelinen EL,Saftig P.Autophagy:a lysosomal degrada⁃tion pathway with a central role in health and disease [J].Biochim Biophys Acta,2009,1793(4):664-673.
[5]Martinez-Vicente M,Sovak G,Cuervo AM.Protein degra⁃dation and aging[J].Exp Gerontol,2005,40(8-9):622-633.
[6]Norris EH,Giasson BI.Role of oxidative damage in pro⁃tein aggregation associated with parkinson's disease and related disorders[J].Antioxid Redox Sign,2005,7(5-6):672-684.
[7]Kiselyov K,Jennigs JJ,Rbaibi Y,et al.Autophagy,mito⁃chondria and celldeath in lysosomalstorage diseases [J].Autophagy,2007,3(3):259-262.
[8]贺强,丁树哲.骨骼肌细胞自噬与运动适应[J].中国运动医学杂志,2014,33(3):247-257.
[9]Navarro A,Gomez C,Lopez-Cepero JM,et al.Beneficial effects of moderate exercise on mice aging:Survival,be⁃havior,oxidative stress,and mitochondrial electron transfer [J].Am J Physiol Regul Integr Comp Physiol,2004,286(3):R505-511.
[10]Li G,He H.Hormesis,allostatic buffering capacity and physiological mechanism of physical activity:A new theo⁃retic framework[J].Med Hypotheses,2009,72(5):527-532.
[11]Radak Z,Chung HY,Goto S.Exercise and hormesis:Oxi⁃dative stress-related adaptation for successful aging[J].Biogerontology,2005,6(1):71-75.
[12]Jackson MJ,Jones DA,Edwards RH.Vitamin e and skele⁃tal muscle[J].Ciba Found Symp,1983,101:224-239.
[13]Hu X,Duan Z,Hu H,et al.Proteomic profile of carbonyl⁃ated proteins in rat liver:Exercise attenuated oxidative stress may be involved in fatty liver improvement[J].Pro⁃teomics,2013,13(10-11):1755-1764.
[14]韩雨梅,刘子泉,常永霞,等.有氧耐力训练对增龄大鼠骨骼肌线粒体生物合成的影响[J].中国运动医学杂志,2010,29(4):425-429.
[15]李江华,汤长发,邓树勋.运动诱导的大鼠腓肠肌细胞凋亡与肌纤维类型百分构成关系的研究[J].中国运动医学杂志,2008,27(3):344-348.
[16]Boffi FM,Cittar J,Balskus G,et al.Training-induced apoptosis in skeletal muscle[J].Equine Vet J,2002,34:275-278.
[17]Rubinsztein DC,Marino G,Kroemer G.Autophagy and ag⁃ing[J].Cell,2011,146(5):682-695.
[18]Vellai T,Bicsak B,Toth ML,et al.Regulation of cell growth by autophagy[J].Autophagy,2008,4(4):507-509.
[19]邱守涛,崔迪,卢健,等.AMPK/Sirt1信号通路在运动调控骨骼肌质量中的作用.天津体育学院学报,2014,29(3):255-258.
[20]Lira VA,Okutsu M,Zhang M,et al.Autophagy is re⁃quired for exercise training-induced skeletal muscle ad⁃aptation and improvement of physical performance.FASEB J,2013,27(10):4184-4193.
[21]Chen Y,Mcmillan-Ward E,Kong J,et al.Mitochondrial electron-transport-chain inhibitors of complexes I and II induce autophagic cell death mediated by reactive oxy⁃gen species[J].J Cell Sci,2007,120(Pt 23):4155-4166.
[22]Pattingre S,Tassa A,Qu X,et al.Bcl-2 antiapoptotic pro⁃teins inhibit beclin 1-dependent autophagy[J].Cell,2005,122(6):927-939.
[23]Qu X,Yu J,Bhagat G,et al.Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene [J].J Clin Invest,2003,112(12):1809-1820.
[24]Furuya D,Tsuji N,Yagihashi A,et al.Beclin 1 augment⁃ed cis-diamminedichloroplatinum induced apoptosisvia enhancing caspase-9 activity[J].Exp Cell Res,2005,307(1):26-40.
[25]钱帅伟,漆正堂,丁树哲.急性递增负荷运动对骨骼肌自噬系统相关基因表达的影响[J].武汉体育学院学报,2014,48(3):76-81.
[26]Benton CR,Wright DC,Bonen A.Pgc-1alpha-mediated regulation ofgene expression and metabolism:Implica⁃tions for nutrition and exercise prescriptions[J].Appl Physio Nutr Metab,2008,33(5):843-862.
[27]Brault J,Jespersen J,Goldberg A.Peroxisome proliferatoractivated receptor γ coactivator 1α or 1β over expression inhibits muscle protein degradation,induction of ubiquitin ligases,and disuse atrophy[J].J Biol Chem,2010,285:19460-19471.
[28]漆正堂,丁树哲.运动适应的细胞信号调控:线粒体的角色转换及其研究展望[J].体育科学,2013,33(7):65-69.
The Effects of Regular Aerobic Exercise on Soleus Apoptosis and Autophagy as well as PGC-1α Signal Regulation of Aging Rats
Liu Wenfeng1,2,Wei Xia1,Zhang Bingxia2,Yin Dazhong1,2,Tang Changfa1,Tang Lihua1,Chen Zongping1
1 Hunan Provincial Key Laboratory of Physical Fitness and Sports Rehabilitation,Hunan Normal University, Changsha 410012,China
2 The Key Laboratory of Protein Chemistry and Developmental Biology of Ministry of Education,Hunan Normal University,Changsha 410081,China
Tang Changfa,Email:tangchangfa@sina.com
ObjectiveTo explore the effect of regular aerobic exercises on soleus apoptosis and au⁃tophagy as well as PGC-1 alpha(PGC-1α)signal regulation in aging rats.MethodsIn this study,3-month-old,13-month-old and 22-month-old specific pathogen free(SPF)male Sprague-Dawley(SD) rats were randomly divided into a young(Y-SED),a middle-aged(M-SED)and an old-aged(O-SED) sedentary control group,and the corresponding young,middle-aged and old-aged aerobic exercise(YEX,M-EX and O-EX)groups.The 10-week regular moderate-intensity aerobic exercise intervention with progressive intensity was carried out in the EX groups,while the control groups were not given any intervention.Haematoxylin and easin(HE)staining was used to observe the morphological changes of muscular fibers horizontally and vertically.Western blotting was performed to decide the expression of superoxide dismutase(SOD),screen and verify the related signal pathways for the autophagy and apoptosis.TUNEL assay was used to measure apoptosis.ResultsThe regular aerobic exercise significant⁃ly improved the bundling and density of soleus muscle fibers,as well as the SOD expression.In con⁃trol groups apoptosis increased as the age increased,while that of Y-EX,M-EX and O-EX groups in⁃creased by 7.55%and 20.26%(Ρ<0.05)and 14.52%(Ρ<0.05)respectively.The LC-Ⅲ autophagy gene reduced with age in each sedentary group,but increased significantly(Ρ<0.01)in regular aerobic exercise rats with age.Compared with the corresponding control groups,the expression of autophagy fac⁃tor Beclin1 increased significantly in EX groups(Ρ<0.05),with most significant increase in Y-EX group.Compared with Y-SED group,the average expression of PGC-1 alpha in M-SED group in⁃creased,but that of O-SED group decreased significantly(Ρ<0.01)compared to Y-SED and M-SED groups.Compared with the sedentary control groups,the average PGC-1 alpha expression in the group Y-EX and M-EX increased;but compared with O-SED group,that of O-EX group improved significant⁃ly(Ρ<0.01).Conclusions The balance and stability between cell autophagy and apoptosis may influ⁃ence the development of aging in soleus.Cell autophagy and apoptosis in the soleus were changed in regular aerobic exercise rats with age,which may be involved in stimulating the expression of PGC-1 alpha signaling pathways to regulate and adjust the biological function and skeletal muscle ageing of so⁃leus.
regular aerobic exercise,apoptosis,cell autophagy,PGC-1
2016.01.31
国家自然科学基金(31271257);国家高科技 863计划(2008AA02Z411);湖南省自然科学基金(11JJ6082和14JJ7035);湖南教育厅优秀青年基金(12B088);湖南师范大学青年优秀人才培养计划(ET1507)共同资助
汤长发,Email:tangchangfa@sina.com
