苦参碱通过调节单核吞噬细胞表型偏移改善博莱霉素诱导的肺纤维化*
2017-02-28苏程程彭守春魏路清姬文婕
李 鑫, 李 琦,3▲, 李 祎, 苏程程, 周 欣, 彭守春, 魏路清△, 姬文婕△
(中国人民武装警察部队后勤学院 1附属医院呼吸与重症医学科, 2附属医院心脏医院, 3锦州医科大学武警后勤学院附属医院研究生培养基地,天津 300162)
苦参碱通过调节单核吞噬细胞表型偏移改善博莱霉素诱导的肺纤维化*
李 鑫1, 李 琦1,3▲, 李 祎1, 苏程程1, 周 欣2, 彭守春1, 魏路清1△, 姬文婕1△
(中国人民武装警察部队后勤学院1附属医院呼吸与重症医学科,2附属医院心脏医院,3锦州医科大学武警后勤学院附属医院研究生培养基地,天津 300162)
目的: 研究苦参碱(matrine,MA)对博莱霉素(bleomycin,BLM)诱导的循环单核细胞和肺泡巨噬细胞表型偏移的调节作用。方法: 160只C57BL/6雄性小鼠随机分为生理盐水(NS)组、BLM组、苦参碱干预组(BLM+MA组)及溶剂对照组(BLM+NS组),经口咽吸入法给予BLM (2.5 mg/kg)建立实验性肺纤维化模型,对照组给予等体积NS,BLM+MA组和BLM+NS组分别在术后每天灌胃给予MA(15 mg·kg-1·d-1)或等量NS。术后第3、7、14和21天处死小鼠,采用HE染色和Masson染色观察肺组织病理学变化及纤维化程度,采用碱水解法测定肺组织羟脯氨酸的含量,用流式细胞术分别检测循环单核细胞亚群和支气管肺泡灌洗液细胞表型的变化。结果: 与对照组相比,MA干预可以明显减轻BLM诱导的小鼠肺组织炎症反应及纤维化程度(P<0.05);与NS组相比,BLM组的Ly6Chi单核细胞比例升高,肺泡巨噬细胞表型由M1型向M2型偏移,且与炎症反应和纤维化程度呈现一定的相关性;MA干预后可以部分逆转BLM诱导的循环单核细胞和肺泡巨噬细胞的表型偏移。结论: 苦参碱可以减轻BLM诱导的急性肺泡炎症和肺纤维化程度,可能是部分通过逆转循环单核细胞和肺泡巨噬细胞表型的偏移而实现的。
苦参碱; 肺纤维化; 单核细胞; 巨噬细胞; 博莱霉素
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种由各种病因引起的累及肺间质、肺泡或细支气管的肺部弥漫性疾病,有病程发展不可逆、预后极差、临床治疗手段有限等特点[1]。单核吞噬细胞系统(mononuclear phagocyte system,MPS)由骨髓中的单核细胞前体细胞、血液循环中的单核细胞以及组织中由单核细胞分化而来的巨噬细胞和树突状细胞组成,是吞噬细胞最主要的组成部分,在机体自身免疫及抵御疾病等方面发挥重要作用[2]。本课题小组前期研究结果表明单核/巨噬细胞表型的偏移与博莱霉素(bleomycin,BLM)诱导的肺纤维化的发生发展密切相关[3-4]。
苦参碱(matrine,MA)是一种从传统中药苦参中分离出来的生物碱,大量证据表明MA具有抗氧化[5]、抗炎[6]及抗纤维化[7]等多种生物和药理学作用。近年来,MA对肺纤维化的干预作用已经得到了广泛研究[8],但是其机制尚不清楚。本研究拟通过博莱霉素诱导的实验性小鼠肺纤维化模型,探索苦参碱是否通过对博莱霉素诱导单核/巨噬细胞表型偏移的调控,从而干预了肺纤维化的发生发展。
材 料 和 方 法
1 动物
健康C57BL/6雄性小鼠,8~10周龄,体重18~20 g,购自中国人民解放军军事医学科学院实验动物中心,许可证号为SCXK-(军)2012-0004。小鼠常规饲养于清洁级动物房内,适应性喂养1周后进行实验。
2 主要试剂
注射用盐酸博莱霉素(NIPPON KAYAKU);苦参碱(纯度>98%,由武警后勤学院生药教研室陈虹教授提供);FITC标记的抗小鼠Ly6C抗体、PE标记的抗小鼠 CD11b抗体、7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)、PerCP/Cy5.5 标记的抗小鼠Ly6G、PE标记的抗小鼠CD206和PerCP/Cy5.5标记的抗小鼠CD64均购自BioLegend;羟脯氨酸(hydroxyproline, HYP)测定试剂盒(碱水解法,南京建成生物工程研究所);其余试剂均为国产分析纯。
3 主要方法
3.1 动物模型的制备 160只C57BL/6雄性小鼠随机分为生理盐水(normal saline, NS)组、BLM组、BLM+NS组和BLM+MA组。参照Lakatos等[9]经口咽吸入法建立肺纤维化模型,BLM组给予BLM(2.5 mg/kg),NS组给予等体容积无菌生理盐水。BLM+MA组在造模后每天经口灌胃给予MA(15 mg·kg-1·d-1),BLM+NS组给予同等容积的生理盐水灌胃。
3.2 标本的采集及处理 分别于模型建立后第3、7、14和21天取材。首先采用乙二胺四乙酸(ethy-lene diamine tetraacetic acid,EDTA)抗凝管经下颌静脉采集取外周静脉血50 μL,进行循环单核细胞亚群的流式细胞术检测。然后将小鼠轻度麻醉后摘眼球放血致死,灌洗组用1 mL预冷无菌生理盐水行经支气管肺泡灌洗,重复3次,支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)离心后用于流式细胞术分析。未灌洗组左肺行病理学检测;灌洗组左肺用于HYP含量的测定。
3.3 肺组织病理学检测 根据前期研究结果[3],选择炎症反应明显的时点第3、7天进行检测。对肺组织进行固定、脱水、透明、浸蜡及包埋处理后,切片。按常规方法进行苏木素-伊红(hematoxylin and eosin,HE)染色和Masson染色。参照Szapiel等[10]方法进行炎症评分(inflammation score,IS),取其平均值代表肺组织的炎症程度。采用Image-Pro Plus 4.5软件对肺间质纤维化程度进行分析,胶原容积分数(collagen volume fraction,CVF)代表肺纤维化程度,公式如下:CVF(%)=胶原面积/(图像总面积-空白区域面积)×100%。
3.4 流式细胞术检测循环单核细胞亚群比例变化 根据前期研究结果[3],选择单核细胞表型偏移明显的时点第3、7天进行检测。取新鲜EDTA抗凝血50 μL,按照说明书推荐剂量,加入PE-CD11b、FITC-Ly6C和PerCP/Cy5.5-Ly6G抗体及各自的同型对照抗体并混匀,24 ℃避光孵育15 min,加入红细胞裂解液600 μL,混匀后避光静置10 min,FC500流式细胞仪(Beckman Coulter,USA)检测。流式细胞术设门策略参见文献[11]。
3.5 肺泡巨噬细胞(alveolar macrophages, AMφ)表型偏移 根据前期研究结果[3],选择巨噬细胞表型偏移明显的时点第3、7、14天进行检测。用50 μL staining buffer重悬计数5×105BALF细胞,加入PerCP/Cy5.5-CD64和PE-CD206抗体,混匀后24 ℃避光孵育15 min,然后加入7-AAD,混匀后避光孵育5 min,加入600 μL staining buffer,300目尼龙滤网过滤后,流式细胞仪检测。设门策略参见文献[4]。
3.6 小鼠肺组织HYP含量测定 根据前期研究结果[3],选择肺纤维化程度最明显的时点第21天进行检测。按照试剂盒说明书采用碱水解法水解肺组织,氯胺T法测定肺组织HYP含量。
4 统计学处理
采用STATA 14.1软件进行统计分析。计量资料均采用均数±标准差(mean±SD)表示,多组间的比较采用单因素方差分析,组间两两比较采用Tukey’s检验,相关性采用Pearson相关分析,以P<0.05为差异有统计学意义。
结 果
1 各组小鼠的肺组织病理变化观察
如图1所示,NS组肺组织经HE染色后在普通光学显微镜下可见肺泡结构基本正常,无炎性细胞浸润和胶原纤维沉积。与NS组相比,BLM组及BLM+ NS组在第3天可见炎性细胞浸润,部分肺间隔增厚,第7天炎症反应加重,可见大量炎性细胞浸润,肺泡间隔明显增厚,肺泡腔塌陷。给予苦参碱干预的BLM+MA组炎性细胞浸润及肺泡腔增厚与BLM组及BLM+NS组相比较轻,肺泡结构相对完整。第3、7天,与NS组相比,BLM组和BLM+NS组的IS增高(P<0.01);BLM+MA组的IS低于BLM+NS组(P<0.05)。Masson染色结果显示,NS组各时点均未见明显胶原沉积。与NS组相比,第21天,BLM组及BLM+NS组可见大量致密的蓝色胶原纤维,BLM+MA组胶原纤维减少。BLM组CVF值较NS组显著升高(P<0.01),BLM+MA组CVF值低于BLM+NS组(P<0.01)。
2 各组小鼠肺组织羟脯氨酸含量的变化
与NS组相比,BLM组第21天的HYP含量明显增高(P<0.01);与BLM+NS组相比,BLM+MA组的HYP含量明显降低(P<0.05),见图1。
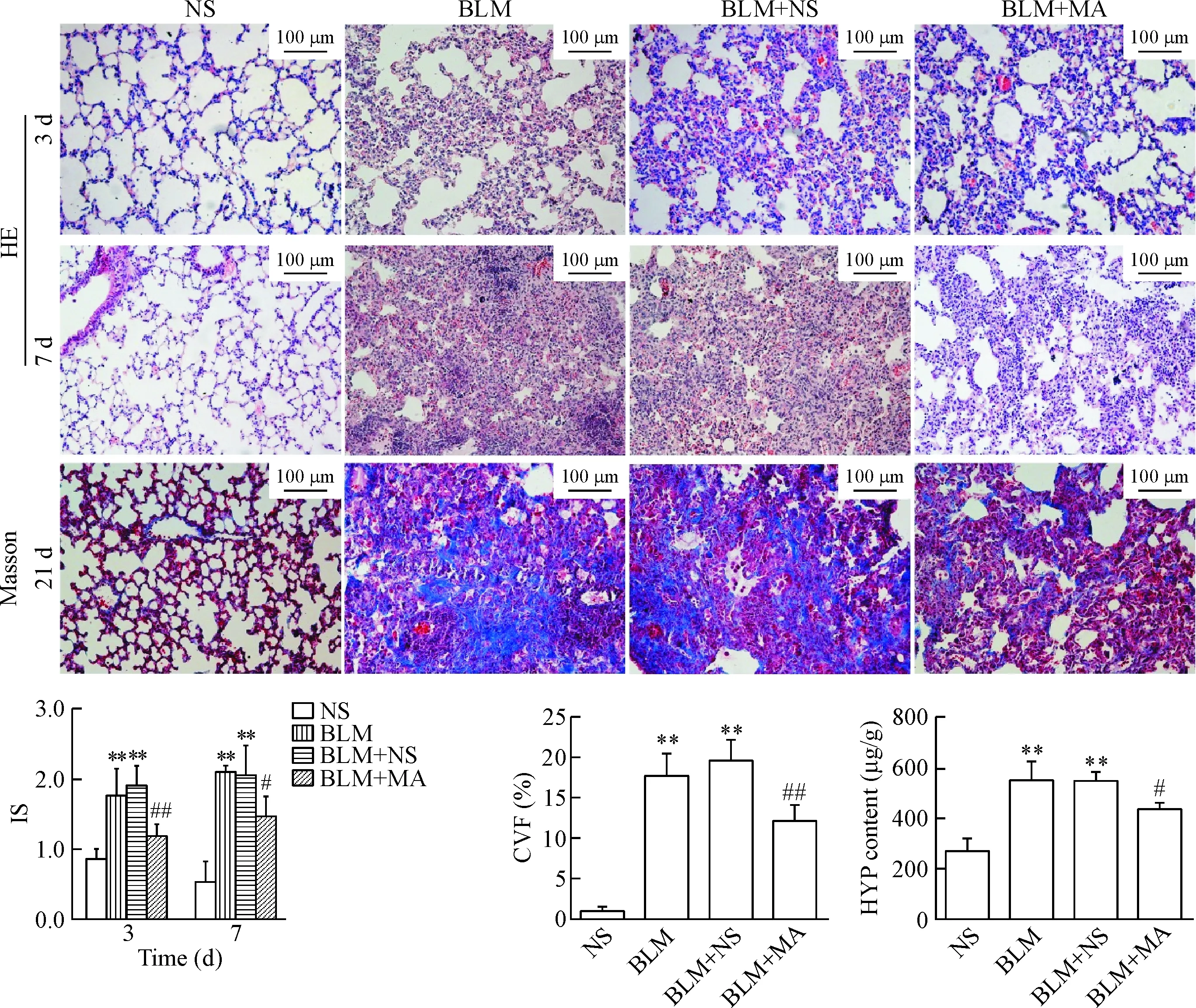
Figure 1.The result of pathological staining and inflammation score (IS), collagen volume fraction (CVF), and hydroxyproline (HYP) content in the mouse lung tissues. Mean±SD.n=5.**P<0.01vsNS group;#P<0.05,##P<0.01vsBLM+NS group.
图1 苦参碱干预后各组小鼠肺组织病理染色及评分结果
3 各组小鼠循环单核细胞亚群比例的变化
流式细胞术分析结果显示,NS组不同时点之间2种单核细胞亚群比例变化差异无统计学显著性。与NS组相比,第 3、7天BLM组Ly6Chi的比例均升高(P<0.01);与BLM+NS组相比,BLM+MA组第3天的Ly6Chi亚群比例降低(P<0.05),第7天有下降趋势,但差异无统计学显著性。Ly6Clo单核细胞亚群比例变化趋势与Ly6Chi相反,见图2。
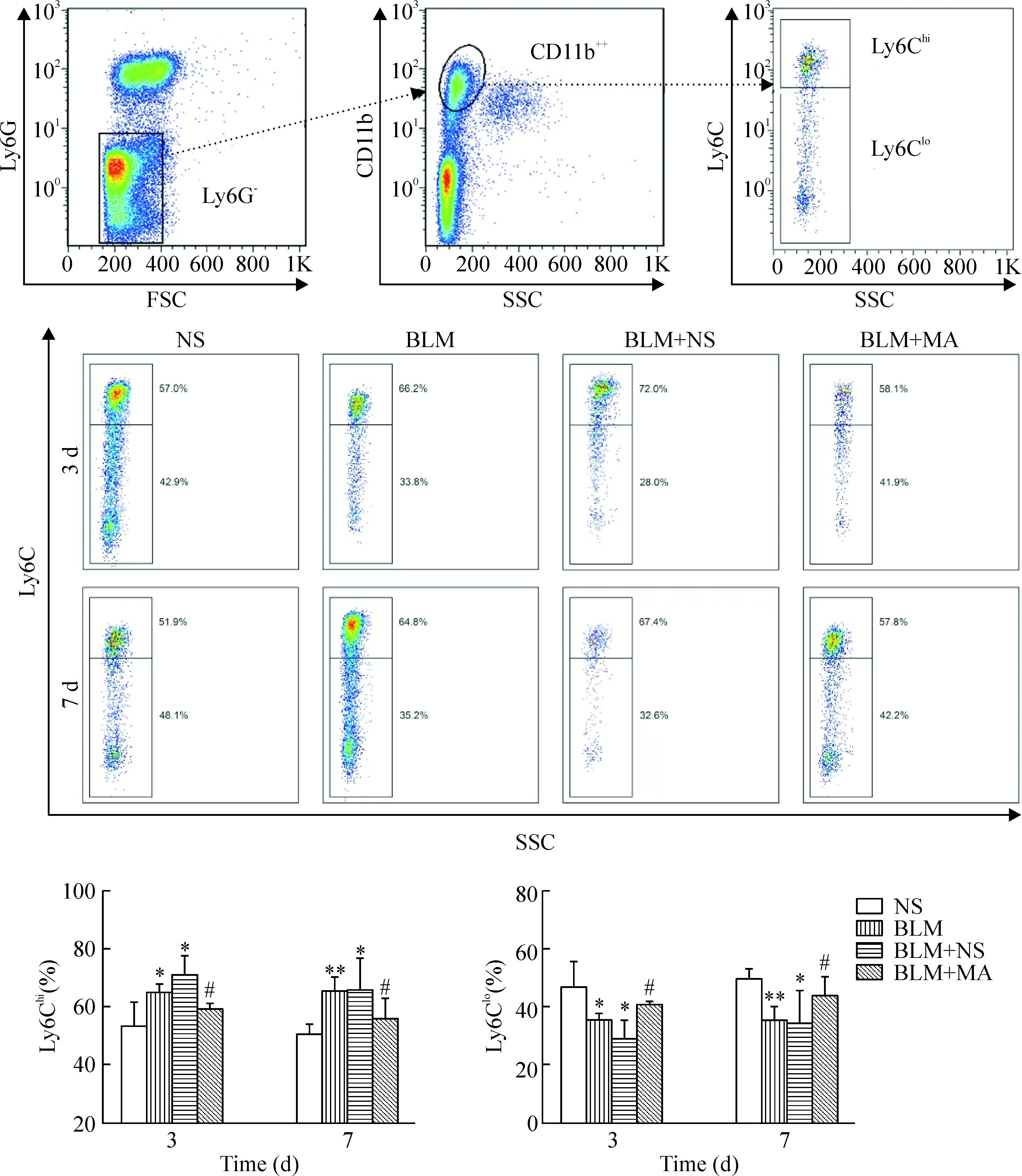
Figure 2.Matrine treatment reversed mononuclear phenotype switching induced by bleomycin. Mean±SD.n=5.*P<0.05,**P<0.01vsNS group;#P<0.05vsBLM+NS group.
图2 苦参碱干预后各组小鼠循环单核细胞亚群的变化
4 各组小鼠肺泡巨噬细胞表型比例的变化
流式细胞术分析结果显示,NS组不同时点之间2种巨噬细胞表型比例变化差异无统计学显著性。与NS组相比,BLM组各时点AMφ M1的比例均降低(P<0.01);与BLM+NS组相比,BLM+MA组第3天AMφ M1的比例变化差异无统计学显著性,第7、14 天BLM+MA组 AMφ M1的比例均升高(P<0.01)。AMφ M2比例变化趋势与AMφ M1相反,见图3。
5 单核细胞亚群Ly6Chi与IS和CVF的相关关系
小鼠循环单核细胞亚群Ly6Chi在博莱霉素干预后,比例迅速升高,在炎症反应期维持较高水平。将相同时点各组小鼠单核亚群Ly6Chi比例与相应肺组织IS,以及将变化最大的第3天小鼠单核亚群Ly6Chi比例与第21天的CVF进行相关性分析,结果如图4所示,Ly6Chi比例与IS呈明显正相关(r=0.6328,P<0.01),Ly6Chi比例的变化与CVF值亦呈明显正相关性(r=0.7857,P<0.01)。
6 M2肺泡巨噬细胞与IS和CVF的相关关系
小鼠M2肺泡巨噬细胞在博莱霉素干预后,比例升高,经MA干预后比例有所下降。将相同时点各组小鼠AMφ M2比例与相应肺组织IS,以及将变化最大的第14天小鼠AMφ M2的比例与第21天的CVF进行相关性分析,结果如图4所示,AMφ M2比例与IS呈明显正相关(r=0.7014,P<0.01),AMφ M2与CVF值亦呈明显正相关性(r=0.9326,P<0.01)。
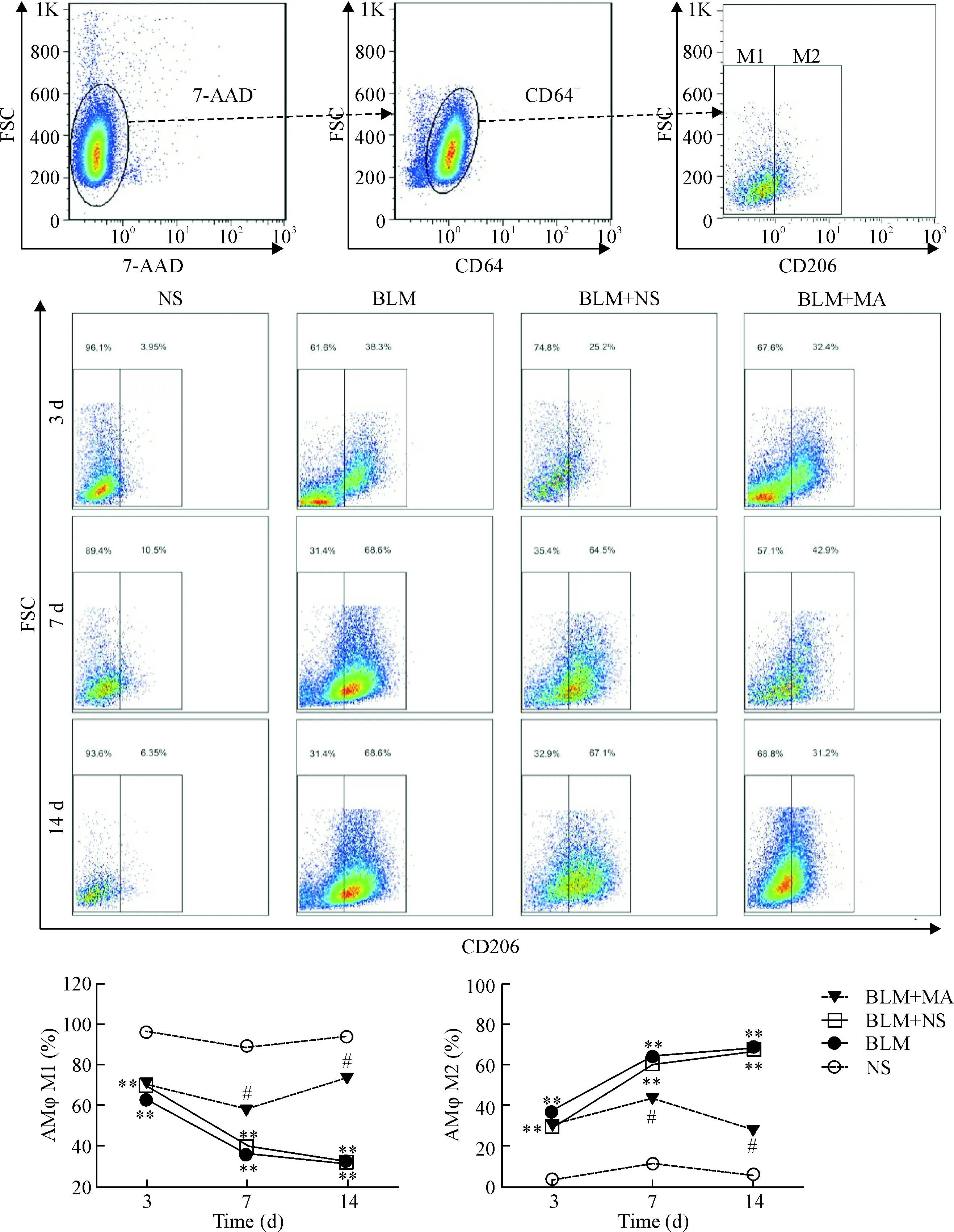
Figure 3.Matrine treatment reversed alveolar macrophages switching induced by bleomycin. Mean±SD.n=5.**P<0.01vsNS group;#P<0.05vsBLM+NS group.
图3 苦参碱干预后各组小鼠肺泡巨噬细胞表型的变化
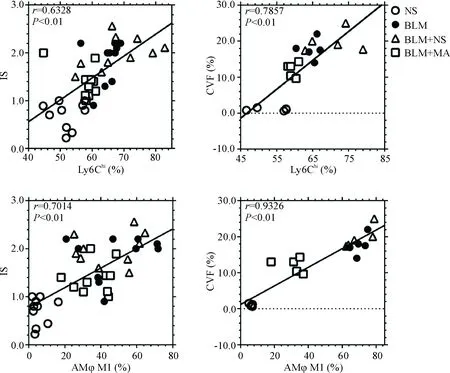
Figure 4.Pooled correlation analysis between mononuclear phagocytes and lung pathological changes.
图4 Ly6Chi单核细胞亚群和M2型肺泡巨噬细胞与炎症评分、胶原容积分数的相关性分析
讨 论
在机体中,骨髓干细胞发育成单核母细胞,后者进一步分化成为前单核细胞并进入血流,在此处分化成为成熟的单核细胞,单核细胞穿过血管内皮,迁移到不同的组织,分化成为组织特异性的巨噬细胞,由于巨噬细胞是一种异质性细胞群体,不同组织甚至同一组织的巨噬细胞在表型和功能方面也存在较大差异[12-13]。由于单核/巨噬细胞具有异质性,小鼠单核细胞可分为具有抗炎作用的单核细胞Ly6Chi群和具有“巡视”功能的单核细胞Ly6Clo群[14]。巨噬细胞在不同环境刺激下分化为经典活化巨噬细胞(classically activated macrophage,CAMs/M1)和选择性活化巨噬细胞(alternatively activated macrophage,AAMs/M2)2种极化类型。M1型细胞参与正向免疫应答,进行免疫监视;M2型细胞具有抑制炎症的表型,同时能够促进血管、淋巴管、肉芽组织的新生,促进组织修复[15]。本课题小组前期研究发现通过盐皮质激素受体阻断剂调节肺泡巨噬细胞的表型偏移能够有效改善二氧化硅所致矽肺的早期炎症反应及后期的肺纤维化程度[16]。
目前大量研究主要还是从抗炎及抗氧化等方面对博莱霉素诱导肺纤维化进行探讨[17-19]。苦参碱在治疗肺纤维化等疾病过程中也主要发挥着抗纤维化、抗炎、抗氧化等作用[20-21],但其治疗肺纤维化的具体作用机制仍不明确。本课题小组前期研究结果显示在博莱霉素诱导的小鼠实验性肺纤维化过程中,单核/巨噬细胞亚群随着肺纤维化程度的发生发展呈明显的动态变化[3],同时发现给予螺内酯阻断盐皮质激素受体后减轻了早期炎症反应及后期纤维化程度,其可能是通过降低炎症早期快速升高的Ly6Chi单核细胞数量及抑制肺泡巨噬细胞选择性激活实现的[11]。结合前期研究,在本研究中经MA干预后第3天肺组织的炎性细胞浸润明显减轻,同时发挥促炎作用的Ly6Chi群的比例也明显低于对照组。在MA干预后,第21天肺组织CVF和HYP均低于BLM+NS组,同时发挥促纤维化作用的AMφ M2在第7、14天均低于BLM+NS组。通过相关性分析发现,Ly6Chi比例和AMφ M2比例与炎症反应及肺纤维化程度均有一定的相关性,尤其发现第14天的AMφ M2比例与后期(第21天)肺纤维化程度密切相关。由此结果可验证本研究假设:苦参碱发挥作用,可能是通过抑制博莱霉素致小鼠肺纤维化过程中单核细胞和巨噬细胞表型偏移,抑制Ly6Chi比例及促纤维化肺泡巨噬细胞M2的升高,进而减轻炎症细胞渗出和胶原沉积。同时前期的Ly6Chi比例和AMφ M2比例能够预测出后期的肺纤维化严重程度。
综上所述,MA可以在一定程度上通过降低炎症反应期的Ly6Chi表型的单核细胞的比例,和降低肺纤维化期的AMφ M2的比例,进而减轻炎症反应和肺纤维化程度。MA通过调控单核/巨噬细胞表型治疗博莱霉素诱导的肺纤维化的具体分子生物学机制有待后续进一步研究。
[1] 金晓光, 代华平, 庞宝森, 等. 博莱霉素致大鼠肺纤维化模型肺组织的动态病理变化及其发生机制 [J]. 中国病理生理杂志, 2009, 29(4):708-714.
[2] Jantsch J, Binger KJ, Muller DN, et al. Macrophages in homeostatic immune function [J]. Front Physiol, 2014, 5:146.
[3] Ji WJ, Ma YQ, Zhou X, et al. Temporal and spatial cha-racterization of mononuclear phagocytes in circulating, lung alveolar and interstitial compartments in a mouse model of bleomycin-induced pulmonary injury[J]. J Immunol Methods, 2014, 403(1-2):7-16.
[4] Xiang GA, Zhang YD, Su CC, et al. Dynamic changes of mononuclear phagocytes in circulating, pulmonary alveolar and interstitial compartments in a mouse model of experimental silicosis[J]. Inhal Toxicol, 2016, 28(9):393-402.
[5] Zhao P, Zhou R, Zhu XY, et al. Matrine attenuates focal cerebral ischemic injury by improving antioxidant activity and inhibiting apoptosis in mice[J]. Int J Mol Med, 2015, 36(3):633-644.
[6] Sun D, Wang J, Yang N, et al. Matrine suppresses airway inflammation by downregulating SOCS3 expression via inhibition of NF-κB signaling in airway epithelial cells and asthmatic mice[J]. Biochem Biophys Res Commun, 2016, 477(1):83-90.
[7] Yu JL, Li JH, Chengz RG, et al. Effect of matrine on transforming growth factor beta1 and hepatocyte growth factor in rat liver fibrosis model[J]. Asian Pac J Trop Med, 2014, 7(5):390-393.
[8] Ma X, Chen R, Liu X, et al. Effects of matrine on JAK-STAT signaling transduction pathways in bleomycin-induced pulmonary fibrosis[J]. Afr J Tradit Complement Altern Med, 2013, 10(3):442-448.
[9] Lakatos HF, Burgess HA, Thatcher TH, et al. Oropharyngeal aspiration of a silica suspension produces a supe-rior model of silicosis in the mouse when compared to intratracheal instillation[J]. Exp Lung Res, 2006, 32(5):181-199.
[10]Szapiel SV, Elson NA, Fulmer JD, et al. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. Am Rev Respir Dis, 1979, 120(4):893-899.
[11]Ji WJ, Ma YQ, Zhou X, et al. Spironolactone attenuates bleomycin-induced pulmonary injury partially via modulating mononuclear phagocyte phenotype switching in circulating and alveolar compartments[J]. PLoS One, 2013, 8(11):e81090.
[12]Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation [J]. Nat Rev Immunol, 2008, 8(12):958-969.
[13]Wallner S, Grandl M, Konovalova T, et al. Monocyte to macrophage differentiation goes along with modulation of the plasmalogen pattern through transcriptional regulation[J]. PLoS One, 2014, 9(4):e94102.
[14]Tam JW, Kullas AL, Mena P, et al. CD11b+Ly6ChiLy6G-immature myeloid cells recruited in response toSalmonellaentericaserovar Typhimurium infection exhibit protective and immunosuppressive properties[J]. Infect Immun, 2014, 82(6):2606-2614.
[15]De Paoli F, Staels B, Chinetti-Gbaguidi G. Macrophage phenotypes and their modulation in atherosclerosis[J]. Circ J, 2014, 78(8):1775-1781.
[16]苏程程, 张译丹, 向国安, 等. 盐皮质激素受体阻断剂对SiO2诱导的肺巨噬细胞表型偏移的调节 [J]. 中国病理生理杂志, 2016, 32(6):1112-1117.
[17]高淑艳, 冯 涛. 丙戊酸钠减轻博莱霉素致大鼠肺纤维化[J]. 中国病理生理杂志, 2015, 31(3):552-556.
[18]黄新莉. 博莱霉素诱导的肺纤维化大鼠肺组织中AAT/SO2的变化[J]. 中国病理生理杂志, 2015, 31(10):1904.
[19]彭 婷, 杜海坚, 李 理, 等. 吉非替尼通过增加Foxo3a活性抑制肺纤维化小鼠上皮-间质转分化[J]. 中国病理生理杂志, 2014, 30(3):444-448.
[20]Zhang B, Liu ZY, Li YY, et al. Antiinflammatory effects of matrine in LPS-induced acute lung injury in mice[J]. Eur J Pharm Sci, 2011, 44(5):573-579.
[21]凌 伟, 谢 敏, 石俊青. 苦参碱对肺成纤维细胞TGF-β1信号转导途径的干预作用[J]. 四川大学学报:医学版, 2009, 40(6):994-999.
(责任编辑: 卢 萍, 罗 森)
Matrine attenuates bleomycin-induced pulmonary injury partially via modulating mononuclear phagocyte phenotype switching in mice
LI Xin1, LI Qi1,3, LI Yi1, SU Cheng-cheng1, ZHOU Xin2, PENG Shou-chun1, WEI Lu-qing1, JI Wen-jie1
(1DepartmentofRespiratoryMedicine&IntensiveCareMedicine,2HeartCenter,3PostgraduateTrainingBaseofJinzhouMe-dicalUniversity,AffiliatedHospitalofLogisticsUniversityofChinesePeople’sArmedPloiceForce,Tianjin300162,China.E-mail:ji_wenjie@hotmail.com;wei_luqing@hotmail.com)
AIM: To investigate the influence of matrine (MA) on the phenotype switching of mouse monocytes and alveolar macrophages induced by bleomycin (BLM). METHODS: All mice were randomly divided into normal saline (NS) group, BLM group, BLM+NS group and BLM+MA group. The mice were administered with BLM at 2.5 mg/kg via oropharyngeal instillation. The mice in BLM+MA group were treated with MA (15 mg·kg-1·d-1) by oral gavage following BLM administration. The mice were sacrificed on days 3, 7, 14, and 21. The lungs were removed for pathological analysis. The circulating monocyte subsets and polarization state of bronchoalveolar lavage fluid (BALF)-derived alveolar macrophages were analyzed by flow cytometry.RESULTS: The results of HE and Masson trichrome staining in BLM and BLM+NS groups exhibited classical pathological stages of lung fibrosis, including acute inflammation phase and later fibrosis phase. Compared with BLM+NS group, MA treatment alleviated the inflammatory response and the degree of fibrosis induced by BLM (P<0.05). There was a rapid change of circulating Ly6Chimonocytes and its magnitude was positively associated with the pulmonary inflammatory response. An expansion of M2-like alveolar macrophages was positively correlated with the magnitude of lung fibrosis. Moreover, MA treatment partially normalized the phenotype switching of monocytes and alveolar macrophages.CONCLUSION: Matrine treatment attenuates BLM-induced pulmonary injury partially via modulating the phenotype switching of monocytes and alveolar mocrophages.
Matrine; Pulmonary fibrosis; Monocytes; Macrophages; Bleomycin
1000- 4718(2017)02- 0322- 07
2016- 09- 05
2016- 10- 09
国家自然科学基金资助项目(No. 81102088; No. 81441101; No. 81570335);天津市自然科学基金资助项目(No. 15JCZDJC35000);武警后勤学院附属医院重点项目(No. FYZ201510; No. FYZ201605)
R363.2
A
10.3969/j.issn.1000- 4718.2017.02.021
杂志网址: http://www.cjpp.net
△通信作者 姬文婕 Tel: 022-60577283; E-mail: ji_wenjie@hotmail.com; 魏路清 Tel: 022-60578671; E-mail: wei_luqing@hotmail.com
▲并列第1作者
