人寡肽转运体1转染MDCK细胞与转染HeLa细胞的比较研究
2017-02-27傅晓钟张文政
罗 敏,傅晓钟,肖 涛,张文政,李 静,陈 雅,刘 亭
(贵州医科大学 1.药学院、2.贵州省药物制剂重点实验室、3.民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004;4.国家苗药工程技术研究中心,贵州 贵阳 550004)
◇实验方法学◇
人寡肽转运体1转染MDCK细胞与转染HeLa细胞的比较研究
罗 敏1,3,4,傅晓钟1,3,肖 涛1,3,张文政1,3,李 静1,3,陈 雅1,3,4,刘 亭1,2
(贵州医科大学 1.药学院、2.贵州省药物制剂重点实验室、3.民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004;4.国家苗药工程技术研究中心,贵州 贵阳 550004)
目的 筛选出更适宜的转染受体细胞,提高构建人寡肽转运体1(human peptide transporter 1,hPepT1)高表达细胞系的效率。方法 利用LipofectamineTM2000转染试剂将pcDNA3.1(+)-hPepT1质粒分别转染进MDCK细胞与HeLa细胞,并进行单克隆细胞的挑选和扩大培养。通过qRT-PCR与Western blot技术来检测两种受体细胞中hPepT1 mRNA与蛋白的表达水平,并利用超高效液相色谱-串联质谱法(UPLC-MS/MS)对两种单克隆转染细胞的hPepT1典型底物甘氨酰肌氨酸(Glysar)摄取能力进行考察。 结果 MDCK细胞与HeLa细胞转染后,hPepT1 mRNA与蛋白表达水平以及Glysar的摄取能力均明显高于其野生型细胞(P<0.05);虽然Glysar在HeLa细胞中的摄取量高于MDCK细胞,但MDCK-hPepT1细胞中hPepT1 mRNA与蛋白表达水平以及Glysar的摄取能力却高于HeLa-hPepT1细胞。结论 在hPepT1稳定高表达转染细胞模型的构建中,为提高hPepT1的转染效率,从而获得更高效的转染细胞模型,以MDCK细胞作为转染的受体细胞可能是更为适宜的选择。
马丁-达比犬肾上皮细胞;子宫颈癌细胞;人寡肽转运蛋白1;稳定转染;qRT-PCR;Western blot;Glysar摄取
人寡肽转运体1(human peptide transporter 1,hPepT1)是一种主要表达于哺乳动物小肠上皮刷状缘膜基顶侧[1]的肠肽转运体,能够介导二肽、三肽化合物以及拟肽类药物的转运吸收[2],其对药物在肠道的吸收和分布过程中发挥着重要作用。在很多新药研发中,利用hPepT1为靶点进行合理药物设计以改善药物细胞膜透过性,从而提高药物的生物利用度成为研究的热点。此外,hPepT1在一些中药单体的透肠吸收筛选中也具有重要意义。因此,如何高效快速地构建一个hPepT1稳定高表达的有效体外细胞模型,对以hPepT1为靶点的新药合成研究以及某些中药单体的筛选和吸收机制研究提供良好工具具有重要意义。目前,研究hPepT1介导的药物吸收机制常用的体外细胞模型有hPepT1高表达的转染细胞模型以及瘦素诱导的 Caco-2 细胞模型。而MDCK细胞与HeLa细胞在hPepT1高表达转染细胞模型的构建中成为应用最为广泛的两种受体细胞。MDCK-hPepT1细胞系与HeLa-hPepT1细胞系被广泛用于hPepTl底物的研究[3-6]。但是,对于转染受体细胞的选择,究竟MDCK细胞与HeLa细胞,哪一种细胞作为hPepT1转染的受体细胞更为适宜,更有利于hPepT1转染细胞模型的建立以及应用,未见有相关文献报导。因此,本实验分别构建了MDCK-hPepT1稳定转染细胞系与HeLa-hPepT1稳定转染细胞系,并对两种稳定转染细胞系中hPepT1的表达水平、hPepT1典型底物甘氨酰肌氨酸(Glysar)的摄取能力进行了验证比较,旨在找到更为适宜的转染受体细胞,从而提高hPepT1细胞模型的构建效率稳定性,也为今后以hPepT1为靶点的新药合成研究中药物的筛选和吸收机制研究奠定基础。
1 材料与方法
1.1 药品、试剂与仪器 pcDNA3.1(+)-hPepT1质粒由京博迈德基因技术有限公司构建;AxyPrepTMPlasmid Miniprep Kit(批号0811北4KA1)购于AxyGen公司;TRIzol试剂(批号15596026)、LipofectamineTM2000转染试剂(批号1657828)购自Invitrogen公司; EastepTM总RNA提取试剂盒(批号7020001018)购于上海普洛麦格生物产品有限公司;TOP10感受态细胞、RIPA裂解液(批号20151020)、BCA蛋白浓度测定试剂盒(批号20150413)、SDS-PAGE凝胶制备试剂盒(批号20160118)、ECL超敏发光液(批号20151020)均购于Solarbio公司;PrimeScript RT试剂盒(批号AK5402)购于TaKaRa公司;一抗rabbit IgG(批号L7342)购于Santa Cruz Biotechnology公司;二抗goat anti rabbit IgG(H+L)(批号GR231489-3)购于Abcam公司;β-actin引物上游5′-CCCCTGAATCCCAAAGCC-3′,引物下游5′-GATGTCACGCACGATCTCCC-3′;hPepT1引物上游5′-GCTCTTATCGCCGACTCGTG-3′,引物下游5′-GGGTTTGATTCCTCCAGTCC-3′由Invitrogen公司设计合成;DMEM高糖培养基(批号8114031)、胎牛血清(FBS,批号1227694)、胰蛋白酶(批号J130049)、G418(批号G8160)均购于Gibco公司;LB肉汤购于青岛高科园海博生物技术有限公司;肌肽、甘氨酰肌氨酸购于美国Sigma公司,质量分数均大于98%;异烟肼购于中国生物制品检定所。
CO2细胞培养箱、Heraeus Fresco17冷冻高速离心机、Biomate3S蛋白核酸分析仪购于Thermo Scientific公司;Modle680酶标仪、PowerPac Basic电泳仪、Trans-Blot Turbo蛋白快速转印仪、CFX96实时荧光定量PCR仪、ChemiDoc XRS+凝胶成像仪均购于Bio Rad公司;Acugity-TDQ型超高效液相色谱-串联质谱购于Waters公司。
1.2 pcDNA3.1(+)-hPepT1质粒的转化扩增、提取纯化 质粒pcDNA3.1(+)-hPepT1作为表达载体,用TOP10感受态细胞扩增质粒。在无菌环境下,取100 μL TOP10感受态细胞置于1.5 mL无菌离心管中,向感受态细胞悬液中加入5 μL pcDNA3.1(+)-hPepT1质粒,轻轻混匀后冰浴放置30 min,将离心管置于42 ℃水浴中60~90 s,然后快速转移到冰浴中放置2~3 min。向离心管中加入500 μL无菌无抗的LB培养基,37 ℃、180 r·min-1震荡培养1 h,使质粒上相关的抗性标记基因表达,使菌体复苏。然后取100 μL已转化的TOP10感受态细胞涂布于含Ampicillin抗生素(100 mg·L-1)LB平板,37 ℃倒置培养12 h后,挑取单克隆菌体接种于含Ampicillin抗生素(100 mg·L-1)的无菌LB液体培养基中,37 ℃、200 r·min-1震荡培养12 h。参照AxyPrepTMPlasmid Miniprep Kit试剂盒说明书提取纯化pcDNA3.1(+)-hPepT1质粒。
1.3 MDCK细胞与HeLa细胞培养 MDCK细胞(购于ATCC细胞库)与HeLa细胞(购于中国科学院细胞库)所用培养液均为含10%胎牛血清,不含抗生素的高糖DMEM,于37 ℃、5% CO2条件下培养。细胞贴壁生长,生长至80%~90%融合度时,用0.25%胰酶消化传代培养。
1.4 G418最佳筛选浓度的确定及MDCK细胞转染 分别将MDCK细胞与HeLa细胞以2×105个每孔种于24孔板,生长24 h后,加入G418浓度分别为400、500、600、700、800、 900 mg·L-1的DMEM培养基进行筛选,以14 d细胞全部死亡的浓度为最佳筛选浓度,最终确定最佳筛选浓度为800 mg·L-1。
分别将MDCK细胞与HeLa细胞以3×105个每孔种于6孔板,待细胞生长至85%左右融合度时,将LipofectamineTM2000转染试剂与pcDNA3.1(+)-hPepT1质粒按2 ∶1的体积质量比转染进MDCK细胞与HeLa细胞,转染48 h后加入含800 mg·L-1G418的完全培养基进行筛选培养,以800 mg·L-1的浓度培养14 d。
1.5 挑选单克隆细胞 将G418筛选14 d的转染的MDCK细胞与HeLa细胞,用胰酶消化后离心,培养基重悬后计数。采用有限稀释法,利用96孔板挑选出单克隆细胞并扩大培养。
1.6 qRT-PCR检测细胞中hPepT1 mRNA的表达 使用TRIzol与EastepTM总RNA提取试剂盒分别提取MDCK-hPepT1单克隆细胞(DH-m细胞)与HeLa-hPepT1(DH-h细胞)单克隆细胞中总RNA,测定RNA浓度后,分别取适量RNA与逆转录试剂在37 ℃反应15 min,85 ℃反应5 s条件下逆转录合成cDNA。将获得的cDNA及合成的引物进行qRT-PCR,PCR反应体系如下:
SYBR Premix Ex TaqⅡ 10.0 μL
hPepT1上游引物 0.8 μL
hPepT1下游引物 0.8 μL
cDNA模板 2.0 μL
ddH2O 6.4 μL
PCR反应条件:94 ℃预变性3 min,然后进行40个循环的反应(94 ℃ 30 s ,56 ℃ 30 s,72 ℃ 35 s),以β-actin作为内参。
1.7 Western blot检测分析hPepT1的表达 分别对DH-m细胞与DH-h细胞及其野生型细胞中的蛋白进行Western blot检测分析。收集细胞,用PBS洗涤3次,以适量RIPA裂解液(含蛋白酶抑制剂)吹打混匀,在冰上放置30 min(每隔10 min涡旋1次),4 ℃、12 000 r·min-1离心15 min,取上清(总蛋白),-80 ℃保存。SDS-PAGE 凝胶电泳用10%分离胶,5%浓缩胶,BCA法测定蛋白浓度,每孔总蛋白上样量为50 μg,90 V电泳15 min,120 V电泳60 min。PVDF膜在1 A条件下转膜20 min,TBST洗涤3次(每次5~10 min),5% BSA室温封闭1~2 h,一抗4 ℃孵育过夜(一抗是兔抗人的hPepT1多克隆抗体IgG 1 ∶500 稀释),TBST洗涤3次(每次5~10 min),二抗[山羊抗兔IgG(H+L)]1 ∶5 000稀释)室温孵育2 h,TBST洗涤3次(每次5~10 min),最后用ECL超敏化学发光试剂A液、B 液按1 ∶1混匀,取适量滴加在PVDF膜上后,利用ChemiDoc XRS+凝胶成像系统进行扫描曝光。
1.8 BCA法测定细胞蛋白浓度 参照BCA蛋白浓度测定试剂盒说明书,测定细胞裂解中蛋白浓度。测定步骤如下:根据所要测定的样品数量,取适量的BCA试剂与Cu试剂按50 ∶1的体积比配制成BCA工作液,混匀后室温放置。工作曲线制备:取适量BSA蛋白标准液,用PBS稀释液稀释至浓度为0.5 g·L-1。分别取0、1、2、4、8、12、16、20 μL标准液至96孔板,加PBS稀释液补足至20 μL。待测样品的制备:将提取的总蛋白用PBS稀释液稀释至初始浓度的0.1,取稀释后的待测样品20 μL至96孔板中。待测样品与标准蛋白液各加入200 μL BCA工作液,37 ℃放置20 min后,酶标仪测定各孔吸光度值A570,根据标准曲线计算待测样品蛋白浓度。曲线方程为Y=0.056 3X+0.075 35(R2=0.997 1)。计算样品中蛋白质量浓度时,取吸光度值在标准曲线范围的稀释样品,曲线方程法计算样品质量浓度。
1.9 Glysar的摄取研究
1.9.1 Glysar在DH-m、DH-h细胞及野生型细胞中的摄取研究 分别将DH-m、DH-h细胞及其野生型细胞以密度2×105个每孔种于6孔板,生长48 h后,进行摄取实验:细胞用37 ℃ HBSS (pH 7.4)洗3遍,37 ℃预孵育15 min后除去孵育液,对照组(野生型细胞)和模型组(转染细胞)分别加入含0.2 mmol·L-1Glysar的HBSS(pH 6.0)2 mL。37 ℃孵育30 min后,用冰冷的HBSS洗3遍终止摄取,用RIPA裂解后,4 ℃、12 000 r·min-1离心15 min,取100 μL上清液,加入适量的异烟肼溶液(内标)和100 μL甲醇沉淀蛋白,涡旋,12 000 r·min-1离心20 min,取上清液用HPLC-MS对Glysar进行含量测定。利用内标法制备标准曲线方程为:Y=2.308 8X+0.031 9 (R2=0.999 4)。用BCA法测定每孔细胞总蛋白浓度,摄取结果用蛋白总量进行校正。
1.9.2 不同浓度Glysar在DH-m、DH-h细胞及其野生型细胞中的摄取研究 分别将DH-m、DH-h细胞及其野生型细胞以密度2×105个每孔种于6孔板,生长48 h后,进行摄取实验:细胞用37 ℃ HBSS(pH 7.4)洗3遍,37 ℃预孵育15 min后除去孵育液,将Glysar用HBSS(pH 6.0)配制成浓度为0.2、1.0、5.0 mmol·L-1的溶液,将不同浓度的Glysar分别加入上述细胞,37 ℃孵育30 min后,用冰冷的HBSS洗3遍终止摄取,按“1.9.1”项下的“样品处理”依法操作后,用UPLC-MS/MS对Glysar进行含量测定。
1.9.3 Glysar在DH-m、DH-h细胞及其野生型细胞中不同时间的摄取研究 分别将DH-m、DH-h细胞及其野生型细胞以密度2×105个每孔种于6孔板,生长48 h后,进行摄取实验:细胞用37 ℃ HBSS (pH 7.4)洗3遍,37 ℃预孵育15 min后除去孵育液,在上述细胞中分别加入含0.2 mmol·L-1Glysar的HBSS (pH 6.0)2 mL,37 ℃分别孵育5、10、15、20、30 min后,用冰冷的HBSS洗3遍终止摄取,按“1.9.1”项下的“样品处理”依法操作后,用UPLC-MS/MS对Glysar进行含量测定。
1.10 Glysar的HPLC-MS检测条件 色谱柱:Waters BEH C18(2.1 mm×50 mm,17 μm)柱,保护柱:Waters Van Guard C18(2.1 mm×50 mm,17 μm);流动相:A: 0.1%甲酸乙腈(V/V),B: 0.1%甲酸水(V/V),全梯度洗脱;流速:0.30 mL·min-1;柱温:45 ℃;进样体积:2 μL;质谱采用选择离子监测(SIR)扫描模式,以电喷雾离子源(ESI)在正离子电离模式下进行测定。离子源温度120 ℃;锥孔电压分别为16 V、30 V;碰撞电压分别为10 V、15 V;监测离子对147.1(Glysar),137.8(内标异烟肼)。
2 结果
2.1 hPepT1 mRNA在不同细胞中的表达 分别提取DH-m、DH-h细胞及其野生型细胞中总RNA,经实时荧光定量RT-PCR检测hPepT1 mRNA的表达。Tab 1显示,DH-m与DH-h细胞中hPepT1 mRNA的表达量均明显高于其野生型细胞。对于不同的两种受体细胞之间,从表中可以看出,虽然MDCK细胞中hPepT1 mRNA的表达量低于HeLa细胞,但是DH-m 细胞中hPepT1 mRNA的表达量明显高于DH-h细胞。
2.2 hPepT1在不同细胞中的表达 分别提取DH-m、DH-h细胞及其野生型细胞的总蛋白,通过Western blot技术检测上述细胞中hPepT1的表达情况(Fig 1)。结果显示,野生型HeLa细胞中同样产生了1条相对于DH-h细胞较弱但也很明显的目的蛋白条带,而在MDCK细胞中只有几乎看不见的1条极微弱的条带。与其野生型细胞比较,DH-h与DH-m细胞均有明显的目的蛋白条带。说明两种受体细胞经转染后,hPepT1的表达均明显升高。


CellhPepT1mRNAMDCK(0.02±0.0016)×10-3DH⁃m1.44±0.12∗HeLa(1.97±0.53)×10-2DH⁃h1.05±0.05#
*P<0.05vsMDCK cells;#P<0.05vsHeLa cells

Fig 1 Expression of hPepT in DH-m, DH-h cells and their wild type cells
2.3 Glysar的摄取研究
2.3.1 Glysar在不同细胞中的摄取 对Glysar在DH-m、DH-h细胞及其野生型细胞中的摄取情况进行考察。以进入细胞的Glysar浓度与每孔细胞的总蛋白浓度比值表示Glysar的摄取量。结果显示(Fig 2),与其野生型细胞相比较,Glysar在DH-m与DH-h细胞中的摄取量明显增加。Glysar在DH-h细胞中的摄取量低于DH-m细胞,而在HeLa细胞中的摄取量却高于MDCK细胞,这可能与受体细胞中存在的内源性目的蛋白有关。
2.3.2 不同浓度Glysar在不同细胞中的摄取 不同浓度的Glysar在DH-m、DH-h细胞及其野生型细胞中的摄取结果显示(Tab 2),在野生型细胞中,HeLa细胞对Glysar的摄取高于MDCK细胞,且一定程度上也呈浓度依赖性增加,而MDCK细胞对Glysar的摄取变化却很小。DH-m与DH-h细胞对Glysar的摄取均呈浓度依赖性增加,但DH-m细胞对Glysar的摄取高于DH-h细胞。
2.3.3 Glysar在不同细胞中不同时间的摄取 对DH-m细胞、DH-h细胞及其野生型细胞在不同时间对Glysar的摄取进行考察,结果显示(Fig 3),在野生型细胞中,MDCK细胞在不同时间对Glysar的摄取几乎没有什么变化,而HeLa细胞对Glysar的摄取不仅高于MDCK细胞,而且对Glysar的摄取在一定摄取时间内有明显增加趋势。而随着时间的增加,DH-m与DH-h细胞对Glysar的摄取量均逐渐增加,但DH-m细胞对Glysar的摄取高于DH-h细胞。
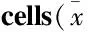
Tab 2 Uptake of various concentrations of Glysar in DH-m cells,DH-h cells and their wild type±s,n=3)
*P<0.05vsMDCK cells;#P<0.05vsHeLa cells

Fig 2 Uptake of Glysar in DH-m cells,DH-h cells

*P<0.05vsMDCK cells;#P<0.05vsHeLa cells

Fig 3 Uptake of Glysar in MDCK cells, DH-m cells,HeLa
3 讨论
人肠道寡肽转运体hPepT1作为一种研究比较深入的跨膜转运蛋白,被广泛用于hPepT1底物的筛选和吸收机制的研究。通过将带有编码目的蛋白基因的质粒转染细胞,使目的蛋白在细胞中高表达的转染细胞系的构建成为研究者的选择[7]。在前期研究中,作者参考已报道的文献[8-9],采用了瘦素诱导hPepT1在Caco-2 细胞中高表达的方法来构建相关细胞模型,但结果并不理想。实验发现,瘦素诱导的Caco-2细胞不能有效表达hPepT1。且研究表明,Caco-2 细胞中存在的多种转运通路对特定载体蛋白的研究也存在影响[10-11]。因此,构建hPepT1高表达的转染细胞系,或许能够为hPepT1底物的筛选和评价研究提供一个更好、更有效的体外细胞模型。在hPepT1高表达转染细胞系的构建中,已有多种细胞作为hPepT1转染的受体细胞被选择。本实验针对其中被应用最多的MDCK与HeLa两种细胞,旨在筛选出转染效率更高,内在因素影响更小的细胞作为hPepT1转染的受体细胞,从而提高构建的hPepT1高表达的转染细胞模型的有效性。
研究表明[12],虽然mRNA和蛋白水平是一个相偶联的过程,但是两者没有必然的一致的趋势,因此,mRNA水平升高并不意味着蛋白表达量就一定会提高。而构建hPepT1转染细胞模型的目的是从蛋白水平对药物进行评价研究,所以不仅在基因水平要有变化,还要在蛋白水平有变化才有意义。所以本实验通过qRT-PCR与Western blot析技术联合应用,分别从基因水平和蛋白水平对转染后的两种受体细胞进行检测比较分析,同时通过摄取实验对两种转染受体细胞中目的蛋白的活性功能进行验证比较分析。结果表明,在相同处理条件下,MDCK作为受体细胞经转染后,其mRNA、蛋白表达水平以及蛋白活性功能均优于转染的HeLa细胞。而从野生型细胞中蛋白表达和对Glysar的摄取结果来看,HeLa细胞有明显的目的蛋白条带,其对Glysar的摄取不仅高于MDCK细胞,而且在一定程度上呈增加趋势,这可能与HeLa细胞中内源性高表达hPepT1有关。研究表明[13],转染过程将对内源性目的蛋白的表达产生影响,使得在利用野生型细胞对研究结果进行校正分析的过程中产生较大的偏差。因此,选择内源性目的蛋白表达少或是不表达的细胞作为转染的受体细胞,更有利于转染细胞模型的构建和应用。实验结果表明,与HeLa细胞相比较,MDCK细胞转染效率高,内源性目的蛋白表达少甚至不表达,其作为hPepT1转染的受体细胞将是更好的选择。
实验发现,虽然MDCK细胞作为hPepT1转染的受体细胞优于HeLa细胞,但其不仅需要消化的时间比较长,而且不容易吹散成单个细胞,即使获得单个细胞,由于吹打时间长,吹打力度较大,细胞受损,获得的单个细胞很难贴壁生长增殖,这给单克隆细胞的挑选工作带来了极大的困难。因此,本实验在多次实验中摸索出了同1 d间隔8 h连续2 次胰酶消化法,不仅改善了MDCK细胞在胰酶消化时不易分散的问题,而且在消化过程中减少了细胞的吹打时间,降低了吹打力度,在获得单个细胞的同时也保证了细胞的完整性,从而提高了挑选单克隆细胞的效率。综上所述,本实验筛选出了对hPepT1转染来说更为适宜的受体细胞,在为今后建立hPepT1高表达转染细胞系提供基础保障的同时,也为今后建立其他转染细胞模型的受体细胞的选择提供参考。
[1] Brandsch M, Knutter I, Bosse-Doenecke E. Pharmaceutical and pharmacological importance of peptide transporters[J].JPharmPharmacol, 2008,60(5): 543-85.
[2] Fei Y J, Sugawara M, Liu J C, et al. cDNA structure, genomic organization, and promoter analysis of the mouse intestinal peptide transporter PEPT1[J].BiochimBiophysActa, 2000, 1492(1):145-54.
[3] Guo X, Meng Q, Liu Q, et al. Construction, identification and application of HeLa cells stably transfected with human PEPT1 and PEPT2[J].Peptides, 2012, 34(2): 395-403.
[4] Huo X K, Liu Q, Wang C Y, et al. Inhibitory effect of valsartan on the intestinal absorption and renal excretion of bestatin in rats[J].JPharmSci, 2014,103(2):719-29.
[5] Herrera-Ruiz D, Faria T N, Bhardwaj R K, et al. A novel hPepTl stably transfected cell line; Establishing a correlation between expression and function[J].MolPharm, 2004,1(2): 136-44.
[6] Omkvist D H, Brodin B, Nielsen C U. Ibuprofen is a non-competitive inhibitor of the peptide transporter hPEPTl (SLC15A1): possible interactions between hPEPTI substrates and Ibuprofen[J].BrJPharmacol, 2010, 161(8): 1793-805.
[7] 吴佳俊, 江宇峰, 伍 超, 等. Smad3 WT、Smad3 EPSM、Smad3 3S-A 3种质粒稳转HepG2细胞株的建立与功能研究[J].中国药理学通报, 2016, 32(6):825-31.
[7] Wu J J, Jiang Y F, Wu C, et al. Construction and functional study of three plasmids including Smad3 WT, Smad3 EPSM and Smad3 3S-A stably transfected HepG2 cell lines[J].ChinPharmacolBull, 2016, 32(6): 825-31.
[8] Nduati V, Yan Y, Dalmasso G, et al. Leptin transcriptionally enhances peptide transporter (hPepT1) expression and activity via the cAMP-response element-binding protein and Cdx2 transcription factors [J].JBiolChem, 2007, 282(2): 1359-73.
[9] Yan Z T, Sun J, Chang Y N, et al. Bifunctional peptidomimetic prodrugs of didanosine for improved intestinal permeability and enhanced acidic stability: synthesis, transepithelial transport, chemical stability and pharmacokinetics[J].MolPharm, 2011, 8(2): 319-29.
[10]Balimane P V, Chong S, Patel K, et al. Peptide transporter substrate identification during permeability screening in drug discovery: comparison of transfected MDCK-hPepTl cells to Caco-2 cells[J].ArchPharmRes, 2007, 30(4): 507-18.
[11]Bhardwaj R K, Herrera-Ruiz D, Sinko P, et al. Delineation of human peptide transporter 1 (hPepT1)-mediated uptake and transport of substrates with varying transporter affinities utilizing stably transfected hPepT 1/Madin-Darby canine kidney clones and caco-2 cells[J].JPharmacolExpTher, 2005, 314(3): 1093-100.
[12]Michael B Mathews, Nahum Sonenberg, John W B Hershey. Translational control in biology and medicine[M]. New York: Cold Spring Harbor Laboratory Press, 2007.
[13]Kuteykin-Teplyakov K, Luna-Tortós C, Ambroziak K, et al. Differences in the expression of endogenous efflux transporters in versus wildtype cell lines affect P-glycoprotein mediated drug transport[J].BrJPharmacol, 2010, 160(6): 1453-63.
Comparison of hPepT1 transfected MDCK cells to hPepT1 transfected HeLa cells
LUO Min1,3,4,FU Xiao-zhong1,3,XIAO Tao1,3,ZHANG Wen-zheng1,3,LI Jing1,3,CHEN Ya1,3,4,LIU Ting1,2
[1.SchoolofPharmacy, 2.GuizhouProvincialKeyLaboratoryofPharmaceutics, 3.EngineeringResearchCenterfortheDevelopmentandApplicationofEthnicMedicineandTCM(MinistryofEducation),GuizhouMedicalUniversity,Guiyang550004,China; 4.NationalEngineeringResearchCenterofMiao’sMedicines,Guiyang550004,China]
Aim To screen a more suitable transfection receptor, and improve the efficiency of constructing cell lines highly expressing human peptide transporters 1 (hPepT1). Methods The recombinant plasmid pcDNA3.1(+)-hPepT1 was transfected into MDCK cells and HeLa cells by LipofectamineTM2000 transfection reagent,respectively. The monoclonal cells were selected and cultured. Expression of hPepT1 mRNA and protein were determined by qRT-PCR and Western blot, respectively. The uptake capacity of Glysar in transfected cells was examined. Results Compared with wild type cells, the expression of hPepT1 and the uptake of Glysar in transfected MDCK cells and HeLa cells significantly increased (P<0.05). Although the uptake of Glysar in HeLa cells was higher than that of MDCK cells, on the contrary, the expression of hPepT1 and the uptake of Glysar in MDCK-hPepT1 cells was higher than that of HeLa-hPepT1 cells. Conclusion MDCK cells may serve as a more suitable transfected receptor for the construction of a cellular model with high expression of hPepT1, which would make the construction of a cell model highly expressing hPepT1 more efficient.
MDCK cells; HeLa cells; human peptide transporter 1; stable transfection; real time fluorescent quantitative RT-PCR; Western blot; Glysar uptake
时间:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.050.html
2016-10-22,
2016-11-20
国家自然科学基金资助项目(No 81260473,81460523 );贵州省优秀青年科技人才培养对象专项基金(2013-45号) ;贵州省社会发展攻关计划项目(2013-3031号);贵州省科学技术基金计划(黔科合基础[2016]1127);贵州省高等学校创新团队靶向药物研究与开发创新团队(黔教合人才团队字[2015]57)
罗 敏(1991-),女,硕士生,研究方向:药物化学及药理学,E-mail: 1532833403@qq.com; 傅晓钟(1972-),男,博士,教授,硕士生导师,研究方向:药物化学,通讯作者,Tel:0851-6908568,E-mail:xiaozhong_fu@sina.com; 刘 亭(1981-),男,博士,副教授,硕士生导师,研究方向:中药药理学,通讯作者,E-mail: 1586740@qq.com
10.3969/j.issn.1001-1978.2017.02.025
A
1001-1978(2017)02-0280-05
R322.61;R329.24;R341;R394.2;R737.33;R977.6
