阿司匹林诱导EB病毒转化的人B淋巴细胞凋亡
2017-02-27陶玉芬李昕潼刘建生杨昭庆刘红旗
陶玉芬, 刘 波, 李 超, 李昕潼, 刘建生, 杨昭庆,刘红旗
(中国医学科学院北京协和医学院医学生物学研究所,云南 昆明 650118)
阿司匹林诱导EB病毒转化的人B淋巴细胞凋亡
陶玉芬, 刘 波, 李 超, 李昕潼, 刘建生, 杨昭庆,刘红旗
(中国医学科学院北京协和医学院医学生物学研究所,云南 昆明 650118)
目的 探讨阿司匹林诱导EB病毒转化的人B淋巴细胞凋亡及其机制。方法 EB病毒转化的人B淋巴细胞经一定浓度的阿司匹林处理后,首先通过MTT法分析细胞的增殖情况;然后用光学显微镜和电子显微镜、PI染色和流式细胞术分析以及琼脂糖凝胶电泳等方法对细胞凋亡进行评价;最后,通过免疫印记法检测凋亡相关蛋白、mTOR信号通路和PU.1-Bim信号通路蛋白表达情况。结果 阿司匹林能抑制EB病毒转化的人B淋巴细胞增殖。形态学和超微结构观察发现,阿司匹林处理的细胞固缩变小、数目减少、细胞核畸形、染色质边缘化和细胞质空泡化。阿司匹林处理导致细胞膜通透性增加、细胞存活率明显下降和细胞DNA的弥散现象。免疫印迹分析显示,阿司匹林处理抑制了细胞的mTOR信号和转录因子PU.1的表达水平,激活了细胞凋亡相关蛋白caspase-3、PARP和Bim。结论 阿司匹林可能通过抑制EB病毒转化的人B淋巴细胞增殖和诱导细胞凋亡表现一定的抗淋巴瘤效应,mTOR信号途径和PU.1-Bim轴可能参与了阿司匹林抗肿瘤作用机制。
阿司匹林;EB病毒转化的人B淋巴细胞; 凋亡;mTOR; PU.1-Bim轴;抗肿瘤
Epstein-Barr病毒(EB病毒)是一种γ亚科疱疹病毒,其感染可能导致人类多种恶性疾病,尤其是上皮和淋巴起源的肿瘤,如Burkitt淋巴瘤、霍奇金病、鼻咽癌等[1]。EB病毒对人B细胞具有亲嗜性。一般认为,EB病毒在体外可以感染静息人B淋巴细胞,使其发生转化,形成永生化淋巴细胞株(LCL)。EB病毒转化人B淋巴细胞,其方法成熟、简单、可行性强,且实验材料易得,为生物医学研究提供了无限的宝贵资源[2]。EB病毒转化的B淋巴细胞,一方面具有B淋巴细胞特性,可用于免疫学方面的研究;另一方面又具有肿瘤细胞的某些特点,可作为肿瘤治疗的药物筛选模型及机制研究等。
阿司匹林(aspirin)又名乙酰水杨酸(acetylsalicylic acid,ASA),是非甾体类抗炎药的成员之一。阿司匹林自诞生之初,因其比较廉价且容易获得,应用已达百余年,是目前在临床上应用得最为成功和最为广泛的化学合成药物之一。从最初的解热、镇痛和抗炎,到心血管疾病的预防和治疗,以及近年来发现的抗肿瘤作用,阿司匹林均显示了广阔的应用前景。阿司匹林的抗肿瘤作用越来越受到医生和科学家们的关注。流行病学和临床应用研究发现,阿司匹林的使用与某些肿瘤的发生率下降[3]、病人生存时间的延长可能有很大的相关性,阿司匹林可能作为肿瘤治疗的一种辅助治疗。目前,阿司匹林抗肿瘤的可能机制主要涉及3条途径:血小板途径、环氧酶依赖途径和环氧酶非依赖途径[4]。然而,参与阿司匹林抗肿瘤的信号途径和分子机制还不是很清楚。
本研究首次利用EBV转化的人B淋巴细胞作为研究对象,探索阿司匹林的抗肿瘤机制。结果表明,阿司匹林通过抑制EBV转化的人B淋巴细胞的增殖和诱导该细胞凋亡表现其抗肿瘤作用。mTOR信号和PU.1-Bim轴可能参与阿司匹林诱导EBV转化的人B淋巴细胞的凋亡。这些发现为阿司匹林的临床应用提供了一定的理论参考。
1 材料与仪器
1.1 药物与试剂 EB病毒转化的人B淋巴细胞来自中国不同民族永生化细胞库(中国医学科学院医学生物学研究所医学遗传室)。阿司匹林购自Cayman Chemical公司;MTT购自Sigma公司;RPMI 1640培养基购自Cellgro公司;胎牛血清、谷氨酰胺和双抗购自Bioind公司;PI购自Invitrogen公司;抗体S6购自Santa Cruz公司;抗体caspase-3、β-actin、pS6、PU.1、Bim、二抗Anti-rabbit IgG和Anti-mouse IgG均购自Cell Signaling Technology公司;BCA蛋白定量分析试剂盒购自Thermo公司;ECL免疫印迹底物(PierceTMECL Plus Western Blotting Substrate)购自Thermo公司。
1.2 仪器 Tecan infinite M200 pro酶标仪(型号1208007652)购自Tecan公司;高速冷冻离心机(型号5430R)购自德国Eppendorf公司;凝胶成像系统(型号1702820)购自BIORAD公司;Mini-PROTEAN®Tetra电泳槽(型号165-8004)购自BIORAD公司;细胞离心涂片机(型号Shandon Cytospin 4)购自Thermo公司;制冰机(型号SIM-F140AY65)购自SANYO公司;XCell IITM Bolt Module 蛋白印迹系统(型号EI9014)购自Invitrogen公司;BD Biosciences FACS Calibur流式细胞仪购自BD公司。
2 方法
2.1 细胞培养和溶液配制 EB病毒转化的人B淋巴细胞的培养基为RPMI 1640培养液(含10%胎牛血清、1%链霉素、1%青霉素和1%谷胺酰胺)。细胞在 37℃和5% CO2培养箱中培养。阿司匹林用无水乙醇配制成400 mmol·L-1的储存液,-20℃保存备用。
2.2 MTT法检测细胞增殖 细胞经阿司匹林处理后,取100 μL细胞悬液于96孔板中,每个样品设3个复孔。每孔加入10 μL MTT吹打均匀,于37℃、5% CO2细胞培养箱中培养3 h后,每孔再加入110 μL盐酸异丙醇,充分吹打溶解沉淀,于37℃恒温箱培养45 min。用酶标仪于波长570 nm测定OD值。OD 值越高说明生成的沉淀越多,细胞增殖越强。
2.3 细胞形态学观察 细胞经阿司匹林处理48 h后,取200 μL细胞悬液放入细胞离心涂片机的细胞漏斗中,于800 ×g转速离心5 min后,置倒置光学显微镜下进行细胞形态学观察。
2.4 细胞超微结构观察 细胞经阿司匹林处理48 h后,将细胞悬液转入15 mL离心管中,于4℃、710×g离心5 min。弃上清,细胞沉淀经过固定、脱水、包埋和切片处理后,置透射电子显微镜观察。
2.5 碘化丙啶(propidium iodide,PI)染色和流式细胞术分析细胞存活率 细胞经阿司匹林处理后,分别在0、24、48、72 h取500 μL细胞悬液入流式管中,加入1 μL PI染料轻轻混匀,用流式细胞仪进行检测。每个样品收集3次数据,每次收集细胞数目为20 000个。取3次结果的平均数进行分析。
2.6 检测细胞凋亡DNA变化 细胞经阿司匹林处理24 h后,离心收集细胞(4℃、710×g离心5 min)。加入500~600 μL裂解缓冲液吹打悬浮细胞,加入RNase A (终浓度为100 g·L-1),于37℃孵育1 h,去除RNA。然后依次加入等体积量的苯酚、三氯甲烷和异戊醇(25 ∶24 ∶1)、三氯甲烷和异戊醇(24 ∶1)进行抽提和去除蛋白质。加入5.0 mol·L-1NaCl(终浓度为300 mmol·L-1)和2.5倍体积的100%乙醇后,于-20℃过夜沉淀DNA。次日,12 000×g离心30 min,用70%乙醇除去多余的盐。纯化的DNA用2%琼脂糖凝胶电泳进行检测。
2.7 免疫印迹法检测蛋白表达 细胞经阿司匹林处理24 h后,收集于15 mL离心管中,于4℃、710×g离心5 min,弃上清;用1 mL预冷的1×PBS重新悬浮细胞,并转移至1.5 mL微量离心管中,于4℃、2 000×g离心3 min,弃上清;加入50~70 μL RIPA蛋白裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),于冰浴上进行30 min细胞裂解。用超声粉碎机于10%功率超声15 s。再于4℃、12 000×g离心10 min,将上清蛋白裂解液转移至新的1.5 mL管。通过BCA法测定蛋白浓度,根据所测各组样品的蛋白浓度,用RIPA蛋白裂解液将蛋白样品稀释成统一浓度(5 g·L-1),加入6×loading buffer(含β-巯基乙醇,V/V5‰)混合均匀,振荡并瞬时离心。100℃煮沸5 min后用于实验或-80℃保存备用。各样品取等量的蛋白经12%的SDS-PAGE胶电泳分离后,于45 V转膜1 h或7 V转膜过夜。膜经封闭后,加一抗(1 ∶1 000)于4°C过夜孵育。加二抗(1 ∶5 000)后于常温孵育2.5 h。ECL显色后,通过Biorad Image Lab照相和分析结果。
2.8 统计学处理 本实验获得的数据利用GraphPad Prism 6软件进行作图和统计学分析(t检验,paired test和two-tailed)。流式细胞分析结果用Flowing software 2进行分析。
3 结果
3.1 阿司匹林抑制EB病毒转化的人B淋巴细胞增殖 为了探索阿司匹林处理对EB病毒转化的人B淋巴细胞的影响,首先通过MTT法分析了阿司匹林处理后该细胞的增殖情况。结果表明,2.5、5.0 mmol·L-1的阿司匹林处理EB病毒转化的人B淋巴细胞后,能明显抑制该细胞的增殖。与2.5 mmol·L-1相比,5.0 mmol·L-1的阿司匹林可能还能杀死细胞,使细胞增殖下降至基线水平之下(Fig 1)。
3.2 阿司匹林诱导EB病毒转化的人B淋巴细胞凋亡 为评价阿司匹林处理诱导EB病毒转化的人B淋巴细胞凋亡效应,我们首先通过普通光学显微镜观察阿司匹林处理后细胞形态的变化。结果发现,阿司匹林处理导致细胞的数目减少,细胞形态呈现皱缩、固化和变小(Fig 2A)。电子显微镜下发现,阿司匹林处理还导致细胞超微结构的改变,包括细胞核形态的变化、染色质浓缩和细胞质空泡化等现象(Fig 2B)。进一步的PI染色和流式细胞分析结果表明,阿司匹林处理也导致EB病毒转化人B淋巴细胞的细胞膜通透性增加,细胞存活率降低(Fig 2C)。接下来,我们又通过免疫印迹法分析了阿司匹林处理后细胞凋亡相关蛋白的表达水平。结果表明,阿司匹林处理激活了EB病毒转化的人B淋巴细胞的天冬氨酸蛋白水解酶caspase-3和DNA修复酶PARP(Fig 2D)。最后,2%琼脂糖凝胶电泳分析细胞DNA结果表明,5.0 mmol·L-1阿司匹林处理24 h后,能引起细胞DNA明显的弥散现象(Fig 2E)。

Fig 1 Aspirin treatment inhibited proliferation of EBV-transformed human B lymphocytes
*P<0.05,**P<0.01vsethanol group;##P<0.01vs2.5 mmol·L-1ASA group
3.3 阿司匹林处理对细胞mTOR信号和PU.1-Bim轴的影响 为了进一步探讨阿司匹林处理诱导细胞凋亡的可能机制,我们通过免疫印迹法首先分析了阿司匹林对细胞mTOR信号的影响。结果发现,2.5、5.0 mmol·L-1阿司匹林处理EB病毒转化的人B淋巴细胞,均能抑制细胞S6K1和S6蛋白磷酸化水平(T389和pS6)(Fig 3A),这提示阿司匹林处理抑制了细胞的mTOR信号。此外,免疫印迹结果还显示,阿司匹林处理抑制造血系统转录因子PU.1的蛋白表达水平,诱导促凋亡蛋白Bim的表达(Fig 3B),这提示PU.1-Bim轴可能与阿司匹林诱导EB病毒转化的人B淋巴细胞的凋亡相关。
3.4 Rapamycin和阿司匹林联合用药对EBV转化人B淋巴细胞的协同效应 前面的结果已表明,mTOR可能参与阿司匹林诱导EBV转化人B淋巴细胞凋亡。这促使我们提出了一个假说:联合mTOR抑制剂和阿司匹林是否可以产生协同作用?为了验证这一假说,我们用不同浓度的mTOR抑制剂Rapamycin和不同浓度的阿司匹林联合处理EBV转化人B淋巴细胞24 h后,通过MTT法分析药物处理对细胞增殖的影响。结果表明,如果联合用药处理,2.5 mmol·L-1阿司匹林和2.5 μmol·L-1的Rapamycin就能产生比单独应用10 μmol·L-1的Rapamycin还强的细胞增殖抑制作用(Fig 4)。这一研究结果也进一步表明,mTOR信号途径可能参与阿司匹林诱导EBV转化的人B淋巴细胞的增殖抑制作用。
4 讨论
EB病毒转化的人B淋巴细胞不仅能作为人类遗传资源的一种保存方法[5],它还是研究细胞凋亡和抗肿瘤药物很好的细胞模型[6]。本研究利用EB病毒转化的人B淋巴细胞所建立的细胞系,首次探讨阿司匹林抗肿瘤的分子机制。结果表明,阿司匹林通过抑制EB病毒转化的人B淋巴细胞的增殖和诱导该细胞凋亡表现其抗肿瘤作用,mTOR信号和PU.1-Bim轴可能参与阿司匹林诱导EB病毒转化的人B淋巴细胞凋亡。联合mTOR信号抑制剂和阿司匹林处理EB病毒转化的人B淋巴细胞可以产生一定的协同效应,有望降低药物的毒副作用。
阿司匹林的临床药理作用通常认为是镇痛、解热、抗炎以及抗血栓等,认为主要是通过抑制COX-2酶活性和影响血小板的形成等机制。近来,大量的流行病学和临床研究表明,阿司匹林的使用能降低肿瘤发生的风险性,对肿瘤的发生有一定的预防作用[7-8]。另外,阿司匹林在肿瘤治疗方面还起一定的佐剂效应,能改善病程[9]。由于阿司匹林还没有被批准作为临床抗肿瘤药物,因此这些报道中阿司匹林的使用剂量都是按照抗心血管疾病的用量。体外抗肿瘤作用研究表明,阿司匹林对肺腺癌SPCA-1 细胞有较强的抑制作用, 表现为SPCA-1细胞的G0/G1期和G2/M期比例明显升高, S期比例下降以及凋亡细胞增多[10]。本研究结果表明,5.0 mmol·L-1阿司匹林就能明显抑制EB病毒转化的B淋巴细胞增殖和诱导细胞凋亡。不同的细胞对阿司匹林处理的敏感性不一样,对于神经内分泌细胞,5.0 mmol·L-1阿司匹林处理72 h后才表现明显的抑制作用[11]。然而,对于人胶质瘤细胞,8.0 mmol·L-1的阿司匹林才抑制细胞的增殖和诱导细胞凋亡[12]。本研究中的阿司匹林作用动态结果表明,5.0 mmol·L-1的阿司匹林处理EB病毒转化的人B淋巴细胞后24 h就出现明显的抑制效应。

Fig 2 Aspirin treatment induced apoptosis in EBV-transformed human B lymphocytes
A: The morphology of aspirin-treated EBV-transformed human B lymphocytes. Figures in each column randomly created from three different fields;B: Ultramicroscopic structure of human B lymphocytes treated by aspirin. Figures in each row randomly created from three different fields;C:Viability of aspirin-treated EBV-transformed B lymphocytes by flow cytometric analysis; D: Expression of apoptosis-associated proteins in aspirin-treated EBV-transformed human B lymphocytes; E: Detection of DNA smear via agarose electrophoresis.△△P<0.01vsNon group;**P<0.01vsethanol group;##P<0.01vs2.5 mmol·L-1ASA group
本研究选用EB病毒转化的人B淋巴细胞作为细胞模型的意义在于:首先,该细胞可以作为造血系统异常相关的淋巴瘤模型,而PU.1是一个起多重作用的造血系统转录因子[13],它可以通过结合到促凋亡蛋白Bim的启动子上,调节该蛋白的表达,从而调控细胞的生长[14];其次,EB病毒感染通过改变细胞的多个信号通路,促进细胞生长和永生化,如EBV感染抑制了促凋亡蛋白Bim的表达[15],从而使细胞具有抗凋亡作用而永生化成为细胞系;EBV的LMP2A蛋白通过激活mTOR信号调节鼻咽癌细胞的生长[16]。因此,本文就选用mTOR信号通路和PU.1-Bim作为阿司匹林抗肿瘤的研究靶点。阿司匹林处理抑制了细胞蛋白S6K1和S6的磷酸化水平,这显示阿司匹林能抑制EBV转化的人B淋巴细胞的mTOR信号途径,可能与细胞凋亡有关。同时本研究也揭示,阿司匹林处理能降低PU.1的蛋白表达水平,诱导促凋亡蛋白Bim的表达,提示PU.1-Bim轴可能参与阿司匹林诱导的细胞凋亡过程。据我们所知,本研究是首次发现阿司匹林处理抑制EB病毒转化的人B淋巴细胞的mTOR信号和转录因子PU.1的表达,并促进促凋亡蛋白Bim激活,从而诱导EB病毒转化的人B淋巴细胞凋亡。然而,PU.1-Bim轴对于阿司匹林诱导EB病毒转化的人B淋巴细胞凋亡是否是必需的,还有待进一步研究。
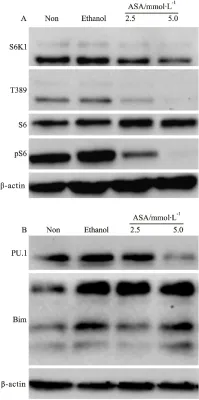
Fig 3 mTOR signal pathway and PU.1-Bim axis in EBV-transformed human B lymphocytes treated by aspirin Western blot was used to evaluate expression levels of proteins in mTOR signaling pathway(A) and PU.1-Bim axis(B) in aspirin-treated EBV-transformed human B lymphocytes.

Fig 4 Effects of combination of aspirin and rapamycin on proliferation of EBV-transformed human B cells
*P<0.05,**P<0.01vs2.5 mmol·L-1ASA+2.5 μmol·L-1rapamycin group
(致谢:本研究所有实验均在中国医学科学院医学生物学研究所感染与免疫研究室完成,感谢科室所有老师和同学的帮助和支持!)
[1] Ali A S,Al-Shraim M, Al-Hakami A M, et al. Epstein-Barr virus: clinical and epidemiological revisits and genetic basis of oncogenesis[J].OpenVirolJ, 2015, 9: 7-28.
[2] Hui-Yuen J, McAllister S, Koganti S, et al. Establishment of Epstein-Barr virus growth-transformed lymphoblastoid cell lines[J].JVisExp, 2011,(57)pii:3321.
[3] Thun M J, Jacobs E J, Patrono C. The role of aspirin in cancer prevention[J].NatRevClinOncol, 2012,9(5):259-67.
[4] Usman M W, Luo F, Cheng H, et al. Chemopreventive effects of aspirin at a glance[J].BiochimBiophysActa, 2015,1855(2):254-63.
[5] Suderman M, Pappas J J, Borghol N, et al. Lymphoblastoid cell lines reveal associations of adult DNA methylation with childhood and current adversity that are distinct from whole blood associations[J].IntJEpidemiol, 2015,44(4):1331-40.
[6] Katano H, Pesnicak L, Cohen J I. Simvastatin induces apoptosis of Epstein-Barr virus (EBV)-transformed lymphoblastoid cell lines and delays development of EBV lymphomas[J].ProcNatlAcadSciUSA, 2004,101(14):4960-5.
[7] Cuzick J, Otto F, Baron J A, et al. Aspirin and non-steroidal anti-inflammatory drugs for cancer prevention: an international consensus statement[J].LancetOncol, 2009,10(5):501-7.
[8] Langley R E, Burdett S, Tierney J F, et al. Aspirin and cancer: has aspirin been overlooked as an adjuvant therapy[J]?BrJCancer, 2011,105(8):1107-13.
[9] Chan A T, Ogino S, Fuchs C S. Aspirin use and survival after diagnosis of colorectal cancer[J].Jama, 2009,302(6):649-58.
[10]朱慧明,吴 铁,崔 燎.阿司匹林诱导人肺腺癌细胞株SPCA-1 凋亡研究.[J].中国药理学通报,2004,20(6):640-3.
[10]Zhu H M, Wu T, Cui L.Study of aspirin on proliferation and apoptosis of human lung adenocarcinoma cell lines SPCA-1invivo[J].ChinPharmacolBull,2004,20(6):640-3.
[11]Spampatti M, Vlotides G, Spottl G, et al. Aspirin inhibits cell viability and mTOR downstream signaling in gastroenteropancreatic and bronchopulmonary neuroendocrine tumor cells[J].WorldJGastroenterol, 2014,20(29):10038-49.
[12]吴伟伦, 梁中琴.阿司匹林体外抑制U251细胞增殖及其机制研究[J].中国药理学通报,2009,25(6):805-8.
[12]Wu W L,Liang Z Q.A study of the mechanism and inhibitory effect of aspirin on U251 cellsinvitro[J].ChinPharmacolBull,2009,25(6):805-8.
[13]Back J, Allman D, Chan S, Kastner P. Visualizing PU.1 activity during hematopoiesis[J].ExpHematol,2005,33:395-402.
[14]Ridinger-Saison M, Evanno E, Gallais I, et al. Epigenetic silencing of Bim transcription by Spi-1/PU.1 promotes apoptosis resistance in leukaemia[J].CellDeathDiffer, 2013,20(9):1268-78.
[15]Clybouw C, McHichi B, Mouhamad S, et al. EBV infection of human B lymphocytes leads to down-regulation of Bim expression: relationship to resistance to apoptosis[J].JImmunol, 2005,175(5):2968-73.
[16]Moody C A, Scott R S, Amirghahari N, et al. Modulation of the cell growth regulator mTOR by Epstein-Barr virus-encoded LMP2A[J].JVirol, 2005,79(9):5499-506.
Mechanisms of aspirin-induced apoptosis in EBV-transformed human B lymphocytes
TAO Yu-fen, LIU Bo, LI Chao, LI Xin-tong, LIU Jian-sheng, YANG Zhao-qing, LIU Hong-qi
(InstituteofMedicalBiology,ChineseAcademyofMedicalScience&PekingUnionMedicalCollege,Kunming650118,China)
Aim To investigate the effects of aspirin on Epstein-Barr virus(EBV)-transformed human B-lymphocytes. Methods EBV-transformed human B-lymphocytes were treated with certain concentrations of aspirin. Cellular proliferation was analyzed by MTT assay. Further evaluation of apoptosis of aspirin-treated cells was performed through light-field microscope, transmission electronic microscope(TEM), propidium iodide(PI) staining and flow cytometric analysis and DNA electrophoresis. Finally, immunoblot analysis was used to determine the expression levels of apoptosis-associated proteins, proteins involved in mTOR pathway and PU.1-Bim axis.Results Aspirin treatment inhibited proliferation of EBV-transformed human B-lymphocytes. We observed that aspirin treatment induced apoptosis in EBV-transformed human B-lymphocytes, resulting in the decreased number and size of cells. Ultramicroscopic structural analysis via TEM indicated that aspirin treatment deformed the cellular nucleus, and led to peripheral chromatin and cytoplasmic vacuole. PI staining and flow cytometric analysis indicated that aspirin increased the permeability of cell membrane and decreased the viability of treated cells. Agarose electrophoresis revealed DNA smear in aspirin-treated cells. Mechanistically, mTOR signaling was inhibited in aspirin-treated cells, as evidenced by the decreased phosphorylation of S6K1 and S6 via immunoblot analysis. Aspirin treatment led to the decrease of hematopoietic transcription factor PU.1.Consequently, pro-apoptotic Bim, apoptosis-associated proteins caspase-3 and PARP were activated in aspirin-treated cells.Conclusion Aspirin may show anti-lymphoma effects via its inhibition of proliferation and induction of apoptosis of EBV-transformed human B-lymphocytes, in which mTOR signal pathway and PU.1-Bim axis may be involved.
aspirin; EBV-transformed human B-lymphocytes; apoptosis; mTOR; PU.1-Bim axis;anti-tumor
时间:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.018.html
2016-11-15,
2016-12-17
国家自然科学基金资助项目(No 81571549);云南省应用基础研究计划项目(No 2013FZ143);云南省重点新产品开发专项项目(No 2016BC004);医学生物学研究所重点项目(No 2014IMB03ZD)
陶玉芬(1974-),女,硕士,研究方向:炎症、感染和免疫学,E-mail:taoyufen@imbcams.com.cn; 刘红旗(1973-),男,博士,副研究员,研究方向:炎症、感染和免疫学,通讯作者,E-mail: lhq@imbcams.com.cn
10.3969/j.issn.1001-1978.2017.02.009
A
1001-1978(2017)02-0185-06
R331.125;R329.25;R373;R979.1
