腹腔注射5-HT2A受体拮抗剂MDL11939对小鼠急性及慢性疼痛的影响
2017-02-27黄思婷姬宁宁章功良张咏梅
黄思婷,姬宁宁,杜 雷,章功良,张咏梅
(1.徐州医学院江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,江苏 徐州 221002;2.安徽医科大学基础医学院,安徽 合肥 230032)
腹腔注射5-HT2A受体拮抗剂MDL11939对小鼠急性及慢性疼痛的影响
黄思婷1,姬宁宁1,杜 雷1,章功良2,张咏梅1
(1.徐州医学院江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,江苏 徐州 221002;2.安徽医科大学基础医学院,安徽 合肥 230032)
目的 探讨5-羟色胺(5-hydroxytryptamine,5-HT)2A受体拮抗剂MDL11939在急性乙酸内脏痛、急性切口痛和坐骨神经慢性缩窄性损伤(chronic constrictive injury,CCI)模型中发挥的作用及意义。方法 选用♂昆明小鼠,建立急性乙酸内脏痛、急性切口痛和CCI神经病理性痛模型,通过腹腔注射给药,观察乙酸致小鼠扭体反应次数变化、切口痛和CCI痛患侧热缩足反射潜伏期(thermal withdrawal latency,TWL)变化。结果 在小鼠急性乙酸内脏痛模型中,与溶剂对照组相比,MDL11939(0.25、0.5、1.0 mg·kg-1,i.p.)呈剂量依赖性地减轻乙酸内脏痛,扭体反应次数明显减少。在急性切口痛和CCI模型中,与模型组和自身给药前相比,MDL11939(0.5 mg·kg-1,i.p.)可以明显提高小鼠患侧的热缩足阈值,减轻疼痛。结论 MDL11939通过腹腔系统性给药可以有效地减轻急性乙酸内脏痛、急性切口痛和CCI慢性神经病理性痛。
5-HT2A受体;MDL11939;内脏痛;坐骨神经痛;切口痛;CCI
疼痛作为人类生活中最为常见的身心体验,在2000年被世界卫生组织定义为一类疾病。正常情况下,疼痛可以作为一种保护性机制使机体免于伤害,但在病理状态下又可对人体造成无法估量的损害。疼痛的发病率较高,尤其是病理性疼痛,仍是当今困扰人类健康的一大难题。
5-羟色胺(5-hydroxytryptamine,5-HT)作为一种自体活性物质,在肠嗜铬细胞中的百分比约为0.90,在血小板中的百分比约为0.08~0.10,在外周作为炎症调节因子与IL-6、TNF-α、缓激肽、前列腺素E2、组胺、去甲肾上腺素等共同发挥作用[1]。作为一种单胺类神经递质,5-HT以约0.01~0.02的百分比存在于中枢神经系统,尤其是中脑缝际核群,参与了体温、睡眠、昼夜节律、运动、情绪等一系列病理生理活动[2]。
5-HT必须通过相应受体的介导才能产生作用[3]。根据对特异性激动剂和拮抗剂选择性的不同,可将5-HT受体(receptor,R)分为7类,目前认为与疼痛关系密切的受体主要有5-HT1R、5-HT2R、5-HT3R、5-HT4R、5-HT7R,其中5-HT2R又包括 5-HT2AR、5-HT2BR、5-HT2CR 3种亚型。以往研究发现,5-HT2AR广泛参与了精神类疾病的发生发展,包括焦虑、抑郁、精神分裂症、药物成瘾等,也在记忆、认知方面发挥了重要的作用[4]。在疼痛模型如完全弗氏佐剂模型、角叉菜胶模型、坐骨神经慢性结扎模型中,5-HT2AR均参与了疼痛调控[3],但其在各类疼痛模型中致痛或抑痛的复杂作用至今尚未明了,有待进一步探究。
本实验针对急性乙酸内脏痛、急性切口痛和坐骨神经慢性缩窄性损伤(chronic constrictive injury,CCI)慢性神经病理性痛,通过腹腔注射给药,探索5-HT2AR在外周被特异性抑制剂MDL11939阻断时的疼痛行为学变化,为深入研究5-HT2AR在疼痛中的作用提供实验依据。
1 材料与方法
1.1 实验动物 昆明种♂小鼠72只,体质量(28~32) g,由山东济宁市任城区鲁康动物饲料经销中心提供[许可证号:SCXK(鲁)20140007]。小鼠置于昼夜(12 h/12 h)节律光照条件下,自由进食饮水,室温(23±1)℃,所有小鼠实验前静养1周。
1.2 实验分组 内脏痛模型鼠随机分为5组,每组7只。Vehicle组:0.9% NS+1% DMSO;MDL11939+Vehicle组:MDL11939(1.0 mg·kg-1)+0.9% NS;乙酸模型组:1% DMSO+0.6%乙酸(10 mL·kg-1);MDL11939低、中、高剂量组:MDL11939(0.25、0.5、1.0 mg·kg-1)+0.6%乙酸(10 mL·kg-1)。切口痛模型鼠随机分为2组,每组10只。切口痛组:小鼠进行右足底切口痛手术;MDL11939 给药组:小鼠手术后指定时间内测得基础痛阈,然后给予MDL11939(0.5 mg·kg-1),15 min后记录1 h的热缩足反射潜伏期(thermal withdrawal latency,TWL)评分。CCI模型鼠随机分为2组,每组8只。均进行CCI手术处理,术后d 3筛选造模成功的小鼠,于d 7上午8 ∶00开始进行痛阈检测。CCI组:检测小鼠基础痛阈及其后1 h内的TWL评分;MDL11939给药组:小鼠首先测得基础痛阈,然后给予MDL11939(0.5 mg·kg-1),15 min后记录1 h内的TWL评分。以上各组动物平均体质量无统计学差异,给药方式均为腹腔给药,给药体积均为0.1 mL·kg-1。
1.3 仪器与药品 热辐射刺激仪购自美国IITC 公司(IITCseries8);MDL11939购自Tocris公司(Cat. No.0870);DMSO购自Biosharp公司。
1.4 动物模型
1.4.1 小鼠急性乙酸内脏痛模型制备 小鼠腹腔注射0.6%乙酸,10 mL·kg-1,建立急性内脏痛模型[5]。造模成功的表现为小鼠出现腹部内凹、躯干与后肢伸张、臀部高起等动作。
1.4.2 小鼠急性切口痛模型制备 参照Brennan等[6]的方法,小鼠七氟醚吸入麻醉后,碘伏消毒右后爪跖部,用手术刀片从足底近端向足趾方向纵行切开5 mm的条形切口,切开足底皮肤后,用眼科镊提起足底肌肉并进行纵向钝性分离,并保持其起止附着点完整。切口处纱布压迫止血,使用5-0丝线非吸收缝线行褥式缝合。
1.4.3 小鼠CCI模型制备 参照Bennett等[7]的方法建立坐骨神经慢性缩窄性损伤模型。小鼠称重,经腹腔注射10%水合氯醛麻醉后,取侧卧位,备皮,用碘伏消毒皮肤,切开右下肢股部皮肤后,顺肌纹钝性分离股二头肌和臀肌,暴露右侧坐骨神经中上段,于坐骨神经分成3支前的主干部位处,游离神经7 mm左右。用4-0医用铬制肠线间隔1 mm松结扎3处,为了预防强度过大,结扎线的松紧以引起右后肢出现轻微的颤动为宜,从而保护神经外膜的血运。结扎完毕后逐层缝合肌肉层和皮肤。
1.5 小鼠疼痛行为学测定
1.5.1 扭体反应测定 MDL11939给药15 min后给予乙酸,观察乙酸腹腔注射后1 h内小鼠扭体反应次数。扭体反应标准[5]为小鼠出现腹部收缩伴随着身体拉长、后肢伸张等非自主性动作。
1.5.2 热缩足反射潜伏期测定 急性切口痛于术后4 h进行TWL测定。CCI模型于术后d 3通过TWL筛选造模成功的小鼠,在术后d 7再进行TWL测定。统一采用热辐射刺激仪测定小鼠足底TWL。将有机玻璃箱置于3 mm厚的玻璃板上,按Hargreaves等[8]方法用热辐射刺激仪照射小鼠足底,照射开始至小鼠出现抬腿回避时间为TWL。热刺激强度在整个实验过程中维持一致,自动切断时间为25 s,以免造成热辐射损伤,为避免或减少前1次刺激对随后刺激效应造成的影响,同一部位刺激的间隔时间至少为5 min,每只动物测定3次,取平均值作为小鼠TWL值。在具体时间点时只需测定1次。

2 结果
2.1 MDL11939对急性乙酸内脏痛小鼠扭体反应的影响 与Vehicle组相比,小鼠给予乙酸后,出现腹部收缩伴随着身体拉长、后肢伸张等行为,表现为扭体反应明显增加(Fig 1A、1C,P<0.01)。与乙酸模型组相比,给予5-HT2A受体拮抗剂MDL11939之后,0.25、0.5、1.0 mg·kg-1给药组扭体反应的次数降低(Fig 1A、1C,P<0.01),且在剂量上存在相关性,呈负相关(Fig 1B,r=-0.85)。而MDL11939+Vehicle组,小鼠没有发生扭体反应(Fig 1A),说明MDL11939对腹腔注射Vehicle组没有引起任何作用,MDL11939在腹腔注射乙酸后的效应是通过5-HT2A受体介导的。以上结果表明,MDL11939可以剂量依赖性地降低急性乙酸内脏痛小鼠的扭体反应次数,明显缓解疼痛。
2.2 MDL11939对急性切口痛小鼠患侧TWL的影响 鉴于乙酸内脏痛模型MDL11939腹腔给药呈剂量依赖性地抑制疼痛,在高剂量1.0 mg·kg-1时,小鼠活动被明显抑制,0.5 mg·kg-1就可以有效减轻疼痛,故在其他模型中选取中剂量0.5 mg·kg-1进行实验。在切口痛组和自身切口痛造模4 h 后,TWL值降低,痛阈下降。与切口痛组和自身给药前相比,MDL11939在给药后1 h内明显提高了小鼠的热缩足阈值(Fig 2,P<0.05,P<0.01)。以上结果表明MDL11939可以有效地减轻急性切口痛。
2.3 MDL11939对CCI慢性神经病理性痛小鼠患侧TWL的影响 术后d 3筛选出造模成功的小鼠,于d 7进行TWL测定时发现,CCI模型组小鼠的TWL评分相对健侧明显降低,表明痛阈下降。在MDL11939给药后1 h内,小鼠的热缩足阈值明显提高(Fig 3,P<0.05,P<0.01),以上结果表明MDL11939可以有效地缓解CCI神经病理性痛。

Fig 1 Dose response curves of 5-HT2Aantagonist MDL11939 on body writhing reaction of visceral pain induced by intraperitoneal administration of acetic acid in mice
A:The number of 1 h cumulative writhing reaction times; B:The dose correlation curve of MDL11939; C:The effect of different doses of MDL11939 on acetic acid pain in 1 h.**P<0.01vscontrol group;##P<0.01vsacetic acid group
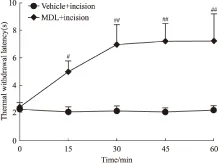
Fig 2 Effects of 5-HT2Aantagonist MDL11939 on ipsilateral TWL of acute incision pain in mice
The time-course of TWL in incision pain mice.#P<0.05,##P<0.01vsincision pain group

Fig 3 Effects of MDL11939 on ipsilateral TWL of CCI chronic neuropathic pain in mice
The time-course of TWL after intraperitoneal administration of 5-HT2Aantagonist MDL 11939 in CCI mice in 1 h.#P<0.05,##P<0.01vsCCI group
3 讨论
5-HT2AR在外周存在于黏膜下神经丛、背根神经节、表皮真皮结合处的无髓鞘轴突等部位,高表达于初级感觉神经元,在中枢表达于脊髓、大脑皮质、杏仁核、海马、室旁核等众多脑区,参与了外周伤害性感受的外周敏化和中枢敏化过程[9]。
疼痛作为一种常见的伤害性感受,5-HT2AR在疼痛领域中的作用也受到越来越多的关注。本实验通过建立急性乙酸内脏痛、急性切口痛和CCI神经病理性痛模型,经腹腔系统性给药,发现MDL11939可以有效地减轻乙酸内脏痛小鼠扭体反应次数,提高切口痛和CCI痛小鼠患侧的TWL阈值。以往研究发现,在坐骨神经CCI模型中,5-HT在损伤侧神经表达增多,在脊髓表达降低[10];鞘内注射5-HT2A/2C受体激动剂α甲基5-HT可以剂量依赖性地抑制热敏痛,这种作用可被预先鞘内注射5-HT2AR的拮抗剂Ketanserin逆转[11];在脊神经结扎(SNL)模型中,5-HT2AR介导了神经损伤引起的痛觉超敏和神经病理性痛[12]。以上结果表明,在神经损伤病理性痛模型中,5-HT及5-HT2AR在外周和脊髓的表达可能存在差异。脊髓5-HT2AR能够降低慢性内脏痛大鼠的痛觉敏化[13],而本实验中5-HT2AR介导了急性乙酸内脏痛小鼠扭体反应的增加。切口痛模型中,5-HT2AR提高了切口痛患侧的疼痛下行易化作用,鞘内注射Ketanserin可以减轻疼痛[14],本实验中通过外周给予MDL11939也减轻了疼痛。一般认为,外周伤害性刺激发生时,肠嗜铬细胞释放5-HT,一方面直接激活肠神经系统,另一方面通过初级感受神经元向脊髓中枢传递,在脑内整合,通过脑干下行易化或抑制系统,对脊髓背角5-HT不同的受体亚型进行调控发挥作用。而大量实验研究表明5-HT2AR参与了其中各个环节的调控,腹腔系统性给药,可能是通过减少外周炎性介质降低了外周敏化[1],也可能是影响了血液循环中炎症介质通过5-HT2AR介导的中枢敏化[15],但具体的机制仍需要进一步研究。
综上所述,5-HT2AR在疼痛中发挥了重要的调控作用,其激活、表达与疼痛刺激类型、刺激强度均存在一定的相关性,明确其在疼痛中的作用及作用机制,将为临床的疼痛诊疗提供新的靶点和思路。
[1] Sommer C. Serotonin in pain and analgesia:actions in the periphery[J].MolNeurobiol, 2004,30(2):117-25.
[2] O′Mahony S M, Clarke G, Borre Y E, et al. Serotonin, tryptophan metabolism and the brain-gut-microbiome axis[J].BehavBrainRes, 2015,277:32-48.
[3] Andrews N, O′Neill M F. It might be a big family but the pain remains-last chance saloon for selective 5-HT receptor ligands[J]?CurrOpinPharmacol, 2011,11(1):39-44.
[4] Zhang G, Stackman R W Jr. The role of serotonin 5-HT2Areceptors in memory and cognition[J].FrontPharmacol, 2015,6:225.
[5] De la Puente B, Romero-Alejo E, Vela J M, et al. Changes in saccharin preference behavior as a primary outcome to evaluate pain and analgesia in acetic acid-induced visceral pain in mice[J].PainRes,2015,8:663-73.
[6] Brennan T J,Vandermeulen E P,Gebban G F.Chracterization of a rat model of incisional pain[J].Pain,1996,64(3):493-501.
[7] Bennett C J,Xie Y K.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[8] Hargreaves K, Dubner R, Brown F, et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77-88.
[9] Hori Y, Endo K, Takahashi T. Long-lasting synaptic facilitation induced by serotonin in superficial dorsal horn neurons of the rat spinal cord[J].JPhysiol,1996,492:867-76.
[10]Vogel C, Mossner R, Gerlach M, et al.Absence of thermal hyperalgesia in serotonin transporter-deficient mice[J].JNeurosci,2003,23(2):708-15.
[11]Sasaki M, Obata H, Saito S, et al. Antinociception with intrathecal alphamethyl-5-hydroxytryptamine,α5-hydroxytryptamine 2A/2C receptor agonist,in two rat models of sustained pain[J].AnesthAnalg, 2003, 96(2):1072-8.
[12]Aira Z,BuesaI,Gallego M, et al. Time-dependent crosstalk between spinal serotonin 5-HT2Areceptor and mglur1 subserves spinal hyperexcitability andneuropathic pain after nerve injury[J].JNeurosci,2012,32(39):13568-81.
[13]焦海峡,刘 庆,林 春,等. 脊髓5-HT2A受体对大鼠慢性内脏痛敏反应及其电针治疗的影响[J].中国药理学通报, 2011,27(9):1263-6.
[13]Jiao H X, Liu Q, Lin C, et al. Effect of spinal 5-HT2Areceptor on chronic visceral pain and electroacupuncture in rats[J].ChinPharmacolBull, 2011, 27(9):1263-6.
[14]Silveira J W, Dias Q M, Del Bel E A, et al.Serotonin receptors are involved in the spinal mediation of descending facilitation of surgical incision-induced increase of Fos-like immunoreactivity in rats[J].MolPain,2010,6:17.
[15]Hu W, Zhang Y, Cai Q, et al.Blockade of 5-HT2Areceptors at the site of inflammation inhibits activation of spinal dorsal horn neurons in rats[J].BrainResBull, 2016,124:85-94.
Effects of intraperitoneal injection of 5-HT2Areceptor antagonist MDL11939 on acute and chronic pain in mice
HUANG Si-ting1, JI Ning-ning1, DU Lei1, ZHANG Gong-liang2, ZHANG Yong-mei1
(1.JiangsuProvinceKeyLaboratoryofAnesthesiology,CollegeofAnesthesiology,XuzhouMedicalCollege,XuzhouJiangsu221002,China;2.SchoolofBasicMedicalSciences,AnhuiMedicalUniversity,Hefei230032,China)
Aim To investigate the effects and significance of 5-HT2Areceptor antagonist MDL11939 on acute acetic acid visceral pain, acute incision pain and chronic constriction injury (CCI) of sciatic nerve inmice. Methods Kunming male mice were suffered acute acetic acid visceral pain, acute incision pain and CCI neuropathic pain. After each animal model was established, MDL11939 was injected intraperitoneally. The writhing reaction was used to assess acute acetic acid visceral pain, while the thermal withdrawal latency (TWL) was used to evaluate the acute incision pain and CCI neuropathic pain. Results Compared with the control group, MDL11939 (0.25, 0.5, 1.0 mg·kg-1, i.p.) relieved acetic acid visceral pain significantly in a dose-dependent manner in mice, as revealed by the significant reduction of the number of twisting. In acute incision pain and CCI neuropathic pain, MDL11939 (0.5 mg·kg-1, i.p.) significantly increased TWL level. Conclusion 5-HT2Areceptor antagonist MDL11939 has analgesic effects on visceral pain, acute pain and neuropathic pain, which might be a novel therapeutic target to treat different pain in clinical situations.
5-HT2Areceptor; MDL11939; visceral pain; sciatica; incision pain; CCI
时间:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.032.html
2016-10-15,
2016-11-20
国家自然科学基金资助项目(No 81171041,81271217);江苏省高校自然科学基金重点项目(No 13KJA320001);江苏省自然科学基金资助项目(No BK20161171)
黄思婷(1990-),女,硕士生,研究方向:疼痛信号转导及其调控,E-mail:shuimudeshijie@163.com; 张咏梅(1970-),女,博士,教授,博士生导师,研究方向:疼痛信号转导及其调控、脑功能衰竭机制及其防治,通讯作者,E-mail:zhangym700@163.com
10.3969/j.issn.1001-1978.2017.02.016
A
1001-1978(2017)02-0223-05
R-332;R392.11;R441.1;R916.4
