鞘氨醇激酶1在肾间质纤维化中的作用及机制研究
2017-02-27杜春阳王鑫贵冯益平胡凤丽陈恩立任韫卓
杜春阳,肖 夏,王鑫贵,符 姣,冯益平,胡凤丽,陈恩立,任韫卓
(河北医科大学病理学教研室,河北 石家庄 050017)
鞘氨醇激酶1在肾间质纤维化中的作用及机制研究
杜春阳,肖 夏,王鑫贵,符 姣,冯益平,胡凤丽,陈恩立,任韫卓
(河北医科大学病理学教研室,河北 石家庄 050017)
目的 观察鞘氨醇激酶1(SphK1)在单侧输尿管结扎导致的小鼠肾间质纤维化模型中的作用及分子机制。方法 CD-1小鼠随机分为假手术组(Sham)、假手术加药物干预组(Sham+PF-543)、单侧输尿管结扎组(unilateral ureteral obstruction, UUO)和输尿管结扎加药物干预组(UUO+PF-543)。分别于手术后1、3、7、14 d取材,采用Western blot方法检测SphK1、纤维化相关指标mature TGF-β1、FN和Col Ⅰ及自噬相关因子LC3、Beclin1、Atg5和Atg12的蛋白表达水平;免疫组织化学染色方法观察SphK1、FN和ColⅠ的肾组织定位表达情况;Masson染色光镜下观察肾小管间质纤维化的病变面积,电镜下观察肾小管细胞内自噬体形成情况。结果 与Sham组相比,UUO组小鼠肾组织SphK1及自噬相关的蛋白表达水平明显升高,呈现时间依赖性;单侧输尿管结扎导致肾小管细胞内自噬体增多;纤维化相关因子的表达明显升高并伴随肾间质纤维化的病变面积增加;与UUO组相比,PF-543干预明显降低肾组织SphK1及自噬相关蛋白的表达,同时肾小管细胞内自噬体形成减少;但PF-543干预导致UUO肾组织纤维化相关因子的表达进一步升高,间质纤维化的病变进一步加重。结论 SphK1在肾间质纤维化过程中发挥肾保护作用,这一作用可能主要是通过诱导自噬实现的。
鞘氨醇激酶1;单侧输尿管结扎;自噬;纤维化;PF-543;电镜
肾间质纤维化(renal interstitial fibrosis, RIF)是多种病因所致的慢性肾脏疾病(chronic kidney disease, CKD)发展至终末期肾功能衰竭的重要病理基础[1]。与肾小球硬化相比,RIF与肾功能减退关系更为密切,直接反映了肾功能受损的严重程度。在RIF中,肾小管上皮细胞的变性、坏死、转分化及细胞外基质(extracellular matrix,ECM)的大量生成和沉积发挥了重要作用[2]。自噬(autophagy)是细胞清除受损细胞器及异常蛋白,避免发生凋亡和坏死的重要自身保护机制,可被饥饿、损伤、细胞分化及正常生长调节所诱导,在多种生理及病理条件下发挥细胞保护作用。研究显示,自噬在包括糖尿病肾病[3]、缺血/再灌注肾损伤[4]及梗阻性肾损伤[5]中均起到了一定的调节作用。
鞘氨醇激酶1(sphingosine kinase 1,SphK1)是细胞生物学功能的重要调控分子,能将具有促凋亡功能的鞘氨醇(sphingosine,Sph)磷酸化为具有促存活功能的鞘氨醇1-磷酸(sphingosine 1-phosphate,S1P),进而调控细胞的生长发育[6]。以往研究表明,SphK1/S1P信号通路在慢性肾脏疾病的发病及其病理生理过程中发挥重要调控作用。TGF-β1能诱导体外培养的足细胞及大鼠系膜细胞SphK1的高表达,抑制SphK1的表达后,RIF相关蛋白α-SMA、laminin 及TIMP-1的表达亦明显减低[7]。新近有研究显示SphK1能够通过诱导自噬延缓肺组织纤维化,发挥保护作用[8]。目前,有关SphK1在单侧输尿管结扎诱导的肾组织纤维化中的作用尚不明确。本实验旨在观察SphK1对单侧输尿管结扎诱导的肾组织纤维化及自噬激活的影响。
1 材料与方法
1.1 材料 8周龄♂ CD-1小鼠(25~28) g,购自北京维通利华实验技术有限公司,于SPF级饲养环境下饲养,自由摄食及饮水。SphK1特异性抑制剂PF-543购自美国Selleck Chemicals公司。兔抗FN单克隆抗体及兔抗SphK1、TGF-β1(mature)、I型胶原(collagen Ⅰ, Col Ⅰ)、LC3、β-actin多克隆抗体购自美国Promega公司。兔抗Beclin1、Atg5和Atg12多克隆抗体为美国Proteintech公司产品。辣根过氧化物酶标记羊抗兔IgG购自北京中杉金桥生物技术有限公司。聚偏二氟乙烯膜(PVDF)为美国Millipore公司产品。
1.2 方法
1.2.1 动物模型的建立、分组及取材 实验动物随机分为4组: 假手术组(Sham)、假手术加药物干预组(Sham+PF-543)、单侧输尿管结扎组(unilateral ureteral obstruction, UUO)和输尿管结扎加药物干预组(UUO+PF-543),每组32只。UUO及UUO+PF-543组小鼠于无菌手术室行左侧输尿管结扎术制备肾纤维化模型。Sham及Sham+PF-543组小鼠手术中除不结扎左侧输尿管外,其余操作步骤均与模型组相同。药物干预组于UUO模型建立当日开始腹腔注射PF-543 (1 mg·kg-1·d-1), Sham及UUO组每天腹腔注射等体积的生理盐水,至取材前。分别于术后d 1、3、7、14处死老鼠。切取左肾, 部分置于2.5%的戊二醛中固定,进行电镜观察;部分肾组织置于4%多聚甲醛中固定, 进行光镜观察、PAS、Masson染色及免疫组织化学检查;另留取部分肾皮质置于液氮中保存, 进行总蛋白质的提取及检测。
1.2.2 Masson染色 4%多聚甲醛中固定24 h的肾组织标本经脱水、透明、浸蜡及包埋后,制成厚为2 μm石蜡切片。常规Masson染色。应用HPIAS-2000影像分析软件,对Masson染色切片肾间质中胶原染色阳性部分进行计算机的辅助分析,结果以肾间质纤维化面积的百分比来表示。
1.2.3 免疫组织化学染色检测肾组织SphK1、FN和ColⅠ的表达 2 μm石蜡切片常规脱蜡至水,3%的H2O2封闭内源性过氧化物酶,随后用胃蛋白酶(1 g·L-1)进行抗原修复,37℃,10 min。一抗分别为抗SphK1(1 ∶200)、抗FN(1 ∶200)和抗Col Ⅰ(1 ∶100),4℃冰箱过夜。磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤后滴加二抗(山羊抗兔IgG,1 ∶200)。二氨基联苯胺(diaminobenzidine,DAB)显色剂显色后,苏木精复染、常规脱水、透明、封片。Image Pro Plus 6.0软件分析切片中阳性染色面积,结果以阳性面积百分比表示。
1.2.4 透射电镜下观察自噬体 将各组小鼠肾皮质切取约1 mm3大小的组织块,立即浸入预冷的2.5%戊二醛中固定。固定完成后,按电镜超薄切片常规处理步骤进行脱水、包埋、固化及切片,乙酸双氧铀染色,枸橼酸铅复染,Hitachi H7500透射电镜观察肾小管上皮细胞的结构变化,计数每10个同等放大倍数电镜视野下肾小管上皮细胞内自噬体数量。
1.2.5 Western blot检测蛋白质表达水平 各组取等量肾组织(100 mg)放入EP管中,加入预冷的组织蛋白裂解液1 mL,研磨,冰上静置裂解30 min后,4℃、12 000 r·min-1离心20 min。Lowry法测定各管上清液中蛋白质浓度。取裂解蛋白50 μg,经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后,转移至PVDF膜上;5%的脱脂奶粉溶液封闭2 h,分别加入SphK1、mature TGF-β1、FN、Col Ⅰ、LC3、Beclin1、Atg5和Atg12抗体,4℃冰箱过夜,洗膜后加辣根过氧化物酶标记的羊抗兔抗体(1 ∶5 000稀释),37℃孵育1.5 h;洗膜后加ECL试剂,然后将PVDF膜放入X光片暗盒,压片,显影,定影。用美国UVP公司LabWorks 4.5分析系统软件对Western条带进行定量分析。
2 结果
2.1 SphK1在UUO模型肾组织不同时间点的表达情况 Western印迹结果显示,SphK1在对照sham组有基础量的表达,UUO组其表达明显增多,呈明显时间依赖性(Fig 1)。

Fig 1 Expression of SphK1 detected by Western blot in sham or UUO group(n=8)
*P<0.05,**P<0.01vssham group
2.2 自噬相关基因在UUO模型肾组织不同时间点的表达情况 Western印迹结果显示,与对照sham组相比,输尿管梗阻1 d后即出现自噬相关基因Beclin1及Atg5的表达增高,3 d和7 d表达迅速增加,14 d逐渐降低至基础水平;LC3-Ⅱ及Atg12在输尿管梗阻3 d表达增高,7 d达到高峰(P<0.01, Fig 2)。
2.3 PF-543对各组肾组织SphK1表达的影响 SphK1的蛋白表达在UUO组(梗阻肾)1 d开始升高,且随着梗阻时间延长进行性增高,14 d达到最高;而UUO+PF-543组SphK1的蛋白表达水平较UUO组同期明显下降(P<0.01, Fig 3A)。免疫组织化学染色结果显示,SphK1主要表达于UUO小鼠肾小管上皮细胞的胞质,明显高于对照sham组;PF-543明显降低了SphK1的表达(Fig 3B)。
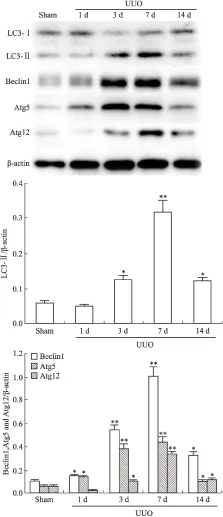
Fig 2 Expression of LC3,Beclin1,Atg5 and Atg12 detected by Western blot in sham or UUO group(n=8)
*P<0.05,**P<0.01vssham group
2.4 PF-543对各组肾组织自噬体形成及自噬相关蛋白表达的影响 与假手术sham组相比,UUO组自噬相关蛋白在输尿管梗阻后7 d表达明显增高;PF-543干预抑制了输尿管梗阻诱导的自噬相关蛋白的高表达(P<0.05, Fig 4A);sham+PF-543组与sham组之间表达无差异。透射电镜下观察各组小鼠肾组织,与假手术sham组相比,UUO组小鼠肾组织中自噬体明显增多,UUO+PF-543组自噬体数量较UUO组减少(Fig 4B)。
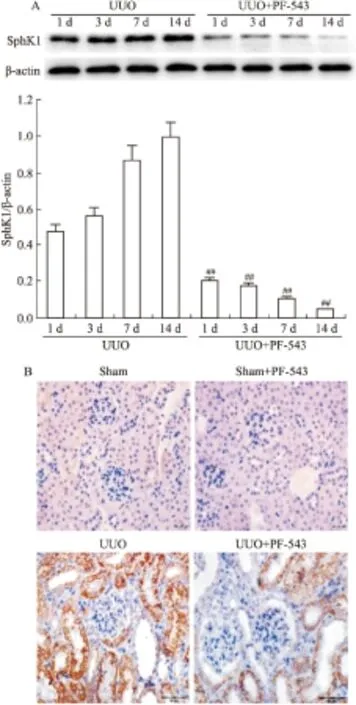
Fig 3 Expression of SphK1 in UUO
##P<0.01vsUUO group
2.5 PF-543对各组肾组织间质纤维化的影响 与假手术sham组相比,输尿管梗阻7 d肾组织纤维化相关指标mature TGF-β1、FN及Col Ⅰ的蛋白表达明显升高,PF-543干预后其表达反而进一步升高,差异有统计学意义(P<0.01, Fig 5A)。免疫组织化学染色结果显示,UUO组FN及Col Ⅰ的表达增强,Col Ⅰ主要表达于肾小管上皮细胞胞质,而FN主要表达于肾间质;PF-543干预后FN及Col Ⅰ的表达进一步增强(Fig 5B、5C)。Masson染色结果显示,UUO组术后7 d小管间质病变面积较假手术sham组明显增加;PF-543干预后小管间质的病变较UUO组进一步加重(Fig 6)。

Fig 4 Effect of PF-543 on activation of autophagy in UUO mice analyzed by Western blot(A) and transmission electron microscope(B)(n=8)
**P<0.01vssham group;#P<0.05vsUUO group
3 讨论
肾小管间质纤维化,无论源自炎症、代谢、免疫或者机械性梗阻,都将不可逆性地进展至终末期肾功能衰竭[9]。因此,由慢性肾小管间质损伤导致的肾间质纤维化已经成为几乎所有肾脏疾病共同的最终结局。在肾脏纤维化过程中,肾间质炎细胞浸润,肾小管上皮细胞转分化、TGF-β表达上调,以及ECM过度沉积均对肾间质纤维化的进展发挥了不可替代的作用[10]。本研究中Masson染色结果显示,UUO组肾间质纤维化面积增加,Western blot及免疫组织化学染色显示ECM的重要组成成分FN及ColⅠ的蛋白表达明显升高。与此同时,肾组织内mature TGF-β1的蛋白表达也明显增强。
越来越多的研究证实,SphK1在体内多个器官的纤维化性疾病进展中起着重要的调节作用,包括肺脏、心脏、肝脏及肾脏。研究显示,SphK1和纤连蛋白FN在高糖培养的肾小球系膜细胞中高表达,抑制剂抑制SphK1的表达后,FN的表达也随之降低,呈现明显的相关性[11]。TGF-β1是组织纤维化中最关键的促纤维化生长因子。体外培养的足细胞中,TGF-β1刺激上调了SphK1的表达,应用siRNA敲低SphK1的表达后,TGF-β1诱导的FN的高表达也受到明显的抑制,提示SphK1在肾细胞纤维化中发挥了典型的促纤维化作用[12]。有趣的是,在对SphK1基因敲除鼠诱导肾间质纤维化的模型研究中,却发现了完全相反的结果。与野生型小鼠相比,SphK1基因敲除鼠的肾间质纤维化的病变更严重,纤维化调控因子CTGF的表达明显升高[13]。在缺血/再灌注导致的急性肾损伤模型中,SphK1通过激活S1P受体1,减轻了肾组织的损伤,发挥肾脏保护作用[4]。本研究结果显示,在UUO梗阻小鼠肾脏中,SphK1的表达明显增加,呈现时间依赖性;PF-543能够抑制SphK1的表达,同时与UUO组相比,mature TGF-β1、FN及Col Ⅰ的表达水平反而增加了,间质纤维化程度也明显加重。这一结果与SphK1基因敲除鼠的研究结果相一致,提示SphK1在肾间质纤维化中可能发挥了抗纤维化的保护作用。

Fig 5 Effect of PF-543 on expression of mature TGF-β1,FN and Col Ⅰin UUO mice (n=8)
A: Results of Western bolt; B: Immunohistochemical staining of Col I; C: Immunohistochemical staining of FN.*P<0.05,**P<0.01vssham group;#P<0.05vsUUO group

Fig 6 Effect of PF-543 on deposition of collagen in UUO mice detected by Masson staining
自噬是细胞内高度保守的维持细胞内环境自身稳定的一种重要的细胞内降解机制,其通过双层膜包裹大分子蛋白和受损或衰老的细胞器而形成自噬体,然后与溶酶体融合形成自噬溶酶体,并在其中完成降解过程。自噬对细胞的作用具有两面性,在低水平损伤时,细胞自噬被激活,并通过降解清除受损细胞器的过程起到了初步尝试重建细胞稳态的作用;若细胞损伤的严重程度超过了自噬可承受的范围时,就导致了程序性的细胞死亡,称之为II类程序性细胞死亡[14]。近年来,自噬在肾脏疾病中的作用被广泛关注。糖尿病肾病中,足细胞自噬缺陷是导致患者出现蛋白尿和肾小球硬化的重要激发靶点[15]。在嘌呤霉素氨基核苷(PAN)肾病模型中,自噬激活标志蛋白LC3的表达在早期明显下降,而在恢复期明显加强[16]。脂联素通过AMPK信号通路激活内皮细胞自噬,进而抑制醛固酮诱导的上皮间质转分化,延缓了高血压性肾组织纤维化进程[17]。在UUO小鼠模型中,Li等[18]发现梗阻后7 d,肾组织内的自噬体形成明显增加,自噬相关蛋白LC3和Beclin1也明显高表达,肾组织内近端小管损伤加重,上皮细胞凋亡率明显增加。在本研究中,输尿管梗阻早期即出现自噬相关基因LC3-Ⅱ、Beclin1、Atg5及Atg12的表达增高,7 d达到顶峰,14 d逐渐降低至基础水平。电镜检测发现,输尿管梗阻7 d时肾组织内自噬体数量较对照组明显增加,与前述结果相一致。
新近研究发现,SphK1能够通过诱导自噬参与多种疾病的发生发展。肿瘤细胞中,SphK1激活细胞自噬,促进肿瘤细胞的生长[19]。饥饿状态下,SphK1激活自噬,抑制了MCF-7细胞的死亡,保证了细胞存活[20]。TGF-β1诱导的肺纤维化模型中,SphK1通过诱导自噬延缓了肺组织纤维化的进程[8]。因此,我们进一步观察了SphK1与自噬之间的关系。结果显示,PF-543能够抑制UUO梗阻小鼠肾组织自噬的激活,减少自噬体的形成及自噬相关基因的表达,提示SphK1可能通过诱导自噬在肾组织纤维化中发挥保护作用。意外的是,我们发现SphK1的表达与肾组织自噬的激活并不呈现平行关系,这可能与UUO 14 d肾组织细胞损伤严重,超出了自噬的可承受范围,出现了细胞的死亡密切相关。
综上所述,在输尿管梗阻导致的肾组织纤维化中,SphK1的表达增高可能是一种适应性的增高,进而通过激活自噬发挥对肾组织的保护作用。
[1] Lawson J, Elliott J, Wheeler-Jones C, et al. Renal fibrosis in feline chronic kidney disease: known mediators and mechanisms of injury[J].VetJ,2015,203(1): 18-26.
[2] Li X, Zhuang S. Recent advances in renal interstitial fibrosis and tubular atrophy after kidney transplantation[J].FibrogenesisTissueRepair,2014, 7:15.
[3] Kume S, Koya D. Autophagy: a novel therapeutic target for diabetic nephropathy[J].DiabetesMetabJ,2015,39(6): 451-60.
[4] Kaushal G P, Shah S V. Autophagy in acute kidney injury[J].KidneyInt,2016,89(4): 779-91.
[5] Ding Y, Kim S L, Lee S Y, et al. Autophagy regulates TGF-beta expression and suppresses kidney fibrosis induced by unilateral ureteral obstruction[J].JAmSocNephrol,2014,25(12): 2835-46.
[6] 彭 晶,兰 天,黄凯鹏,等. 黄连素调节鞘氨醇激酶-1-磷酸鞘氨醇信号通路抗糖尿病小鼠肾损伤的研究[J].中国药理学通报,2011,27(11): 1544-9.
[6] Peng J, Lan T, Huang K P, et al. Berberine ameliorates diabetic mouse renal injury through inhibition of SphK1-S1P signaling pathway[J].ChinPharmacolBull,2011,27(11): 1544-9.
[7] Yamanaka M, Shegogue D, Pei H, et al. Sphingosine kinase 1 (SPHK1) is induced by transforming growth factor-beta and mediates TIMP-1 upregulation[J].JBiolChem,2004,279(52): 53994-4001.
[8] Huang L S,Natarajan V. Sphingolipids in pulmonary fibrosis[J].AdvBiolRegul,2015,57: 55-63.
[9] Grgic I, Duffield J S, Humphreys B D. The origin of interstitial myofibroblasts in chronic kidney disease[J].PediatrNephrol,2012,27(2):183-93.
[10]Kriz W, Kaissling B, Le Hir M. Epithelial-mesenchymal transition(EMT) in kidney fibrosis: fact or fantasy[J]?JClinInvest,2011,121(2): 468-74.
[11]Lan T, Liu W, Xie X, et al. Sphingosine kinase-1 pathway mediates high glucose-induced fibronectin expression in glomerular mesangial cells[J].MolEndocrinol,2011,25(12): 2094-105.
[12]Huang J, Huang K, Lan T, et al. Curcumin ameliorates diabetic nephropathy by inhibiting the activation of the SphK1-S1P signaling pathway[J].MolCellEndocrinol,2013,365(2): 231-40.
[13]Ren S, Babelova A, Moreth K, et al. Transforming growth factor-beta2 upregulates sphingosine kinase-1 activity, which in turn attenuates the fibrotic response to TGF-beta2 by impeding CTGF expression[J].KidneyInt,2009,76(8): 857-67.
[14]左 玮,梅 丹.高血糖通过抑制线粒体自噬加重大鼠脑缺血/再灌注损伤[J].中国药理学通报,2016,32(6):846-53.
[14]Zuo W, Mei D. Hyperglycemia aggravated cerebral ischemia/reperfusion injury by inhibiting mitophagy[J].ChinPharmacolBull,2016,32(6): 846-53.
[15]Xin W, Li Z, Xu Y, et al. Autophagy protects human podocytes from high glucose-induced injury by preventing insulin resistance[J].Metabolism,2016, 65(9):1307-15.
[16]Asanuma K, Tanida I, Shirato I, et al. MAP-LC3, a promising autophagosomal marker, is processed during the differentiation and recovery of podocytes from PAN nephrosis[J].FASEBJ,2003,17(9):1165-7.
[17]Ruan C C, Li Y, Ma Y, et al. YIA 03-02 adiponectin-mediated epithelial autophagy attenuates hypertensive renal fibrosis[J].JHypertens,2016,34(1):e204.
[18]Li L, Zepeda-Orozco D, Black R, et al. Autophagy is a component of epithelial cell fate in obstructive uropathy[J].AmJPathol,2010,176(4):1767-78.
[19]Beljanski V, Knaak C, Smith C D. A novel sphingosine kinase inhibitor induces autophagy in tumor cells[J].JPharmacolExpTher,2010,333(2): 454-64.
[20]Lavieu G, Scarlatti F, Sala G,et al. Regulation of autophagy by sphingosine kinase 1 and its role in cell survival during nutrient starvation[J].JBiolChem,2006,281(13): 8518-27.
Role of SphK1 in renal tubulointerstitial fibrosis and its mechanism
DU Chun-yang,XIAO Xia,WANG Xin-gui, FU Jiao,FENG Yi-ping,HU Feng-li,CHEN En-li, REN Yun-zhuo
(DeptofPathology,HebeiMedicalUniversity,Shijiazhuang050017,China)
Aim To investigate the effect of sphingosine kinase 1(SphK1) on unilateral ureteral obstruction(UUO)-induced tubulointerstitial fibrosis and explore the possible mechanism.Methods The CD-1 mice were randomly divided into four groups: sham-operation group(Sham), PF-543 treatment control group(Sham+PF-543), model group(UUO) and PF-543 treatment group(UUO+PF-543). On 1,3,7 and 14 d after operation, eight mice were selected randomly from each group and sacrificed. The protein expressions of SphK1,mature TGF-β1,FN,ColⅠ,LC3,Beclin1,Atg5 and Atg12 were observed by Western blot. The histological changes were examined by Masson′s trichrome stain. Immunhistochemistry was performed to measure the levels of expression of SphK1,FN and ColⅠ. Transmission electron microscope was used to observe the autophagic body.Results SphK1 expression and autophagy were both upregulated in a mouse model of kidney fibrosis induced by UUO. Meanwhile, increased mature TGF-β1 and deposition of extracellular matrix(ECM) were observed in tubulointerstitial areas compared with sham-operated mice. After intraperitoneal injection with the SphK1 specific inhibitor PF-543 in UUO mice, enhanced expression of SphK1 and activated autophagy were significantly abrogated. However, aggravation of renal fibrosis was detected when SphK1 inhibitor PF-543 was applied to suppress SphK1 expression in UUO mice.Conclusion SphK1 activation is renoprotective through the induction of autophagy in the pathogenesis of kidney fibrosis.
sphingosine kinase 1;unilateral ureteral obstruction;autophagy;fibrosis;PF-543;transmission electron microscope
2016-10-08,
2016-11-18
时间:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.028.html
河北省卫生厅重点科技研究计划(No 20150628); 河北医科大学大学生创新实验项目资助课题
杜春阳 (1980-),女,博士,讲师,研究方向:肾脏病理学,E-mail: duchunyang55@163.com; 任韫卓(1978-),女,博士,教授,研究方向:肾脏病理学,通讯作者,E-mail: renyunzhuo1978@163.com
10.3969/j.issn.1001-1978.2017.02.014
A
1001-1978(2017)02-0212-07
R-332;R329.24;R345.57;R692.320.22
