刺槐素对乳腺癌T47D细胞增殖的影响
2017-02-27司玲玲任欢欢任博雪李德芳郑秋生
司玲玲,马 俊,任欢欢,任博雪,李德芳,郑秋生,
(1.石河子大学药学院,新疆特种植物药资源教育部重点实验室,新疆 石河子 832002;2.滨州医学院,山东 烟台 264005)
刺槐素对乳腺癌T47D细胞增殖的影响
司玲玲1,马 俊2,任欢欢1,任博雪1,李德芳2,郑秋生1,2
(1.石河子大学药学院,新疆特种植物药资源教育部重点实验室,新疆 石河子 832002;2.滨州医学院,山东 烟台 264005)
目的 研究刺槐素对乳腺癌T47D细胞增殖的影响,探究刺槐素雌激素样作用的主要介导受体。方法 磺酰罗丹明B(SRB)法检测细胞增殖,流式细胞术检测细胞周期的变化,qPCR检测雌激素受体-α(ERα)、雌激素受体-β(ERβ)、细胞增殖抗原标记物(Ki67)mRNA表达,Western blot法检测ERα、ERβ蛋白表达。结果 刺槐素浓度为0.001~10 μmol·L-1,能促进T47D细胞增殖,使S和G2/M期的细胞比例明显增加,增殖指数升高,同时增加Ki67 mRNA的表达,此作用可被雌激素受体拮抗剂ICI 182.780所拮抗。刺槐素及17β-雌二醇(E2)均可上调ERα和ERβ的表达,刺槐素联合ERα受体拮抗剂(MPP)可逆转刺槐素的促增殖作用,使S和G2/M期的细胞比例明显降低,减少Ki67 mRNA的表达;但刺槐素联合ERβ受体拮抗剂(PHTPP)处理虽可抑制细胞增殖效应,使S和G2/M期的细胞比例降低,减少Ki67 mRNA的表达,但作用不明显。结论 刺槐素具有雌激素样作用,在0.001~10 μmol·L-1浓度范围内,可通过调节ERα受体表达来促进T47D细胞的增殖。
刺槐素;雌激素;T47D细胞;雌激素α受体;雌激素β受体;雌激素样作用;细胞增殖
乳腺癌为女性最普遍的恶性肿瘤之一,并且引起女性死亡极高,每年约达40万人,仅次于肺癌[1]。乳腺癌治疗取决于乳腺癌的类型和分期,至今,传统的治疗手段包括手术、激素治疗、全身化疗、放疗和分子靶向治疗等[2]。寻找高效的治疗药物,并能有效地提高乳腺癌综合治疗效果,减少副作用,降低死亡率,已成为当前乳腺癌治疗研究重点之一。
黄酮类化合物是存在于植物中的天然化合物,目前,已知的黄酮类化合物大概有8 000多种。据报道,黄酮类化合物具有降血压、抗真菌、抗病菌等作用,其中补骨脂黄酮、异补骨脂黄酮等多种黄酮类化合物对雌激素敏感性人乳腺癌细胞株MCF-7均具有雌激素样活性[3]。刺槐素(acacetin,5,7-二羟基-4-甲氧基黄酮)是从刺槐中提取的一种黄酮类化合物,具有抗氧化、抗炎和抗疟原虫的功能[4],它可以抑制胃癌AGS细胞、非小细胞肺癌A549细胞的生长[5];拓扑异构酶Ⅰ诱导的DNA损伤是刺槐素产生细胞毒性的潜在因素[6]。据报道,刺槐素、染料木素和其他植物雌激素的化学结构与雌激素类似,并有弱雌激素活性[7],刺槐素用于乳腺癌的治疗已经引起越来越多的关注。本课题研究刺槐素对雌激素依赖性肿瘤细胞T47D增殖的影响,为揭示其发挥雌激素样作用的机制提供初步的理论基础,给植物雌激素产品的研发提供确切的依据,而且可以为指导临床妇科用药,特别是为更年期妇女保健及乳腺癌等雌激素依赖性肿瘤患者的用药提供参考。
1 材料
1.1 细胞 人乳腺导管癌T47D细胞,购自ATCC。
1.2 药品与试剂 刺槐素、17β-雌二醇(E2)、二甲基亚砜(DMSO)、磺基罗丹明B(SRB)、预染蛋白Marker、First Strand cDNA Synthesis Kit,均为美国Sigma公司产品;DMEM、无酚红DMEM、活性炭-葡聚糖苷处理的胎牛血清(CDT-FBS)为Hyclone公司产品;雌激素受体(ER)拮抗剂(ICI 182.780)、ERα拮抗剂(MPP)、ERβ拮抗剂(PHTPP),anti-estrogen receptor alpha(anti-ERα)抗体、anti-estrogen receptor beta(anti-ERβ)抗体、goat anti-rabbit IgG,Abcam公司;NC膜、蛋白酶抑制剂(PMSF)、4×蛋白上样缓冲液、RIPA 裂解液,Solarbio公司。
1.3 仪器 CO2细胞培养箱(Thermo 3131)、多功能酶标仪(Thermo 3001),美国Thermo公司;超净工作台(ZHJH-1112B),上海智诚分析仪器有限公司;倒置荧光显微镜(MIC00266),德国ZEISS公司;倒置生物显微镜(BDS200-PH),重庆奥特光学仪器有限公司;流式细胞仪,美国BD公司。
2 方法
2.1 细胞培养 T47D细胞置于DMEM培养基(10%胎牛血清)中,37 ℃、5% CO2恒温培养箱中培养2 d。实验开始前3 d,PBS洗涤3次,改成无酚红DMEM(含5% CDT-FBS)培养,直至耗尽细胞内储存的雌激素。
2.2 SRB法检测细胞增殖 实验分成9组:control、刺槐素组(A)、刺槐素+ICI 182.780组、E2组、E2+ICI 182.780组、刺槐素+MPP组、E2+MPP组、刺槐素+PHTPP组、E2+PHTPP组。T47D细胞使用无酚红DMEM(含5% CDT-FBS)培养3 d。收集对数生长期细胞,8×104/孔接种于96孔板,培养24 h后,各组加入相应药物(刺槐素的给药浓度为0.001、0.01、0.1、1、10 μmol·L-1,ICI 182.780给药浓度为1 μmol·L-1,E2给药浓度为0.01 μmol·L-1,MPP给药浓度为1 μmol·L-1,PHTPP给药浓度为1 μmol·L-1);每个浓度设5个复孔,37℃、5% CO2恒温培养箱中分别继续培养24、48、72 h。培养结束后,加入三氯乙酸(TCA,终浓度为10%),4 ℃固定1~2 h。固定结束后,吸弃孔内液体,去离子水洗涤4~5次,室温干燥。每孔加入100 μL 0.4% SRB,染色10 min,吸弃板孔内SRB染液,1%乙酸洗涤5遍,室温干燥。加入150 μL DMSO,充分振荡溶解10 min,Thermo 3001多功能酶标仪测量各孔的吸光值(A510 nm)[8],计算平均值,计算细胞增殖率。
增殖率(proliferation rate,PR)/%=(实验组A值/溶剂对照组A值)×100%。
2.3 流式细胞术检测细胞周期 T47D细胞用无酚红DMEM(含5% CDT-FBS)培养基培养3 d后,以5×105/皿接种于培养皿中,待细胞贴壁后,改成无酚红DMEM(含0.5% CDT-FBS)完全培养基,培养3 d,细胞统一在G0期,换成无酚红DMEM培养液(5% CDT-FBS,且含药物浓度同“2.2”项),继续培养72 h。收集细胞,加入预冷的70%乙醇,混匀,4℃冰箱过夜,弃去乙醇,PBS洗2遍,加入碘化丙啶染液(0.03 g·L-1)、RNase A(0.3 g·L-1),37℃避光30 min,流式细胞仪检测细胞周期分布比例,并计算细胞增殖指数(PI)[9]。
PI=(S+G2/M)/(G0/G1+S+G2/M)
2.4 qPCR检测雌激素受体相关基因的mRNA表达 T47D细胞经无酚红DMEM(含5% CDT-FBS)培养3 d,1×106/皿接种于培养皿中,待细胞贴壁后,各组更换含相应药物(给药浓度同“2.2”项)的无酚红培养基继续培养72 h。按照试剂盒说明书进行操作,提取总RNA,逆转录,然后进行扩增反应,最后得PCR产物,并分析数据。PCR引物序列见Tab 1[10]。

Tab 1 Primer sequences of qPCR
2.5 Western blot法检测ERα和ERβ蛋白表达 细胞处理同“2.4”。收集各处理组细胞,4 ℃预冷的PBS(pH 7.4)洗2遍,加入200 μL RIPA细胞裂解液,冰上裂解30 min,4 ℃、12 000 r·min-1离心10 min,取上清。蛋白经煮沸处理后,各组取 30 μg蛋白样品,经10% SDS-PAGE电泳分离,转印NC膜上,加入一抗,4 ℃过夜,次日以TBST洗膜3次,每次10 min;加入二抗,室温孵育1 h;以TBST摇床洗膜3次,每次10 min,加入ECL显色液,经免疫印迹成像系统显影检测目的蛋白。
3 结果
3.1 刺槐素对T47D细胞增殖的影响 首先,分别使用0.001、0.01、0.1、1、10 μmol·L-1刺槐素处理人乳腺癌T47D细胞。如Fig 1所示,与对照组相比,刺槐素对T47D细胞增殖具有明显的促进作用,呈现剂量依赖效应;并且随作用时间的延长,刺槐素对T47D细胞的促增殖效应增强,72 h作用最明显(P<0.01)。0.01、1、10 μmol·L-1刺槐素处理人乳腺癌T47D细胞,流式细胞仪检测细胞周期结果显示(Fig 2),与对照组相比,刺槐素作用于T47D细胞72 h后,可以增加S期和G2/M细胞的比例,促进细胞增殖,并呈现出浓度依赖性。同时,qPCR结果如Fig 3所示,与对照组相比,刺槐素给药后,可上调Ki67基因表达。

Fig 1 Effect of acacetin on proliferation rate of T47D cells
*P<0.05,**P<0.01vscontrol
3.2 刺槐素的雌激素活性检测 使用10 μmol·L-1刺槐素及0.01 μmol·L-1E2分别处理T47D细胞24、48、72 h,结果表明(Fig 4),刺槐素和E2能促进T47D细胞增殖,并呈现出明显的时间依赖性。然后,使用1 μmol·L-1ICI 182.780与刺槐素或E2共同处理T47D细胞,结果表明(Fig 4),与刺槐素或E2单独处理组比较,细胞增殖率明显降低。细胞周期检测结果显示(Fig 5),与对照组相比,10 μmol·L-1刺槐素作用于T47D细胞72 h后,可以增加S期和G2/M细胞的比例(P<0.01),促进细胞增殖,但该作用稍弱于E2组;当加入ICI 182.780后,S期和G2/M细胞的比例明显下降。同时,Ki67检测结果显示(Fig 6),与对照组相比,刺槐素可以升高Ki67 mRNA的水平,刺槐素联合ICI 182.780处理组与刺槐素单独处理组相比,可抑制Ki67 mRNA的表达。
3.3 刺槐素雌激素活性的主要介导受体 分别使用刺槐素(10 μmol·L-1)、E2(0.01 μmol·L-1)、MPP(1 μmol·L-1)和PHTPP(1 μmol·L-1)处理T47D细胞,检测细胞内ERα和ERβ的表达情况。与对照组相比,MPP下调ERα的表达,PHTPP下调ERβ的表达。与刺槐素组相比,刺槐素联合MPP组中ERα的mRNA表达明显降低,蛋白表达也有所降低,另外,刺槐素联合PHTPP处理可明显降低ERβ的mRNA表达(Fig 7)。

Fig 2 Effect of acacetin on cell cycle of T47D cells
A:Cell cycle distribution;B:Proliferation index.**P<0.01vscontrol

Fig 3 Effect of acacetin on Ki67 mRNA expression in T47D cells
*P<0.05,**P<0.01vscontrol
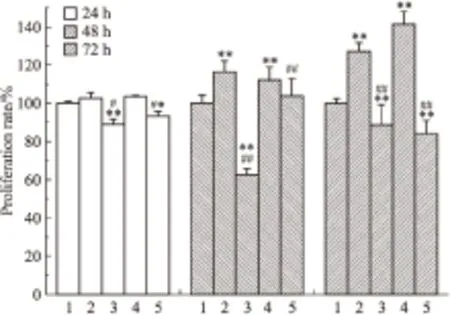
Fig 4 Effects of acacetin, E2 and
T47D cells were treated respectively with acacetin(A),17β-estradiol(E2) and estrogen receptor inhibitor ICI 182.780(ICI).1:Control;2:A;3:A+ICI;4:E2;5:E2+ICI.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsacacetin or E2 group
使用上述浓度的药物处理T47D细胞,每个浓度设5个复孔,37℃、5% CO2条件下分别继续培养24、48、72 h。Fig 8A为MPP对T47D细胞增殖率的结果,与刺槐素或者E2的单独处理组相比,刺槐素联合MPP组、E2联合MPP组的细胞增殖率降低,无时间依赖效应。Fig 8B为PHTPP处理对T47D细胞增殖率的结果,结果显示,与刺槐素或者E2的单独处理组相比,刺槐素联合PHTPP组、E2联合PHTPP组的细胞增殖率无明显差异。流式细胞术检测结果显示(Fig 9),与单独加刺槐素组比较,刺槐素联合MPP组S期和G2/M期细胞的比例明显下降。而刺槐素联合PHTPP组S期和G2/M期细胞的比例无明显改变。同时,qPCR检测结果显示(Fig 10),与单独加刺槐素组比较,刺槐素联合MPP组可抑制Ki67的mRNA表达。而刺槐素联合PHTPP组无明显变化。以上结果均说明,在T47D细胞中,刺槐素可能主要是通过ERα发挥其雌激素活性,即主要通过ERα受体介导促进ER阳性乳腺癌细胞增殖。
4 讨论
T47D细胞是雌激素敏感性人乳腺癌细胞,ERα、ERβ均为阳性,可以特异性地受雌激素或雌激素样活性物质调节,影响T47D细胞增殖,故该细胞普遍应用于快速筛选和评价雌激素。ER存在于正常乳腺组织上皮细胞,而在乳腺癌组织ER阳性表达,说明癌组织部分保存了正常细胞的结构功能,所以这类患者通常恶性程度低,内分泌治疗比较有效。大约30%的乳腺癌患者属于雌激素依赖性,乳腺癌患者在绝经后,此比例则占据一大半,此类雌激素依赖性的患者体内具有雌激素受体且需要雌激素来维持肿瘤的生长[12-13]。本研究主要针对植物性雌激素药物在乳腺癌内分泌治疗中的应用进行探究,为植物性雌激素在妇女保健和妇科病症治疗的应用提供理论依据。

Fig 5 Effects of acacetin, E2 and ICI 182.780 on cell cycle of T47D cells
A: Cell cycle distribution; B: Proliferation index.**P<0.01vscontrol;##P<0.01vsacacetin or E2 group

Fig 6 Effects of acacetin, E2 and ICI 182.780 on Ki67 mRNA expression in T47D cells
*P<0.05,**P<0.01vscontrol;##P<0.01vsacacetin or E2 group
本实验中SRB增殖检测结果表明,刺槐素在0.001~10 μmol·L-1范围内能促进T47D细胞的增殖,此作用与E2作用相同。细胞周期受到精确的调控,复杂却有序。Ki67是G1、S、G2、M期细胞的标志性蛋白,由于G0期没有这种蛋白,所以Ki67蛋白的表达能够作为判断肿瘤细胞增殖活性的一种可靠指标[11]。mRNA检测结果表明刺槐素可明显提高Ki67的mRNA水平。同时刺槐素对细胞增殖周期的影响与E2趋势相同,即提高细胞分裂增殖指数,主要表现在S期细胞比例增加,G2/M期细胞比例也有所上升。以上结果表明,刺槐素在0.001~10 μmol·L-1内可有效促进T47D细胞增殖,表现出明显的雌激素样作用。接着探讨刺槐素是否通过雌激素受体发生作用,E2组和刺槐素组同时加入ICI 182.780,结果证明刺槐素诱导T47D细胞增殖作用能被ICI 182.780完全拮抗。进而用刺槐素联合MPP或PHTPP共同作用细胞,研究发现刺槐素组和雌二醇组加入MPP后,细胞的生长明显受到抑制,与刺槐素和雌二醇组相比差异具有显著性;而PHTPP对细胞的增殖与刺槐素或雌二醇组相比,差异无显著性。说明刺槐素的促进细胞增殖作用可能主要是由ERα介导的。本实验中,刺槐素促增殖效应随ERα拮抗剂的加入而被削弱了,说明刺槐素不仅会促进ERα基因表达,而且还可能通过ERα介导的转录调控通路发挥促增殖效应。

Fig 7 Effects of acacetin, E2, ERα inhibitor and ERβ inhibitor on mRNA and protein expressions of ERα and ERβ in T47D cells
A:ERα mRNA expression; B: ERβ mRNA expression; C: ERα protein expression; D: ERβ protein expression.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsacacetin or E2 group.

Fig 8 Effects of acacetin, E2, ERα inhibitor and ERβ inhibitor on proliferation rate of T47D cells
A: ERα inhibitor (MPP). 1: Control; 2: A; 3: A+MPP; 4: E2; 5: E2+MPP. B: ERβ inhibitor (PHTPP). 1: Control; 2: A; 3: A+PHTPP; 4: E2; 5: E2+PHTPP.*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsacacetin or E2 group
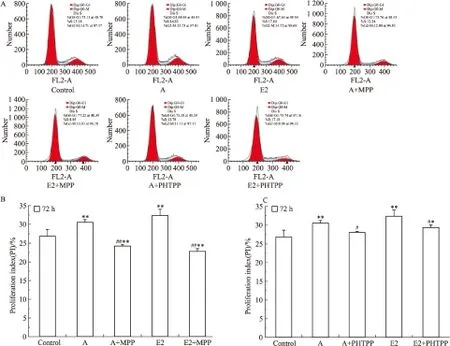
Fig 9 Effects of acacetin, E2, ERα inhibitor and ERβ inhibitor on cell cycle of T47D cells
A:Cell cycle distribution; B: ERα inhibitor(MPP);C:ERβ inhibitor(PHTPP).*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsacacetin or E2 group.
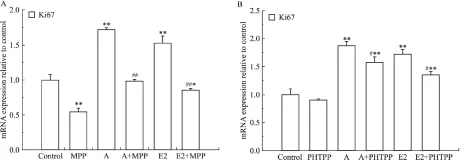
Fig 10 Effects of acacetin, E2, ERα inhibitor and ERβ inhibitor on Ki67 mRNA expression in T47D cells
A:ERα inhibitor(MPP);B:ERβ inhibitor(PHTPP).*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsacacetin or E2 group.
研究表明,雌激素通过ERs的基因组途径或非基因组途径,调控某些分子的表达来影响细胞的分化、增殖、凋亡逃避和侵袭转移等。Han等[14]发现在乳腺癌中,E2可以通过ERα途径,进而诱导LRP16基因表达增加,调节E-cadherin的表达,进一步影响乳腺癌的侵袭能力。Stettner等[15]发现,E2可以通过对ERK1/2的快速磷酸化,调节Bcl-2的表达,促进甲状腺细胞的增殖,而这种作用与ERα表达呈正相关。本实验发现,刺槐素及E2可上调雌激素受体的表达,与单用刺槐素组相比,刺槐素联合MPP组中ERα的mRNA和蛋白表达有明显降低,与MPP组相比,刺槐素联合MPP组中ERα的mRNA和蛋白表达明显升高,而刺槐素联合PHTPP处理可明显降低ERβ的mRNA和蛋白表达。这说明刺槐素的雌激素样作用可能通过上调ERα蛋白表达,影响ER受体通路,进而促进细胞增殖。
目前的大量研究报道表明,在一定浓度范围内,黄酮类化合物会促进肿瘤细胞增殖。已有研究表明,雌激素、大豆异黄酮类化合物在一定浓度范围内均具有促癌细胞增殖作用,即雌激素样活性。据报道,刺槐素、染料木素和其他植物雌激素的化学结构与雌激素类似,具有雌激素样活性,其中刺槐素用于乳腺癌的治疗已经引起越来越多的关注。因此,本课题通过研究低剂量的刺槐素对雌激素依赖性肿瘤细胞T47D增殖的影响,揭示刺槐素发挥雌激素样作用的机制,为植物雌激素产品的开发和临床妇科用药提供了实验依据。
[1] Sarkar S, Kanoi A, Bain J, et al. Correlation between cyclin D1 expression and standard clinicopathological variables in invasive breast cancer in Eastern India[J].AsianPACJCancer,2015,4(4):155-9.
[2] Hertog M G, Hollman P C, Katan MB, et al. Intake of potentially anticarcinogenic flavonoids and their determinants in adults in the Netherlands[J].NutrCancer,1993,20(1):21-9.
[3] 沈丽霞, 赵丕文, 牛建昭, 等. 补骨脂素对人类乳腺癌细胞增殖作用的影响[J]. 中国药理学通报, 2007, 23(11): 1448-51.
[3] Shen L X, Zhao P W, Niu J Z et al. Effect of psoralen on proliferation of human breast carcinoma cells[J].ChinPharmacolBull, 2007, 23(11):1448 -51.
[4] Warat M, Szliszka E, Korzonek-Szlacheta I, et al. Apigenin and acacetin inhibit tumor necrosis factor-related apoptosis-inducing ligand receptor-1(TRAIL-R1) on activated RAW264.7 macrophages[J].IntJMolSci,2014,15(7):11510-22.
[5] Hsu Y L, Kuo P L, Liu C F, et al. Acacetin-induced cell cycle arrest and apoptosis in human non-small cell lung cancer A549 cells[J].CancerLett,2004, 212(1):53-60.
[6] Boege F, Straub T, Kehr A, et al. Selected novel flavones inhibit the DNA binding or the DNA religation step of eukaryotic topoisomerase I[J].JBiolChem,1996, 271(4):2262- 70.
[7] Kuiper G G, Lemmen J G, Carlsson B, et al. Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor[J].Endocrinology,1998,139(10):4252-63.
[8] Vichai V, Kirtikara K. Sulforhodamine B colorimetric assay for cytotoxicity screening[J].NatProtoc,2006,1(3):1112-6.
[9] 平芳芳, 王月琴, 张敏敏, 等. Hsp90抑制剂FS-108抑制癌基因依赖肿瘤细胞增殖及运动的机制研究[J]. 中国药理学通报, 2016, 32(10):1357-63.
[9] Ping F F, Wang Y Q, Zhang M M, et al. FS-108, an Hsp90 inhibitor, impairs survival and motility of oncogene addicted cancer cells[J].ChinPharmacolBull, 2016, 32(10): 1357-63.
[10]王艳明, 刘 瑛, 阎新燕, 等. 甘草查尔酮A抑制小鼠黑色素瘤B16F10细胞增殖机制研究[J]. 中国药理学通报, 2015, 31(7): 967-72.
[10]Wang Y M, Liu Y, Yan X Y,et al. Inhibitory effects of Licochalcone A on proliferation of melanoma B16F10 cells[J].ChinPharmacolBull,2015, 31(7): 967-72.
[11]Sun J, Chen C, Wei W, et al. Associations and indications of Ki67 expression with clinicopathological parameters and molecular subtypes in invasive breast cancer: a population-based study[J].OncolLett,2015, 10(3):1741-8.
[12]沈丽霞, 董晓华, 李 炜, 等. 槲皮素、补骨脂素对乳腺癌细胞株MCF-7增殖的影响[J]. 中国药理学通报, 2009,25(5):601-5.
[12]Shen L X, Dong X H, Li W, et al. Effect of quercetin and psoralen on proliferation in MCF-7 cells[J].ChinPharmacolBull,2009,25(5):601-5.
[13]陈晓明, 倪 峰. 植物黄酮类化合物对机体免疫调节作用研究进展[J]. 福建中医学院学报, 2010,20(2): 69-70.
[13]Chen X M, Ni F. Research progress of flavonoids on the immunomodulatory effects[J].FujianUnivTCM,2010, 20(2):69-70.
[14]Han W D, Si Y L, Zhao Y L. GC-rich promoter elements maximally confers estrogen-induced transactivation of LRP16 gene through ERalhpa/Spl interaction in MCF-7 cells[J].JSteroidBiochemMolBiol, 2008, 109(1-2):47-56.
[15]Stettner M, Kaulfuss S, Burfeind P,et al. The relevance of estrogen receptor-beta expression to the antiproliferative effects observed with histone deacetylase inhibitors and phytoestrgens in prostate cancer treatment[J].MolCancerTher, 2007, 6(10): 2626-33.
Effects of acacetin on T47D cell proliferation
SI Ling-ling1, MA Jun2, REN Huan-huan1, REN Bo-xue1,LI De-fang2,ZHENG Qiu-sheng1,2
(1.KeyLaboratoryofXinjiangEndemicPhytomedicineResources,MinistryofEducation,SchoolofPharmacy,ShiheziUniversity,ShiheziXinjiang832002,China;2.BinzhouMedicalUniversity,YantaiShandong264005,China)
Aim To investigate the effect of acacetin on cell proliferation and the influence of acacetin on estrogen receptor expressioninvitro.Methods The proliferation rates and the cell cycle changes of acacetin-treated T47D cells were measured by sulforhodamine B(SRB) assay and flow cytometry, respectively. Moreover, the mRNA expressions of estrogen receptor-alpha(ERα), estrogen receptor-beta(ERβ) and proliferating antigen(Ki67) were determined by quantitative real time PCR(qPCR). Western blot was employed to detect the ERα and ERβ protein expression.Results Acacetin significantly promoted the proliferation and increased the amount of cells arrested in S and G2/M phase under the concentration of 0.001~10 μmol·L-1. Ki67 mRNA level and the ERα protein level in T47D cells were remarkably upregulated after acacetin treatment. To clarify which estrogen receptors played a role in acacetin induced the proliferation of T47D cells, the combination treatment of acacetin and ERα inhibitor(MPP)/ERβ inhibitor(PHTPP) was employed. We found that MPP could reverse the cell proliferation, the cell arrested in S and G2/M phase and the increased Ki67 mRNA level induced by acacetin. PHTPP also alleviated the T47D cell proliferation induced by acacetin, whereas no significant changes were found in cell cycle and Ki67 mRNA level.Conclusion Acacetin stimulates the cell proliferation of T47D cells in the concentration from 0.001 μmol·L-1to 10 μmol·L-1, which is mainly mediated by ERα.
acacetin; estrogen; T47D cell; estrogen receptor alpha; estrogen receptor beta; estrogenic effects; cell proliferation
时间:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.044.html
2016-10-31,
2016-11-28
滨州医学院科研启动基金项目(No BY2014KYQD01);国家自然科学基金资助项目(No 31471338);山东省高等学校优势学科人才团队培育计划
司玲玲(1990-),女,硕士生,研究方向:肿瘤药理学,E-mail:1481570144@qq.com; 郑秋生(1968-),男,博士,教授,研究方向:药理学,通讯作者,E-mail: zqsyt@ sohu.com
10.3969/j.issn.1001-1978.2017.02.022
A
1001-1978(2017)02-0260-08
R284.1;R329.24;R392.11;R737.9;R977.12
