护理干预在食管癌术后早期营养支持治疗中的应用
2017-02-25刘薇
刘 薇
护理干预在食管癌术后早期营养支持治疗中的应用
刘 薇
[目的]探讨护理干预在食管癌术后早期营养支持治疗中的应用效果。[方法]将2014年5月—2015年5月行食管癌根治术的204例病人随机分为两组各102例,对照组术后常规禁食,给予肠外营养支持及相关护理;观察组早期行肠内外营养支持治疗及护理干预,术后第8天比较两组营养状态、免疫功能、胃肠功能恢复及并发症发生情况。[结果]术后第8天,观察组血清前清蛋白(33.24 g/L±3.28 g/L)、清蛋白(32.78 g/L±4.14 g/L)、血清免疫球蛋白IgA(2.52 g/L±0.47 g/L)、IgG(13.52 g/L±1.44 g/L)、IgM(1.72 g/L±0.36 g/L)高于对照组血清前清蛋白(30.45 g/L±3.32 g/L)、清蛋白(30.21 g/L±3.21 g/L)血清免疫球蛋白IgA(2.21 g/L±0.40 g/L)、IgG(12.46 g/L±1.16 g/L)、IgM(1.61 g/L±0.28 g/L),两组比较差异有统计学意义(P<0.05);观察组病人肠鸣音恢复时间(63.63 h±6.37 h)、肛门排气时间(68.74 h±9.53 h)、肛门排便时间(65.59 h±8.75 h) ,对照组肠鸣音恢复时间(84.37 h±8.39 h)、肛门排气时间(115.37 h±12.52 h)、肛门排便时间(114.69 h±11.75 h),两组比较差异有统计学意义(P<0.01);两组病人并发症发生率比较差异无统计学意义(P>0.05)。[结论]早期肠内外营养支持治疗联合护理干预能有效改善病人营养状态,提高免疫功能,促进胃肠道功能恢复,且不增加并发症发生率。
食管癌;肠内营养;肠外营养;早期干预;营养支持
食管癌是中老年病人常见的一种消化道恶性肿瘤,早期无典型症状,仅有轻度不适,往往贻误治疗时机;晚期食管癌病人临床表现为进行性加重的吞咽困难、胸骨后疼痛和肿瘤恶病质状态[1]。食管癌根治术是食管癌主要手术方式,创伤较大,原始胃或空肠组织需要完全适应食管的生理需要,主张术后进行肠外营养支持治疗、短期内禁食及胃肠减压[2]。近年来研究发现,术后早期肠内营养有助于术后胃肠功能恢复[3]。本研究以此为背景,探究食管癌术后早期肠内外营养支持治疗配合护理干预的临床效果。
1 资料与方法
1.1 临床资料 选择我院2014年5月—2015年5月行食管癌根治术的204例病人为研究对象,采用随机数字表法分为观察组和对照组各102例。观察组中男54例,女48例;年龄57岁~81岁(64.68岁±6.75岁);肿瘤类型:隆起型32例,蕈伞型32例,狭窄型21例,浸润型17例;肿瘤分期:Ⅱa期30例,Ⅱb期37例,Ⅲ期35例。对照组中,男55例,女47例;年龄56岁~82岁(64.96岁±6.28岁);肿瘤类型:隆起型33例,蕈伞型33例,狭窄型20例,浸润型16例;肿瘤分期:Ⅱa期32例,Ⅱb期36例,Ⅲ期34例。两组病人一般资料比较差异无统计学意义(P<0.05)。
1.2 纳入标准与排除标准 纳入标准:①所有病人均给予食管癌根治术;②年龄56岁~82岁;③病人有自主行为能力,能够知晓并配合本次研究,签署知情同意书。排除标准:①合并严重心、肝、肾功能障碍及危及生命的各类疾病;②肿瘤晚期全身播散病人;③胃肠道其他疾病或影响消化吸收功能的疾病。
1.3 营养支持方法
1.3.1 对照组 术后常规禁食、胃肠减压,静脉内营养补充葡萄糖、复方氨基酸、脂肪乳、维生素等,总热量:125.52 kJ/(kg·d),连续营养支持8 d[4]。
1.3.2 观察组 采取肠内外营养配合支持治疗:使用Fresenius Kabi AG公司经鼻喂养管,经鼻插管,将肠内营养管放置于十二指肠悬韧带(Treize韧带)远端20 cm~30 cm处固定。术后第1天滴入生理盐水250 mL(滴注速度25 mL/h~50 mL/h),第2天经喂养管输入泵泵入500 mL(泵入速度30 mL/h~40 mL/h)肠内营养混悬液(SP)——百普力[纽迪希亚制药(无锡)有限公司,批号:1306045],第3天~第4天滴入1000 mL/d(滴注速度50 mL/h~60 mL/h),第5天~第8天滴入1 500 mL(滴注速度80 mL/h~100 mL/h),之后再根据病人适应状况、舒适程度逐渐加量[5]。肠内营养量不足以满足病人基本营养需求时,不足的部分用肠外静脉营养补充。
1.4 护理方法
1.4.1 对照组 实行肠外静脉营养的相应护理,主要是静脉导管相关护理,每日定期消毒预防输液性感染。
1.4.2 观察组 病人进行肠内外营养支持治疗的同时,实施相应的护理干预措施。将肠内营养液的温度控制在38 ℃~40 ℃,防止腹泻及痉挛性腹痛[6]。每隔4 h进行1次鼻饲管冲洗,以保持管道通畅,输入肠内营养的同时密切观察病人舒适程度及是否出现不良反应,调节输注速度,保持最佳状态。此外,食管癌病人术前即存在进食困难和一定程度的营养不良,术后病人对早期肠内营养可能存在畏惧心理,护士应对病人及家属进行健康宣教,介绍肠内营养的优点,鼓励病人配合肠内营养[7]。十二指肠置管应使用蝶形胶布固定,每日更换并消毒,防止医源性感染。仔细查看引流液的量及颜色,根据引流量调节肠内营养的量及速度。给予肠内营养时,应将病人床头抬高30°~45°,防止食管反流引起误吸[8]。经常清理病人口腔,防止口腔定植细菌下行感染。鼓励病人适当运动,以促进胃肠功能早期恢复。
1.5 观察指标
1.5.1 营养学指标 术前及术后第8天采集空腹静脉血4 mL,3 000 r/min离心10 min(离心半径3 cm)取血清,采用日立7600全自动生化分析仪检测血清前清蛋白(Prealbumin,PA)、清蛋白(albumin,ALB)水平。检测方法:酶联免疫吸附法,所有试剂均购自北京晶美生物工程有限公司。
1.5.2 免疫功能 术前、术后第8天,采集空腹静脉血4 mL,3 000 r/min离心10 min(离心半径3 cm)取血清,检测血清免疫球蛋白(IgG、IgA、IgM)的含量,检测方法:散射比浊法,所有试剂均购自北京晶美生物工程有限公司。
1.5.3 胃肠功能 统计两组病人肠鸣音恢复时间、肛门排气时间和肛门排便时间。
1.5.4 并发症 包括腹胀、恶心呕吐、出血、感染等并发症发生情况。
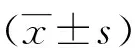
2 结果
2.1 两组手术前后营养学指标比较(见表1)
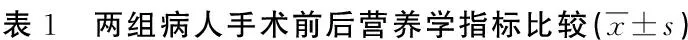
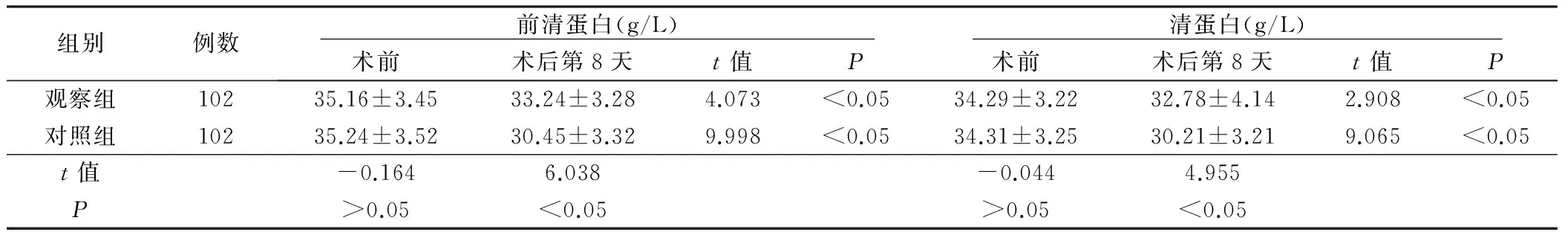
组别例数 前清蛋白(g/L) 术前术后第8天t值P 清蛋白(g/L) 术前术后第8天t值P观察组10235.16±3.4533.24±3.284.073<0.0534.29±3.2232.78±4.142.908<0.05对照组10235.24±3.5230.45±3.329.998<0.0534.31±3.2530.21±3.219.065<0.05t值-0.1646.038-0.0444.955P>0.05<0.05>0.05<0.05
2.2 两组手术前后免疫功能指标比较(见表2)
g/L
2.3 两组并发症发生情况比较(见表3)

表3 两组并发症发生情况比较 例(%)
2.4 两组胃肠功能恢复情况比较(见表4)
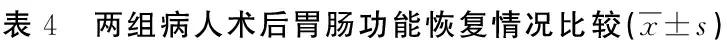
h
3 讨论
食管癌根治术切除肿瘤组织及所在节段的食管,并取用胃或空肠替代食管组织,根据病变部位不同选择开胸或不开胸[9]。既往研究认为,该手术胃肠道恢复期至少4 d,4 d后才能给予肠内营养。最新研究显示:小肠的蠕动和吸收功能在术后6 h就能得到有效恢复,可以接受肠内营养,仅胃组织对麻醉的恢复较慢。且长期禁食对小肠的功能损伤较大,破坏肠道正常菌群,不利于病人远期营养状态及免疫功能的恢复[10]。早期肠内营养有助于维持肠道正常菌群,有利于小肠吸收功能的恢复,能够促进病人营养的吸收,对改善病人营养状态和免疫功能效果显著。本研究中,对照组采用传统的早期肠外静脉营养,8 d后给予肠内营养,观察组术后第1天即给予肠内营养,逐渐加量,直至病人完全适应肠内营养。术后早期肠内营养可以为肠道提供营养素,能够有效改善病人营养状况,调节免疫功能,增强抵抗感染的能力。本研究中,观察组术后第8天血清前清蛋白、清蛋白、免疫球蛋白(IgG、IgA、IgM)均明显高于对照组,国内外学者也有类似的报道[11-12],提示早期肠内外营养配合有利于提高病人营养状态和免疫功能。
针对早期肠内外营养支持治疗实施相应的护理干预措施,如将肠内营养液温度调节到适于人体的温度,能减少对胃肠道的刺激;根据引流液的量调节输注速度,能保证病人的最佳耐受情况[13]。另外,帮助及鼓励病人早期下床运动也能促进胃肠蠕动。本研究中,观察组肠鸣音恢复时间、肛门排气时间和肛门排便时间均明显短于对照组,说明早期肠内外营养配合相关护理措施有助于病人胃肠道功能的恢复。肠内营养常见的并发症有腹胀、恶心、呕吐、出血、感染[14]。我院实施肠内营养前常规口服蓖麻油,促进胃肠道通畅,加上其他相应护理措施,肠内营养并发症显著降低。
本研究结果表明,早期肠内外营养支持有助于改善病人营养及免疫状态,促进胃肠道功能恢复,且不增加并发症发生率,护理干预有助于提高营养支持的临床效果。需要指出的是,本研究所设计的肠内外营养支持未与病人体征有效融合起来,护理干预也未做到个性化,有待于今后扩大样本进行进一步的研究。
[1] Wang WP,Yan XL,Ni YF,etal.Effects of lipid emulsions in parenteral nutrition of esophageal cancer surgical patients receiving enteral nutrition:a comparative analysis[J].Nutrients,2013,6(1):111-123.
[2] 蒋占鑫.小切口胸段食管癌根治术与标准开胸手术治疗食管癌的临床疗效分析[J].中国肿瘤临床与康复,2013,20(10):1128-1129.
[3] Filip B,Scarpa M,Cavallin F,etal.Postoperative outcome after oesophagectomy for cancer:nutritional status is the missing ring in the current prognostic score[J].Eur J Surg Oncol,2015,41(6):787-794.
[4] 施赛磊,李方,袁慧.食管癌患者术后联合营养支持的护理[J].江苏医药,2015,41(24):3070-3071.
[5] 何菊芳,李静辉,燕丽丽,等.食管癌术后早期肠内、外配合营养支持治疗的临床研究[J].中国药物经济学,2013(9):197-198;206.
[6] Xu M,Liu C,Guo M,etal.Combined laparoscopic-thoracoscopic esophagectomy and intrathoracic esophagogastric anastomsis[J].J Thorac Dis,2013,5(6):895-897.
[7] 陆红艳,虞桂平.早期营养支持治疗和护理干预对食管癌术后胃肠功能的影响[J].南昌大学学报(医学版),2013,53(11):56-59.
[8] 谭维静.食管癌术后早期肠内营养的护理[J].现代医药卫生,2013,29(13):2034-2035.
[9] 夏晓明,施仁忠,张亚锋.食管癌术后早期肠内营养对患者免疫功能的影响[J].山东医药,2012,52(18):38-39.
[10] 郝彩琴,王耀琴.食管癌术后非正常终止肠内营养的原因分析和护理[J].护理研究,2012,26(11C):3130-3131.
[11] 杨东杰,何伟玲,王亮,等.术后早期经口进食对结直肠癌术后体液免疫功能的影响[J].中华胃肠外科杂志,2013,16(11):1051 -1054.
[12] Tsuda Y,Morita M,Saeki H,etal.Esophagectomy-related thoracic duct injury detected by lymphoscintigraphy with(99m)Tc-diethylenetriamine pentaacetic acid-human serum albumin:report of a case[J].Surg Today,2014,45(4):517-521.
[13] 靳雁,郭小花,袁娟,等.持续质量改进在食管癌患者术后肠内营养的应用[J].护士进修杂志,2011,26(21):1945-1946.
[14] 张梅,陈淑娜.食管癌术后患者肠内营养并发症的预防性护理[J].山东医药,2011,51(26):89.
(本文编辑张建华)
Application of nursing intervention in early postoperative nutritional support treatment for esophageal cancer patients after surgery
Liu Wei
(First people’s Hospitol of Guangyuan City of Sichuan Province)
Objective:To probe into the application effect of nursing intervention for early nutritional support therapy of esophageal cancer patients after surgery.Methods:A total of 204 patients with esophageal cancer who underwent radical surgery from May 2014 to May 2015 were randomly divided into two groups,102 cases in each.The patients in control group received the postoperative conventional fasting,parenteral nutrition support and related care.The patients in observation group were given early postoperative enteral and parenteral nutrition therapy and nursing intervention.On the eighth day after surgery,the nutritional status,immune function,gastrointestinal function recovery and complications were compared between both groups.Results:On the 8th day after operation,serum prealbumin(33.24 g/L±3.28 g/L),albumin(32.78 g/L±4.14 g/L),serum immunoglobulin IgA(2.52 g/L±0.47 g/L),IgG(13.52 g/L±1.44 g/L) and IgM(1.72 g/L±0.36 g/L) in observation group were higher than those in control group,serum prealbumin(30.45 g/L±3.32g /L),albumin(30.21 g/L±3.21g/L),serum immunoglobulin IgA(2.21 g/L±0.28 g/L ),IgG(12.46 g/L±1.16 g/L),IgM(1.61 g/L±0.28 g/L).The difference between the two groups was statistically significant(P<0.05).The recovery time of bowel sounds(63.63 h±6.37 h),anal exhaust time(68.74 h±9.53 h),defecation time(65.59 h±8.75 h) of patients in observation group were better than those in control group,recovery time of bowel sounds(84.37 h±8.39 h),anal exhaust time(115.37 h±12.52 h),anal exhaust time(114.69 h±11.75 h).The difference between the two groups was statistically significant(P<0.01).There was no statistically significant difference in the incidence of complications between the two groups(P>0.05).Conclusions:Early enteral and parenteral nutrition therapy combined with nursing intervention can effectively improve the nutritional status of patients,improve immune function and promote gastrointestinal function recovery,and cannot increase the incidence of complications.
esophageal cancer;enteral nutrition;parenteral nutrition;early intervention;nutritional support
四川省广元市科技基金项目,编号:广科成果2014—14。
刘薇,副主任护师,本科,单位:628000,四川省广元市第一人民医院。
R473.73
A
10.3969/j.issn.1009-6493.2017.06.012
1009-6493(2017)06-0683-04
2016-06-22;
2017-02-03)
引用信息 刘薇.护理干预在食管癌术后早期营养支持治疗中的应用[J].护理研究,2017,31(6):683-686.
