三叉神经痛患者半月节射频热凝术前后静息态fMRI的变化
2017-02-22杨立强唐元章何亮亮公维义倪家骧首都医科大学宣武医院疼痛科北京100053
杨立强,窦 智,唐元章,何亮亮,公维义,倪家骧(首都医科大学宣武医院疼痛科,北京 100053)
三叉神经痛患者半月节射频热凝术前后静息态fMRI的变化
杨立强,窦 智,唐元章,何亮亮,公维义,倪家骧*
(首都医科大学宣武医院疼痛科,北京 100053)
目的 利用功能MR研究三叉神经痛患者半月节射频热凝术(PRT)前后脑功能局部一致性(ReHo)变化。方法 对31例接受PRT手术的三叉神经痛患者在术前1周及术后6个月分别进行MR扫描,采集其大脑结构及静息态功能图像;同时记录患者的疼痛视觉模拟量表(VAS)评分、面部麻木程度及患病时间。比较患者手术前后全脑ReHo值出现显著变化的脑区,再将这些脑区的平均ReHo值与临床观察指标进行相关分析。结果 与术前相比,患者术后右侧梭状回(FG)和双侧前扣带回(ACC)的ReHo值显著增高(P均<0.05),而左侧顶下小叶(IPL)、右侧距状回、右侧颞中回(MTG)、左侧中央后回(PoCG)以及左侧岛叶的ReHo值显著降低(P均<0.05)。左侧PoCG的ReHo值与手术前后VAS评分呈正相关,术前右侧MTG的ReHo值与手术前后VAS的变化值呈负相关。结论 PRT术后多个脑区的ReHo出现显著变化,这些区域与痛觉感知、情感表达及情绪体验密切相关,其中左侧PoCG具有作为靶点判断疼痛部位及评估疼痛强度的潜在价值。
三叉神经痛;磁共振成像;局部一致性;经皮穿刺射频热凝术
三叉神经痛是一种常见的头面部疼痛性疾病,以三叉神经分布区发作性电击样疼痛为特征。尽管目前三叉神经半月节经皮穿刺射频热凝(percutaneous radiofrequency thermocoagulation, PRT)术是三叉神经痛最为常用的微创治疗技术,但仍有5%~10%的患者术后疼痛不能有效缓解,且术后10年的复发率高达50%[1-2]。已有研究[3]表明,三叉神经痛患者大脑结构及功能已发生特异性改变。Moisset等[3]发现刺激三叉神经痛患者的扳机点会引起大脑一些特定区域的激活,而PRT后再刺激原扳机点激活的大脑区域显著减少。关于三叉神经痛患者PRT术前、术后大脑静息状态下自发性活动的变化尚未见报道。本研究旨在采用fMRI技术,通过比较手术前后静息态大脑局部一致性(regional homogeneity, ReHo)变化,来分析PRT术对三叉神经痛患者脑功能活动的影响。
1 资料与方法
1.1一般资料 收集2015年6月—2015年12月在我院疼痛科接受PRT术的患者31例,年龄31~81岁,平均(60.1±10.8)岁,其中男12例,女19例。纳入标准:①符合国际头痛疾病分类-Ⅱ(2004)中对于原发性三叉神经痛的诊断标准;②病变分支为右侧第Ⅱ和(或)第Ⅲ支;③患者为右利手;④疼痛为间歇性,有疼痛缓解期。排除标准:①患者同时患有其他慢性疼痛疾病;②患者有脑部手术史;③患者体内存在金属植入物,无法接受MR检查;④患者有幽闭恐惧症或其他精神疾病史。本研究经我院伦理委员会审核批准,所有患者入组前均签署知情同意书。
1.2仪器与方法
1.2.1 PRT手术流程 依照Hartel前入路法进行三叉神经半月节穿刺,采用CT扫描确定卵圆孔位置并设计进针点及最佳穿刺路径。穿刺成功后采用运动(2 Hz,1 ms)和感觉(50 Hz,0.1 ms)刺激确认或调整针尖位置,之后采用75℃温度热凝120 s。手术流程详见参考文献[4]。
1.2.2 MRI数据采集 对所有患者均采集2次MRI数据,第1次扫描在术前1周、第2次扫描在术后6个月。服用卡马西平或其他镇痛药的患者需停药1周再接受扫描,患者如在扫描期间出现疼痛发作,则在疼痛完全缓解后再次接受扫描。
采用Siemens Tim Trio 3.0T MR扫描仪,所有患者扫描前均用头垫控制头动,并戴耳机隔绝噪音。告知患者在扫描期间保持清醒、闭目,并且脑中不去想象特别的事物[5]。采用快速梯度回波序列采集高分辨率T1WI,TR 1 900 ms、TE 2.19 ms、FA 9°、FOV 256 mm×256 mm,层数176,体素1 mm×1 mm×1 mm。采用平面回波序列T2*加权成像采集功能图像,TR 2 000 ms、TE 30 ms、FA 90°、FOV 240 mm×240 mm、层数33、层厚4 mm。
1.2.3 临床指标采集 在第1次MR扫描前记录患者的患病时间、疼痛发作频率和疼痛发作时的疼痛强度等信息,其中疼痛强度采用视觉模拟量表(visual analogue scale, VAS)进行评价(0~10分),0分代表无痛,10分代表最严重的疼痛。在第2次MR扫描前评估患者的疼痛强度及面部麻木程度,分为0~Ⅳ级,0为无麻木感,Ⅳ级为痛性麻木[4]。
1.2.4 MR图像处理及ReHo计算 所有的图像预处理及ReHo计算、分析均采用MatLab(2014b)平台的SPM12及DPABI 2.1工具箱。图像预处理过程:去除前10个时间点的图像,将剩余的230个图像进行时间层矫正及头动矫正。剔除x、y、z轴任意方向上头动位移超过2 mm,或任意角度转动超过2°,或平均帧位移超过0.4 mm的图像[6-7],之后将结构像及功能像进行配准,并用DARTEL进行空间标准化[8]。
通过计算某一体素与其邻近26体素间的肯德尔一致性系数获得每个体素的ReHo值,除以全脑均值,并进行z变换获得标准化的ReHo值,最后用4 mm的高斯平滑核对图像进行空间平滑。
1.3 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,手术前后VAS评分比较采用配对t检验。采用配对t检验比较患者术前(ReHopre)与术后(ReHopost)每个体素的ReHo值,以单个体素P<0.005且簇内体素数量>54为差异有统计学意义,等价于用蒙特卡罗模拟进行AlphaSim矫正后P<0.05。对差异有统计学意义的脑区采用Pearson相关分析计算其ReHo值与临床观察指标之间的相关性,以P<0.05为差异有统计学意义。

表1 手术前后疼痛及麻木评分比较(n=31)

表2 手术前后ReHo值显著变化的脑区(P<0.05,Alphasim校正)
注:BA:Brodmann分区;MNI:蒙特利尔神经科学研究所
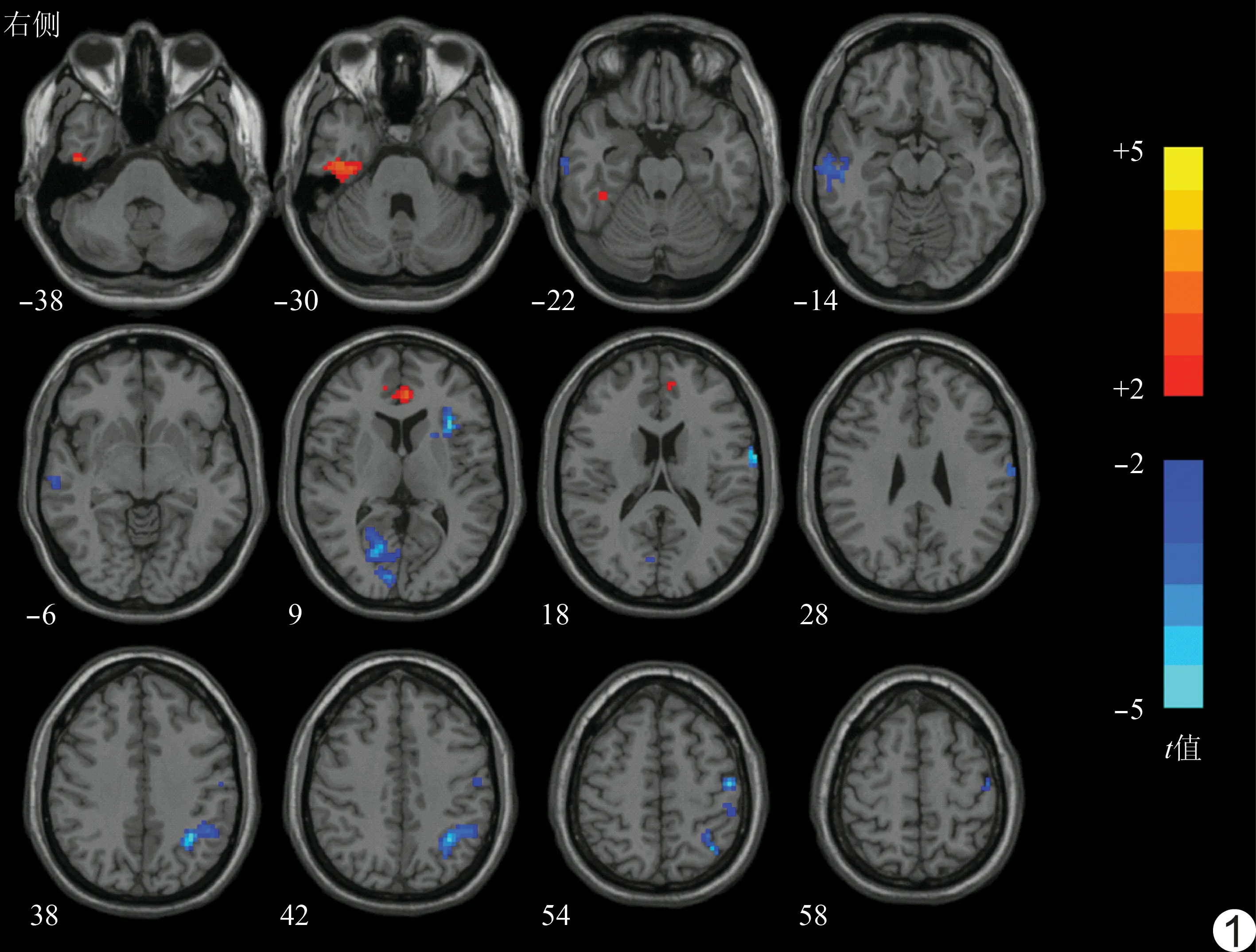
图1 手术前后ReHo值显著变化的脑区(轴位) 采用MNI坐标系,数字代表z轴坐标;色谱代表对手术前后ReHo进行配对t检验所得的t值
2 结果
2.1手术前后临床指标比较 31例患者中,术后29例疼痛显著缓解,2例患者疼痛中等程度缓解,6个月的随访期中,无患者复发。与术前相比,术后VAS评分显著降低(t=30.1,P<0.001),但术后患者均出现不同程度面部麻木(表1)。
2.2手术前后大脑fMRI结果比较 与术前相比,患者术后右侧梭状回(fusiform gyrus, FG)和双侧前扣带回(anterior cingulate cortex, ACC)的ReHo值显著增高(P<0.05,AlphaSim矫正),而左侧顶下小叶(inferior parietal lobule, IPL)、右侧距状回、右侧颞中回(middle temporal gyrus, MTG)、左侧中央后回(postcentral gyrus, PoCG)以及左侧岛叶的ReHo值显著降低(P<0.05,AlphaSim矫正)。见表2、图1。
2.3 ReHo与临床指标相关性分析 左侧PoCG的ReHo值与VAS评分呈显著正相关(术前:r=0.620,P<0.001;术后:r=0.379,P<0.05)。右侧MTG的ReHopre与手术前后VAS评分的差值(ΔVAS)呈显著负相关(r=-0.360,P<0.05)。患者病程长短以及术后面部麻木程度与各簇的ReHo值无明显相关性(图2)。
3 讨论
本研究发现三叉神经痛患者PRT手术前后静息状态下多个脑区的ReHo值出现显著变化。其中PoCG为主要躯体感觉皮层(primary somatosensory cortex, S1)所在区域,一直被认为是痛觉网络的重要组成部分。既往fMRI研究[9-10]表明,在多种疼痛疾病中(如三叉神经痛、带状疱疹后遗神经痛、慢性腰背痛)PoCG均会出现异常激活。本研究发现三叉神经痛患者术后PoCG的ReHo值出现显著降低,其中峰值点出现在头面部代表区。此外,PoCG的ReHo值还与VAS评分呈显著正相关,均表明PoCG在三叉神经痛的疼痛感知中有重要作用,且其还有作为靶点判断疼痛部位及评估疼痛强度的潜在价值。
除PoCG外,岛叶也被认为在急、慢性疼痛的感知过程中有至关重要的作用。Ostrowsley等[11]发现与健康对照相比,三叉神经痛患者无论在自发性疼痛还是刺激扳机点诱发疼痛时,岛叶的活动均显著增强。直接刺激岛叶也会诱发电击样疼痛,性质与三叉神经痛相似。Moisset等[3]发现即使是不存在痛觉超敏的三叉神经痛患者,轻触患侧皮肤也会引起岛叶的显著激活,但该现象在PRT术后会消失,这种岛叶的异常激活可能与患者对疼痛的过度预期有关。一项针对疼痛的结构及功能连接研究显示,岛叶的前部可能与疼痛的情感-认知维度有关[12]。本研究结果表明患者术后左侧岛叶前部的ReHo显著降低,与上述研究[12]结论一致。

图2 左侧PoCG(A)手术前后ReHo值对比及其与VAS评分的相关性散点图(B);右侧MTG手术前后ReHo值对比(C)及右侧MTG手术前ReHo值与ΔVAS的相关性(D) (*:P<0.05)
另一个与三叉神经痛的发病密切相关,且与岛叶存在紧密功能连接的区域是ACC。ACC和岛叶均为突显网络(salience network, SAN)的重要组成部分,在人类外部环境出现显著变化时激活[13]。在慢性疼痛患者中,ACC和岛叶前部之间的功能连接显著增强[14]。然而,ACC在三叉神经痛中的作用仍然存在争议,在自发性疼痛时,ACC的大部分区域均显著激活,对扳机点施加痛性刺激会引起双侧ACC的后部(BA 24和32区的尾侧部分)激活,但在静息态时ACC并无异常活动[3,15]。本研究发现术后患者双侧ACC的喙部(BA 32区的头侧部分)ReHo显著降低,与Becerra等[16]研究复杂性区域疼痛综合征患者治疗前后的ACC自发性活动变化结果很相似。表明ACC的不同部位可能在三叉神经痛的发病中起到不同的作用。
IPL和MTG位于后外侧皮层,是默认网络(default mode network, DMN)的三大主要成分之一。DMN是健康人群在静息状态下主要活动的脑功能网络,其后外侧成分参与疼痛认知及反刍行为的调节[17]。在慢性腰痛中,可发现DMN内部以及DMN-岛叶之间功能连接的增强。与健康对照相比,偏头痛患者DMN内部前额叶和颞叶之间的功能连接减弱,而DMN-岛叶之间的功能连接在头痛发作时显著增强。本研究发现三叉神经痛患者在PRT术后IPL和MTG的自发活动均减弱,然而这两个脑区之间功能连接的变化以及整个DMN内部功能活动变化仍需进一步探索。除自发活动减弱外,MTG术前的ReHo值与患者术后疼痛的缓解程度(ΔVAS)呈显著负相关,提示MTG的ReHo值可作为预测PRT手术疗效的生物学标记。
本研究中患者术后右侧FG的ReHo值显著升高,而该区域与面孔识别有关。本研究并未对患者施加视觉刺激,因此推测三叉神经痛患者存在自我面部感知功能的可逆性损伤,当疼痛缓解后,FG的功能又会逐渐恢复。不仅面孔识别,FG在慢性疼痛中可能还存在其他作用。术后疼痛会使同侧FG的活动增强,慢性腰痛患者的FG区域活动也显著增强,尤其当看到表现疼痛的图片时。偏头痛患者FG区域的结构及功能均出现异常改变,与健康对照相比,有视觉先兆的偏头痛患者FG的灰质含量显著增加,而无先兆偏头痛患者FG的灰质含量及功能活动均显著降低[18]。
本研究尚存在以下几点不足:首先,样本含量偏低,且未观察手术无效或术后复发的患者,因此无法针对这两种情况进行亚组分析。其次,本研究仅纳入了右侧患病的三叉神经痛患者,这可能会使结果中脑区的侧别产生偏倚。最后,ReHo虽然是目前研究大脑局部功能变化应用最为广泛的指标,但PRT手术对远距离区域之间功能连接的影响也应该进行探索。
综上所述,三叉神经痛患者在接受PRT手术后,大脑多个区域的功能活动会出现显著变化,且某些区域的激活强度与患者的疼痛程度密切相关,其中左侧PoCG具有作为靶点判断疼痛部位及评估疼痛强度的潜在价值。
[1] Gunther T, Gerganov VM, Stieglitz L, et al. Microvascular decompression for trigeminal neuralgia in the elderly: Long-term treatment outcome and comparison with younger patients. Neurosurgery, 2009,65(3):477-482.
[2] 韩嵩博,柳晨,李水清,等.CT引导下射频治疗慢性疼痛的进展.中国介入影像与治疗学,2012,9(9):701-703.
[3] Moisset X, Villain N, Ducreux D, et al. Functional brain imaging of trigeminal neuralgia. Eur J Pain, 2011,15(2):124-131.
[4] Tang YZ, Jin D, Bian JJ, et al. Long-term outcome of computed tomography-guided percutaneous radiofrequency thermocoagulation for classic trigeminal neuralgia patients older than 70 years. J Craniofac Surg, 2014,25(4):1292-1295.
[5] Li Y, Liang P, Jia X, et al. Abnormal regional homogeneity in Parkinson's disease:A resting state fMRI study. Clin Radiol, 2016,71(1):e28-e34.
[6] Yan CG, Cheung B, Kelly C, et al. A comprehensive assessment of regional variation in the impact of head micromovements on functional connectomics. Neuroimage, 2013,76:183-201.
[7] Power JD, Barnes KA, Snyder AZ, et al. Spurious but systematic correlations in functional connectivity MRI networks arise from subject motion.Neuroimage, 2012,59(3):2142-2154.
[8] Ashburner J. A fast diffeomorphic image registration algorithm.Neuroimage, 2007,38(1):95-113.
[9] Becerra L, Morris S, Bazes S, et al. Trigeminal neuropathic pain alters responses in CNS circuits to mechanical (brush) and thermal (cold and heat) stimuli.J Neurosci, 2006,26(42):10646-10657.
[10] Liu J, Hao Y, Du M, et al. Quantitative cerebral blood flow mapping and functional connectivity of postherpetic neuralgia pain: A perfusion fMRI study. Pain, 2013,154(1):110-118.
[11] Ostrowsky K, Magnin M, Ryvlin P, et al. Representation of pain and somatic sensation in the human insula: A study of responses to direct electrical cortical stimulation. Cereb Cortex, 2002,12(4):376-385.
[12] Craig AD. A new view of pain as a homeostatic emotion. Trends Neurosci, 2003,26(6):303-307.
[13] Kucyi A, Salomons TV, Davis KD. Mind wandering away from pain dynamically engages antinociceptive and default mode brain networks. Proc Natl Acad Sci U S A, 2013,110(46):18692-18697.
[14] Ichesco E, Quintero A, Clauw DJ, et al. Altered functional connectivity between the insula and the cingulate cortex in patients with temporomandibular disorder:A pilot study.Headache, 2012,52(3):441-454.
[15] Wang Y, Zhang X, Guan Q, et al. Altered regional homogeneity of spontaneous brain activity in idiopathic trigeminal neuralgia. Neuropsychiatr Dis Treat, 2015,11:2659-2666.
[16] Becerra L, Schwartzman RJ, Kiefer RT, et al. CNS measures of pain responses pre- and post-anesthetic ketamine in a patient with complex regional pain syndrome. Pain Med, 2015,16(12):2368-2385.
[17] Kucyi A, Moayedi M, Weissman-Fogel I, et al. Enhanced medial prefrontal-default mode network functional connectivity in chronic pain and its association with pain rumination. J Neurosci, 2014,34(11):3969-3975.
[18] Rocca MA, Messina R, Colombo B, et al. Structural brain MRI abnormalities in pediatric patients with migraine.J Neurol, 2014,261(2):350-357.
Changes of resting-state fMRI in trigeminal neuralgia after percutaneous radiofrequency thermocoagulation
YANGLiqiang,DOUZhi,TANGYuanzhang,HELiangliang,GONGWeiyi,NIJiaxiang*
(DepartmentofPainManagement,XuanwuHospital,CapitalMedicalUniversity,Beijing100053,China)
Objective To investigate regional homogeneity (ReHo) changes in patients with trigeminal neuralgia (TN) before and after percutaneous radiofrequency thermocoagulation (PRT) procedure by resting-state fMRI. Methods Totally 31 TN patients underwent PRT procedure underwent MR scans 1 week before and 6 months after surgery. The anatomical and resting-state functional images were acquired. Voxel-wise ReHo analysis was performed to detect the altered regional clusters after surgery. The correlations between the mean ReHo values of each significant cluster and clinical variables such as visual analogue scale (VAS) scores, degree of facial numbness and time of illness were analyzed. Results Compared with pre-surgical condition, patients after PRT procedure showed that the significant ReHo value increased in the right fusiform gyrus (FG) and bilateral anterior cingulate cortex (ACC, bothP<0.05), but decreased in the left inferior parietal lobule (IPL), right calcarine, right middle temporal gyrus (MTG), left postcentral gyrus (PoCG) and left insula (allP<0.05). There were positive correlation between ReHo in the left PoCG and VAS scores, and there were negative correlation between pre-surgical ReHo in the right MTG and VAS changes. Conclusion Alterations of ReHo post-surgical are found in several regions, which are related to sensory, affective and emotional processes. The left PoCG may play an important role in defining pain regions and monitoring pain intensities.
Trigeminal neuralgia; Magnetic resonance imaging; Regional homogeneity;Percutaneous radiofrequency thermocoagulation
北京市医院管理局临床医学发展专项——“扬帆”计划项目(ZYLX201507)。
杨立强(1976—),男,河北保定人,博士,副主任医师。研究方向:疼痛医学。E-mail: ylqsy@139.com
倪家骧,首都医科大学宣武医院疼痛科,100053。E-mail: nijiaxiang@263.net
2016-08-31
2016-10-21
10.13929/j.1672-8475.201608044
R745.11; R445.2
A
1672-8475(2017)02-0092-05
