静息态fMRI评估急性酒精暴露对恒河猴脑功能的影响
2017-02-22丁兆明余永强王海宝程文文安徽医科大学第一附属医院影像科安徽合肥230032
丁兆明,余永强,王海宝,程文文(安徽医科大学第一附属医院影像科,安徽 合肥 230032)
静息态fMRI评估急性酒精暴露对恒河猴脑功能的影响
丁兆明,余永强*,王海宝,程文文
(安徽医科大学第一附属医院影像科,安徽 合肥 230032)
目的 采用静息态fMRI基于分数低频振荡幅度(fALFF)方法评估急性酒精暴露后恒河猴脑功能改变。方法 分别对7只健康雄性恒河猴于静脉注射酒精前及注射后10、28、46 min进行BOLD fMRI序列及3D结构像扫描,采用fALFF算法获得并比较4个时间点fALFF差异的脑区。结果 4个时间点fALFF总体差异显著的脑区为右侧中央后回、右侧岛叶、右侧小脑、左侧海马旁回、双侧额下回、小脑蚓部、右枕叶、楔前叶、左侧缘上回(P均<0.05);静脉注射酒精后fALFF值减低的脑区为双侧额上回、右侧额下回、右侧梭状回、右侧角回、双侧颞上回、右枕叶、左侧外侧沟、左侧中央后回、左侧楔状叶、左侧丘脑、左侧岛叶、前扣带回(P均<0.05);静脉注射酒精后fALFF值增高的脑区为右侧额下回、右侧颞中回(P均<0.05)。结论 酒精暴露急性期脑代谢活动发生显著变化,主要涉及默认网络、奖赏及情绪加工系统、视听皮层等。
酒精中毒,急性;磁共振成像;恒河猴
急性酒精暴露会立刻引起脑神经元代谢和局部脑血流量的改变,进而导致认知控制、情感处理、工作记忆、感觉运动等功能紊乱[1]。神经影像学是研究急性酒精暴露脑功能改变的重要方法,但目前的试验设计基本采用单个时间点采集数据[2-4],这对酒精药理学的研究具有局限性。,Strang等[5-6]利用动脉质子自旋标记(arterial spin labeling,ASL)技术研究血液酒精浓度(blood alcohol concentration, BAC)上升期脑血流动力学改变,结果表明,酒精可导致全脑血流量增加,并且具有剂量依赖性。Weber等[7]对默认网络(default mode network, DMN)的研究采用口服酒精60 min及90 min两个时间点采集数据,结果表明两个时间点间DMN连接不同。Lahti等[8]报道,86%的急性酒精暴露者死于BAC下降期,因此对BAC下降期的神经药理学研究十分重要。本研究采用静息态fMRI基于分数低频振荡幅度(fractional amplitude of lowfrequency fluctuation, fALFF)评估BAC下降期恒河猴脑功能改变,并在静脉注射酒精后1 h内的3个时间点(10、28、46 min)采集数据[9],动态观察BAC下降期恒河猴脑功能变化。
1 材料与方法
1.1 实验动物 选取雄性恒河猴7只,由中国科学院昆明研究所提供,无酒精接触史,年龄(5.0±1.0)岁,体质量(8.0±2.0)kg,单笼喂养,自由进食、饮水。先饲养30天,以适应周围环境。
1.2 仪器与方法 采用GE Discovery 750W 3.0T MR扫描仪,头部32通道相控阵线圈。功能像采用BOLD 单次激发EPI序列行全脑轴位扫描,TE 35 ms,TR 2 000 ms,翻转角90°,FOV24 cm×24 cm,矩阵64×64,层厚2.5 mm,层距0.5 mm,层数26层。轴位三维解剖图像采用快速扰相梯度反转恢复序列扫描,TE 3.1 ms,TR 7.2 ms,翻转角8°,FOV 25.6 cm×25.6 cm。矩阵256×256,层厚1.0 mm,层数172层。所有实验动物均接受2次相同实验,间隔1周以上。实验采取静脉注射酒精前后的自身对照[5-6,9]设计。
禁食、禁水6 h后以95%戊巴比妥钠肌肉注射麻醉,剂量为1 ml/kg体质量,诱导期约15 min;确定动物处于麻醉状态后将其取出,若长时间未达麻醉状态,可在确保安全的情况下取出动物,并从腿部静脉适当补药,直至达麻醉状态;摆正动物体位,以海绵垫填充头部与线圈之间缝隙,并以橡胶塞封闭耳孔以降低噪声干扰,将呼吸、心率监控仪器置于最佳位置,观察显示器数据正常后,盖上被子保温。
首先进行BOLD MR扫描,获取基础静息态数据作为对照(0期),然后配置20度的酒精生理盐水溶液,并按照0.44 g/kg体质量静脉推注酒精生理盐水,推注时间5 min;推注酒精后10 min(Ⅰ期)、28 min(Ⅱ期)、46 min(Ⅲ期)时分别进行3次BOLD MR扫描,BOLD序列扫描结束再进行其他序列扫描,整个扫描过程约2 h。扫描过程中时刻观察动物呼吸心率变化,如出现明显升高,可经静脉适当补充麻醉药物。扫描结束后,将动物安全送回动物房,确定其清醒后方离开。
1.3 图像处理 采用基于MatLab 7.12(R2011a)的dpabi软件中的DPARSF 3.2 for monkey data及SPM12数据处理软件对静息态fMRI数据进行处理:图像首先由DICOM格式转换为NIFTI格式;然后剔除前10个时间点数据并进行头动校正,剔除头部平移>2.5 mm及转动>2.5°的数据;进行空间标准化,先将静息态功能像匹配到T1WI解剖图像上,再将T1WI图像配准到112RM-SL_T1_F99模板[10]进行标准化,以2 mm×2 mm×2 mm体素单元重采样;再进行高斯半高全宽(3 mm)平滑处理及去线性漂移、低频滤过处理,滤过活动频率范围为0.01~0.08 Hz的低频信号;采用Friston24去除协变量,包括去趋势线、头动参数、脑脊液、脑白质信号等;计算全脑fALFF值。通过MNI(Montreal Neurological Institute)坐标获取4个时间点fALFF有差异的脑区,再根据猴脑解剖图谱确定各脑区具体位置[11-12],利用MRIcro软件将这些脑区呈现出来。本实验共进行14次图像采集,符合要求的13次。
1.4统计学分析 采用SPM 12.0统计分析软件。不同时间点fALFF总体差异采用单因素方差分析,以P<0.05(非校正)及簇体积≥10个体素为差异有统计学意义。Ⅰ、Ⅱ、Ⅲ期与0期比较fALFF增加或减少脑区分析采用配对t检验,以P<0.05(非校正)及簇体积≥10个体素为差异有统计学意义;根据MNI坐标利用MRIcroN软件呈现差异有统计学意义的脑区。
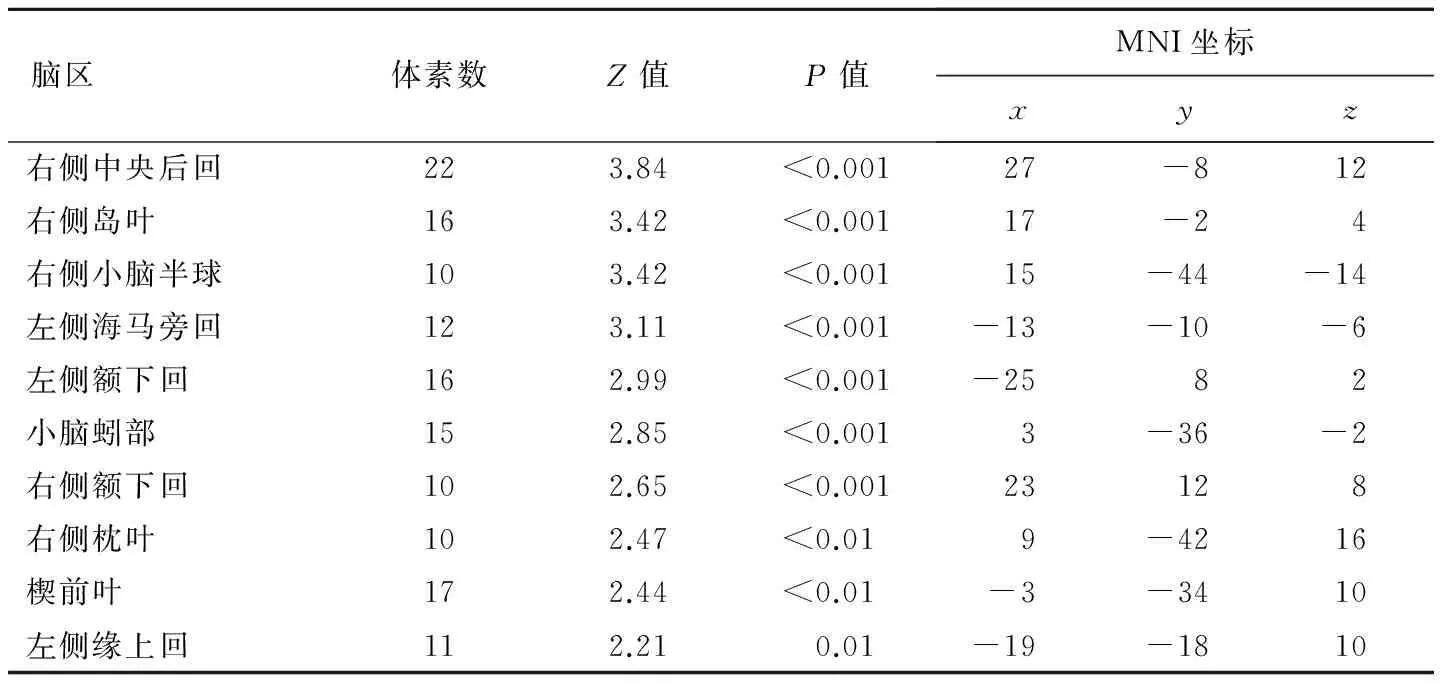
表1 4个时间点fALFF总体差异有统计学意义的脑区
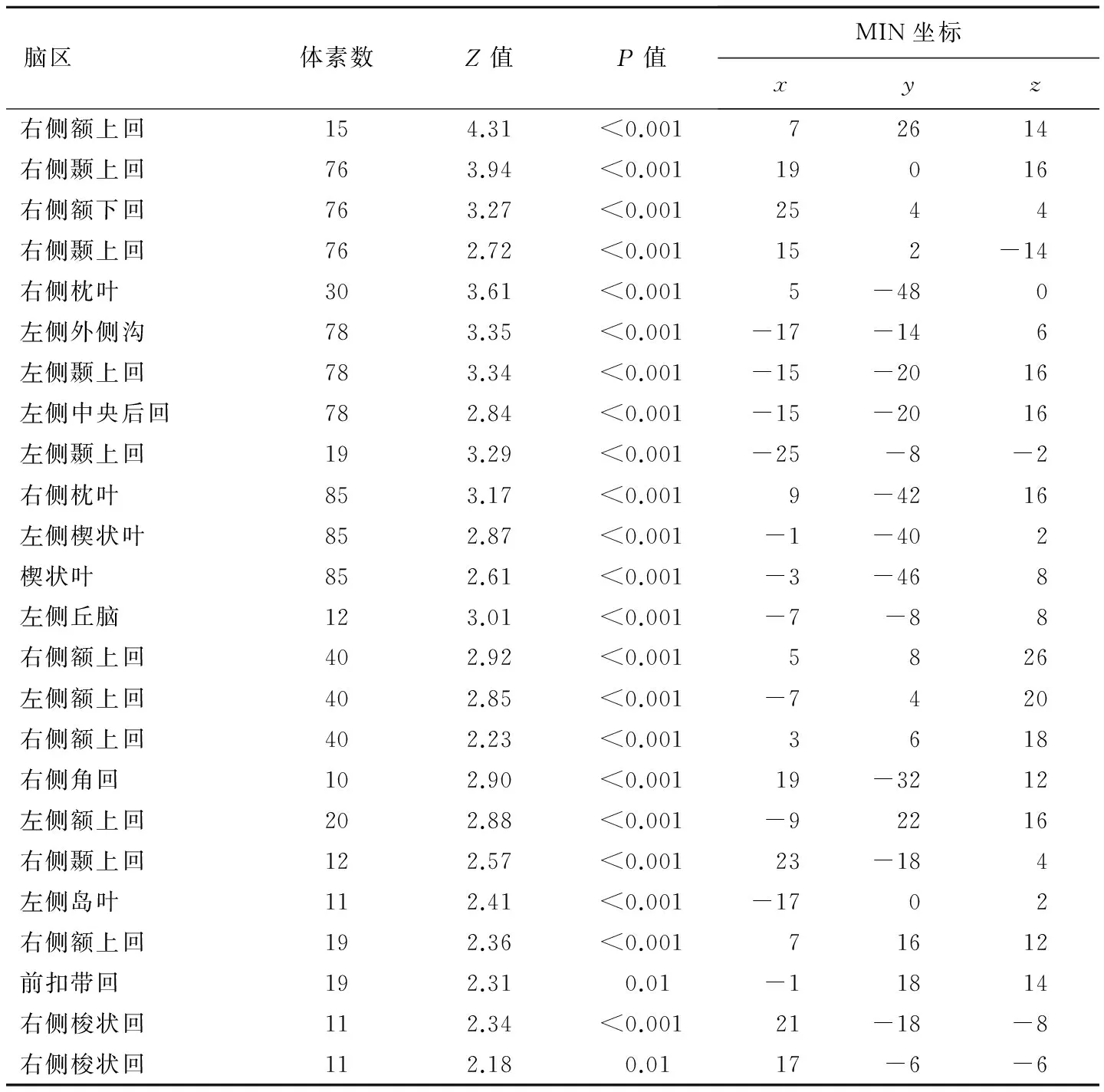
表2 静脉注射酒精后fALFF值减低的脑区

表3 静脉注射酒精后fALFF值增加的脑区
2 结果
4个时间点间fALFF总体差异有统计学意义的脑区为右侧中央后回、右侧岛叶、右侧小脑半球、左侧海马旁回、双侧额下回、小脑蚓部、右侧枕叶、楔前叶、左侧缘上回(簇体积≥10个体素,P<0.05),见表1、图1。
静脉注射酒精后fALFF值减低的脑区为双侧额上回、右侧额下回、右侧梭状回、右侧角回、双侧颞上回、右枕叶、左侧外侧沟、左侧中央后回、左侧楔状叶、左侧丘脑、左侧岛叶、前扣带回(簇体积≥10个体素,P均<0.05),见表2、图2。
静脉注射酒精后fALFF值增高的脑区为右侧额下回、右侧颞中回(体素≥10个,P值均<0.05),见表3、图3。
3 讨论
近年,静息态功能影像学用于神经药理学的研究已经取得重大进展,相比任务态,其操作简单、扫描时间短,避免了人为学习某项技能或执行特定任务时引起的个体差异,而且可以进行跨物种研究[13],为动物模型应用于神经药理学研究提供了便利。动物实验是基础研究的重要工具,其可以很好地控制许多人为不可控因素。非人灵长类动物模型对神经影像学研究有重要参考价值。研究[9]已证明,恒河猴DMN与人类具有相似性,且麻醉状态下网络连接仍具有完整性,这些均充分证明了此类模型应用于临床研究的可行性。Telesford等[9]报道,静脉注射1 g/kg体质量酒精10 min后,恒河猴静息态脑网络发生显著改变。目前可以确定的恒河猴DMN组成脑区有楔前叶、后扣带回、内侧前额叶皮层、颞上回[9]。本研究恒河猴DMN涉及的脑区双侧额上回、颞上回fALFF降低,楔前叶fALFF变化显著,fALFF降低提示区域神经元活动代谢减低,表明酒精急性期严重影响了DMN,与之前报道一致[2,7]。DMN功能改变也间接反映了急性酒精暴露后有关认知、情感、感觉运动等脑功能严重受损,这也解释了酒精中毒患者的一些异常表现如行为失控、外向、记忆丢失等。
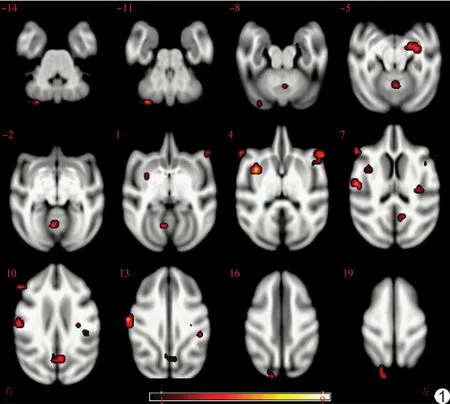
图1 4个时间点间fALFF总体差异有统计学意义的脑区
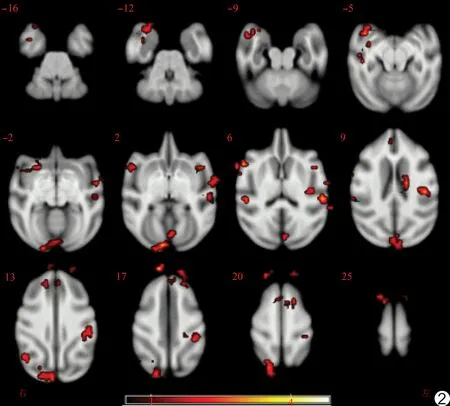
图2 静脉注射酒精后fALFF值减低的脑区
PET研究证实中等剂量酒精暴露会显著降低全脑葡萄糖代谢,对脑组织整体起抑制作用,但能增加纹状体(包括伏隔核)、杏仁核、岛叶、中脑的葡萄糖代谢水平,激活中脑边缘系统,同样的结论在任务态fMRI中也得到证实[1]。之前的研究大都采用单个时间点采集数据,这对酒精药理学的研究是不够的,本研究在静脉注射酒精后近1 h内设置3个时间点,动态、更长时间的观察酒精对脑神经元活动的影响[9]。研究发现fALFF减低脑区明显多于增加脑区,表明在静脉注射酒精后的3期时间内大部分脑区脑活动代谢减少,大脑活动整体受到抑制。此外,中脑边缘系统相关脑区左侧海马旁回fALFF增加,双侧岛叶fALFF发生改变,表明中脑边缘系统神经元代谢活动受到影响。本研究fALFF增加最明显的脑区为右侧额下回,额下回主要功能是与杏仁核一起参与对奖励/惩罚、情绪和动机的处理、加工,提示酒精可激活情绪加工系统。Bjork等[1]认为急性期酒精可能增加感觉区域内及区域间的功能连接,增强机体的环境线索/刺激奖赏学习功能,造成酒精依赖的复吸行为。Esposito等[14]报道酒精可增加视听网络固有连接;Spagnolli等[3]报道BAC为0.5 g/L时,左侧梭状回、左侧颞下回、左侧副胼胝体皮层BOLD信号显著减低,这些脑区参与组成腹侧视觉网络、奖赏回路。本研究中静脉注射酒精后的动物视听皮层相关脑区右侧枕叶、楔状叶及双侧颞上回fALFF变化明显,主要以减低为主,这些改变也再次表明饮酒时机体对外界环境的检测、处理功能发生改变。

图3 静脉注射酒精后fALFF值增加的脑区
酒精对神经元代谢的影响因素包括酒精浓度、曝光时间及曝光速率[15]。之前的研究主要采取口服酒精,但由于性别、年龄、遗传及第一代谢等因素导致个体差异很大,静脉注射酒精可以避免这些不利因素,特别是采用计算机辅助注射系统[5-6],可以控制酒精的浓度、升降速率及作用时间,这对药理学的研究至关重要。此外,酒精具有血管活性作用,酒精使血流量增加依赖于两个因素即自身扩血管作用和局部代谢引起的血流改变[6]。这使fMRI信号与实际脑代谢之间必然存在误差,且随着酒精剂量的增加这种误差增大,这也是目前该研究集中在中等剂量的原因。研究[9]指出,静息态脑网络研究已经确认额中回-后扣带回、顶叶-前额叶之间存在连接,但麻醉状态下却未发现,可能与麻醉剂的使用有关,故对麻醉剂的探讨也显得十分重要。
总之,酒精急性期全脑代谢活动发生显著变化,主要涉及默认网络、奖赏及情绪加工系统、视听皮层。
[1] Bjork JM, Gilman JM. The effects of acute alcohol administration on the human brain: Insights from neuroimaging. Neuropharmacology, 2014,84:101-110.
[2] Zheng H, Kong L, Chen L,et al. Acute effects of alcohol on the human brain: A resting -state fMRI study. Biomed Res Int, 2015,2015:947529.
[3] Spagnolli F, Cerini R, Cardobi N, et al. Brain modifications after acute alcohol consumption analyzed by resting state fMRI. Magn Reson Imaging, 2013,31(8):1325-1330.
[4] Tolentino NJ, Wierenga CE, Hall S, et al. Alcohol effects on cerebral blood flow in subjects with low and high responses to alcohol. Alcohol Clin Exp Res, 2011,35(6):1034-1040.
[5] Strang NM, Claus ED, Ramchandani VA, et al. Dose-dependent effects of intravenous alcohol administration on cerebral blood flow in young adults. Psychopharmacology (Berl), 2015,232(4):733-744.
[6] Marxen M, Gan G, Schwarz D, et al. Acute effects of alcohol on brain perfusion monitored with arterial spin labeling magnetic resonance imaging in young adults. J Cereb Blood Flow Metab, 2014,34(3):472-479.
[7] Weber AM, Soreni N, Noseworthy MD. A preliminary study on the effects of acute ethanol ingestion on default mode network and temporal fractal properties of the brain. MAGMA, 2014,27(4):291-301.
[8] Lahti A, Pitkäniemi J, Jones AW, et al. Cause and manner of death and phase of the blood alcohol curve. Forensic Sci Int, 2014,244:306-312.
[9] Telesford QK, Laurienti PJ, Friedman DP, et al. The effects of alcohol on the nonhuman primate brain: A network science approach to neuroimaging. Alcohol Clin Exp Res, 2013,37(11):1891-1900.
[10] McLaren DG, Kosmatka KJ, Oakes TR, et al. A population-average MRI-based atlas collection of the rhesus macaque. Neuroimage, 2009,45(1):52-59.
[11] Martin RF, Bowden DM. A stereotaxic template Atlas of the macaque brain for digital imaging and quantitative neuroanatomy. Neuroimage, 1996,4(2):119-150.
[12] Lewis JW, Van Essen DC. Corticocortical connections of visual, sensorimotor, and multimodal processing areas in the parietal lobe of the macaque monkey. J Comp Neurol, 2000,428(1):112-137.
[13] Khalili-Mahani N,van Osch MJ, de Rooij M, et al. Spatial heterogeneity of the relation between resting-state connectivity and blood flow: An important consideration for pharmacological studies. Hum Brain Mapp, 2014,35(3):929-942.
[14] Esposito F, Pignataro G, Di Renzo G, et al. Alcohol increases spontaneous BOLD signal fluctuations in the visual network. Neuroimage, 2010,53(2):534-543.
[15] Wetherill L, Morzorati SL, Foroud T, et al. Subjective perceptions associated with the ascending and descending slopes of breath alcohol exposure vary with recent drinking history. Alcohol Clin Exp Res, 2012,36(6):1050-1057.
Resting-state fMRI in evaluating acute effect of alcohol on healthy Rhesus brain
DINGZhaoming,YUYongqiang*,WANGHaibao,CHENGWenwen
(DepartmentofMedicalImaging,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230032,China)
Objective To assess the value of resting-state fMRI based on fractional amplitude of low-frequency fluctuation (fALFF) in detecting the acute effects of alcohol on healthy Rhesus brain. Methods Seven healthy Rhesus underwent BOLD resting-state fMRI and 3D structure imaging before and 10, 28, 46 min after intravenous injection of acute alcohol, and fALFF were used to investigate spontaneous neural activity in the resting state. Results Brain areas with significant difference of fALFF in 4 time points were right postcentral gyrus, right insula, right cerebellum, left parahippocampal gyrus, bilateral inferior frontal gyrus, cerebellar vermis, right occipital, left supramarginal gyrus, precuneus (allP<0.05). Brain areas with decreased fALFF were bilateral frontal gyrus, right inferior frontal gyrus, right fusiform gyrus, right angular gyrus, bilateral temporal gyrus, right occipital, left lateral sulcus, left postcentral gyrus, left cuneus, left thalamus, left insula, and anterior cingulate (allP<0.05). Brain areas with increased fALFF were right inferior frontal gyrus, right middle temporal gyrus (allP<0.05). Conclusion It has great effect of alcohol on brain function in rhesus monkeys, and mainly involve default network, reward and emotional processing system, visual and auditory cortex.
Alcoholic intoxication; Magnetic resonance imaging; Macaca mulatta
国家自然科学基金(81171326、81571308)、2013年高校省级自然科学研究基金项目(K12013ZD08)。
丁兆明(1987—),男,安徽蒙城人,硕士,医师。研究方向:神经影像学。E-mail: 1105991828@qq.com
余永强,安徽医科大学第一附属医院影像科,230032。E-mail: yuyongqiang@hotmail.com
2016-10-28
2016-12-15
10.13929/j.1672-8475.201610033
R-332; R445.2
A
1672-8475(2017)02-0102-06
基础与实验研究
