Aβ3-10多价腺病毒疫苗鼻粘膜免疫AD转基因鼠的治疗效果研究
2017-02-20林璐璐辛世萌曹云鹏
李 昱, 张 慧, 林璐璐, 辛世萌, 曹云鹏
Aβ3-10多价腺病毒疫苗鼻粘膜免疫AD转基因鼠的治疗效果研究
李 昱1, 张 慧1, 林璐璐1, 辛世萌1, 曹云鹏2
目的 探讨Aβ3-10多价腺病毒疫苗鼻粘膜免疫AD转基因鼠的治疗效果。方法 18只雄性10月龄AD转基因鼠,随机分为3组,分别以Aβ3-10多价腺病毒疫苗Ad-Aβ(3-10)10-CpG、空腺病毒载体及Aβ1-42免疫,ELISA法检测血清抗Aβ抗体滴度及亚型,Morris水迷宫检测转基因鼠的学习记忆能力,免疫组化法检测转基因鼠脑内Aβ沉积;ELISA法检测转基因鼠脑组织匀浆和血清中可溶性Aβ42水平。结果 Ad-Aβ(3-10)10-CpG组和Aβ1-42组抗体水平随着免疫次数逐渐增加,第7次免疫后Ad-Aβ(3-10)10-CpG组和Aβ1-42组血清中抗Aβ抗体水平分别为(67.42±13.68)μg/ml和(94.41±14.01)μg/ml,而空载体组一直在基线水平。Ad-Aβ(3-10)10-CpG组IgG1/IgG2a比值明显高于Aβ1-42组(P<0.05)。在Morris水迷宫实验中Ad-Aβ(3-10)10-CpG组的逃避潜伏期明显小于空载体组(P<0.01);Ad-Aβ(3-10)10-CpG组在靶象限的停留时间明显长于空载体组(P<0.01);Ad-Aβ(3-10)10-CpG组穿越平台所在位置的次数明显多于空载体组(P<0.05)。Ad-Aβ(3-10)10-CpG组脑组织Aβ沉积所占面积百分比与空载体组比较明显减少(P<0.01)。Ad-Aβ(3-10)10-CpG组脑组织匀浆和血清中可溶性Aβ42水平明显高于空载体组(P<0.01)。结论 Aβ3-10多价腺病毒疫苗鼻粘膜免疫AD转基因鼠,主要引起Th2型免疫应答,可以改善AD转基因鼠学习和记忆能力,促进转基因鼠脑内Aβ清除,可以减少由细胞免疫应答引起的炎症反应。Aβ3-10多价腺病毒疫苗是AD免疫治疗的安全有效的候选疫苗。
阿尔茨海默病; 腺病毒疫苗; Aβ; 免疫治疗
阿尔茨海默病(Alzheimer’s disease,AD)发病率高,目前尚无有效的防治方法。其核心病理改变为脑组织Aβ沉积形成老年斑。早期研究发现,Aβ42主动免疫可以促进转基因鼠脑内Aβ斑块清除,改善基因鼠的学习和记忆功能[1]。但后期的临床试验,由于部分患者中出现亚急性脑膜脑炎而终止[2,3]。推测这种副作用与Aβ的T细胞抗原决定簇特异性的T细胞反应或传统佐剂QS21有关[3],后续的主动免疫研究集中在改变免疫原和佐剂来克服不恰当的T细胞应答引起的中枢神经系统炎症。Zago等[4]发现只有针对Aβ的N末端的抗体可以使脑内淀粉样斑块清除。针对Aβ的N末端的DNA疫苗可以改善转基因鼠认知功能,促进Aβ斑块清除,减少脑内炎症反应[5,6]。
本研究前期工作已成功构建编码10次重复N末端片段Aβ3-10及CpG序列的新型基因重组腺病毒疫苗Ad-Aβ(3-10)10-CpG,发现鼻粘膜免疫BALB/c鼠可以诱导Th2型免疫反应,产生特异性抗Aβ抗体[7]。本研究用这种新型腺病毒疫苗鼻粘膜免疫10月龄的AD转基因鼠,通过测定血清抗Aβ抗体水平、脑组织Aβ沉积、血清及脑组织中可溶性Aβ及Morris水迷宫行为学检测,探讨Ad-Aβ(3-10)10-CpG鼻粘膜免疫AD转基因鼠的治疗效果。
1 材料与方法
1.1 材料 18只10月龄APPswe/PSEN1dE9鼠,雄性,每只鼠出生后均完成鼠尾DNA鉴定,购自中国医科大学动物部。APPswe/PSEN1dE9鼠表达鼠/人嵌合的淀粉样蛋白前体(Mo/HuAPP695swe)和突变的人早老素1(PS1- dE9),这两种突变与早发性AD相关。Aβ1-42多肽(AnaSpect),人Aβ ELISA试剂盒(Invitrogen,Camarillo,CA),完全弗氏佐剂(Sigma,USA),不完全弗氏佐剂(Sigma,USA),小鼠单克隆抗体(Covance,USA),羊抗小鼠IgG-HRP(R&D),Morris水迷宫恒温游泳池(淮北正华生物仪器设备有限公司),Morris水迷宫分析系统(淮北正华生物仪器设备有限公司)。
1.2 实验动物及免疫方法 Ad-Aβ(3-10)10-CpG组:Ad-Aβ(3-10)10-CpG 10 μl(1×108PFU)鼻腔免疫;空载体组:空腺病毒载体10 μl(1×108PFU)鼻腔免疫;Aβ1-42组:免疫方法参照[1],第1次免疫用50 μl(100 μg)+完全性弗氏佐剂(Sigma,USA)50 μl,股四头肌肌内注射,第2次及以后免疫用Aβ1-4250 μl(100 μg)+不完全性弗氏佐剂(Sigma,USA)50 μl,股四头肌肌内注射。各组均每10 d免疫1次,共免疫7次。每组小鼠免疫前及第2次到第7次免疫后7 d采血,经眶静脉采血,每次采血量约为0.2~0.3 ml。全血室温下静置2~3 h,10000 rpm,10 min 离心,留取血清,分装,-70℃保存。
1.3 ELISA 法测血清抗Aβ 抗体滴度及亚型 用碳酸盐包被缓冲液(pH 9.6,0.05 mol/L)将Aβ1-42肽稀释至5 μg/ml,在96孔酶标板每个孔中加0.1 ml,4 ℃过夜。次日,弃去孔内溶液,用洗涤缓冲液(含0.05%TW20的1×PBS)洗板3次。每孔中加入封闭缓冲液(含0.5%BSA,5%羊血清,0.05%TW20的1×PBS)200 μl,室温孵育1 h。弃去孔中液体,向孔中加入标准抗体6E10(标准抗体浓度分别为10 ng/ml,7.5 ng/ml,5 ng/ml,2.5 ng/ml,1.25 ng/ml,0.625 ng/ml,0 ng/ml)和待测血清(血清稀释500~3000倍)50 μl,置于37 ℃孵育1.5 h。弃去血清和抗体,用洗涤缓冲液洗板3次。于各孔中加入稀释的羊抗小鼠IgG-HRP(1∶1000稀释),IgG1-HRP(1∶500稀释),IgG2a-HRP(1∶500稀释),IgG2b-HRP(1∶500稀释)0.1 ml,置于37 ℃孵育1 h。弃去二抗,洗板5次。于各孔中加入TMB底物溶液0.1 ml,置于37 ℃孵育20 min。于各反应孔中加入0.5 mol/L硫酸0.1 ml。用酶标仪检测450 nm处各孔吸光度(OD)值,绘制标准曲线,求得各待测血清中的抗Aβ抗体浓度。
1.4 Morris 水迷宫实验 转基因鼠第7次免疫后1 w进行水迷宫实验。Morris水迷宫恒温游泳池(直径1.25 m,高 0.4 m)均分为第Ⅰ、Ⅱ、Ⅲ、Ⅳ象限,第Ⅰ象限为靶象限,每次实验水温保持在23~26 ℃,水用牛奶染成白色。摄像机吊于水面上方170 cm处,并通过配套软件系统进行数据分析。1 d、2 d是可视平台实验,一个9 cm×9 cm圆形平台位于靶象限中心露出水面上1 cm,小鼠分别从4个象限入水,使小鼠记住平台位置。3 d到7 d是隐藏平台获得实验,圆形平台位于靶象限中心水面下1 cm,每只小鼠从靶象限对面象限入水,每天进行3次实验。记录小鼠找到平台的逃避潜伏期。如果60 s内未找到平台按60 s计算,并把小鼠引导至平台上逗留30 s。8 d是空间探索实验,撤除平台,使小鼠按照从第Ⅰ~Ⅳ象限的顺序面对池壁放入水池,小鼠在无平台情况下寻找记忆中的平台,每个象限游泳60 s,记录游泳轨迹、穿过平台次数、游泳距离、平均速度等。
1.5 ELISA法检测血清和脑组织匀浆可溶性Aβ42采用人Aβ试剂盒,用ELISA法检测血清及脑组织匀浆中Aβ42水平。脑组织加入8倍湿重的5 mol/L胍盐酸/50 mmol/L TrisHCl,用超声细胞粉碎仪制成匀浆,室温下混合3~4 h,取匀浆2.5 μl,加入反应缓冲液(5% BSA 0.03% TW-20的Dulbecco’s 磷酸盐缓冲液,混合1× 蛋白酶抑制剂混合物) 按1∶40稀释,离心 16 000 r/min,5 min,4 ℃,留取上清,-20 ℃保存。血清离心,取上清20 μl,加入160 μl的5 mol/L胍盐酸/50 mmol/L TrisHCl,-20 ℃保存。按照试剂盒说明书操作检测,用酶标仪(El×800,BIOTEK)测定450nm处吸光度值(OD)。血清Aβ42水平用pg/ml表示,脑组织Aβ42水平用pg/mg 表示。
1.6 免疫组化法检测脑组织内Aβ沉积 石蜡包埋的大脑右侧半球,按冠状位切片,厚约4 μm,常规二甲苯脱蜡,梯度酒精脱水;3%双氧水37 ℃孵育10 min以阻断灭活内源性过氧化物酶,PBS冲洗3次,每次5 min;0.01 mol/L枸橼酸缓冲液(pH 6.0)中煮沸5 min以抗原修复,冷却至室温,PBS冲洗3次,每次5 min;正常羊血清工作液封闭,37 ℃,10 min,倾去勿洗;检测小鼠脑内Aβ沉积滴加抗Aβ抗体,4 ℃冰箱孵育过夜,PBS冲洗3次,每次5 min;滴加生物素标记相应的二抗,37 ℃孵育30 min,PBS冲洗3次,每次5 min;滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育30 min,PBS冲洗3次,每次5 min;DAB显色,自来水充分冲洗;苏木素复染5 min,常规脱水,透明,干燥,中性树胶封片。图像分析应用MetaMorph显微图像分析系统,计算Aβ斑块所占面积百分比。
2 结 果
2.1 血清抗Aβ抗体及抗体亚型检测 各组免疫前的血清均未检测到抗Aβ抗体,随着免疫次数的增加,Ad-Aβ(3-10)10-CpG组和Aβ1-42组抗体水平逐渐增加,而空腺病毒载体组抗体水平一直呈基线水平。第7次免疫后Ad-Aβ(3-10)10-CpG组和Aβ1-42组血清中抗Aβ抗体水平分别为(67.42±13.68)μg/ml和(94.41±14.01)μg/ml(见图1)。
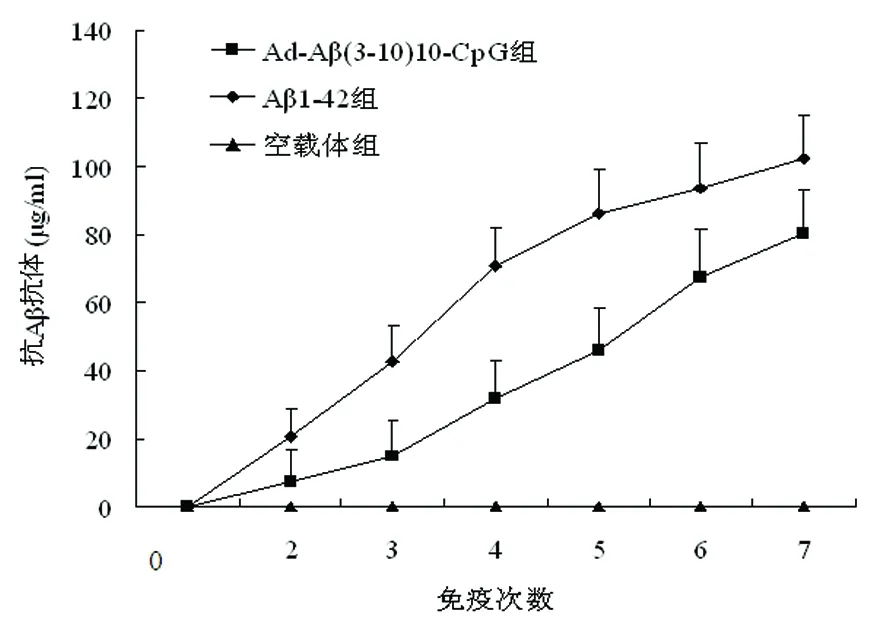
图1 免疫过程中各组小鼠血清中抗Aβ抗体水平变化
将Aβ1-42组和Ad-Aβ(3-10)10-CpG组小鼠第7次免疫后的血清进行抗体亚型分析。产生的抗体有IgG1,IgG2a,IgG2b,Ad-Aβ(3-10)10-CpG组产生的抗体大部分为IgG1,IgG1/IgG2a比值为(9.85±1.82);Aβ1-42组的IgG1/ IgG2a比值为(2.08±0.81)。Ad-Aβ(3-10)10-CpG组IgG1/IgG2a比值明显高于Aβ1-42组(P<0.05)(见图2)。

图2 血清抗Aβ抗体亚型分析。(A)第7次免疫后血清抗Aβ抗体的IgG1、IgG2a、IgG2b亚型。(B) IgG1/IgG2a比值,与Aβ1-42组比较*P<0.05
2.2 Morris 水迷宫实验
2.2.1 可视平台实验 Ad-Aβ(3-10)10-CpG组、Aβ1-42组和空载体组平均逃避潜伏期无明显差异(P>0.05),说明免疫治疗没有影响各组小鼠的运动能力和视觉(见图3A)。
2.2.2 隐藏平台获得实验 从3~7 d,各组逃避潜伏期都随训练次数增加而缩短。Ad-Aβ(3-10)10-CpG组和Aβ1-42组的逃避潜伏期明显小于空载体组(P<0.01),但Ad-Aβ(3-10)10-CpG组和Aβ1-42组无明显差异(P>0.05)(见图3A)。
2.2.3 空间探索实验 Ad-Aβ(3-10)10-CpG组和Aβ1-42组在靶象限的停留时间明显长于空载体组(P<0.01),Ad-Aβ(3-10)10-CpG组和Aβ1-42组无明显差异(P>0.05)(见图3C)。Ad-Aβ(3-10)10-CpG组和Aβ1-42组穿越平台所在位置的次数明显多于空载体组(P<0.05),但Ad-Aβ(3-10)10-CpG组和Aβ1-42组无明显差异(P>0.05)。而游泳距离、平均游泳速度各组间比较无差异(P>0.05)(见图3B)。分析游泳轨迹图:训练早期及空载体组的游泳轨迹主要以游泳池边缘型为主,Ad-Aβ(3-10)10-CpG组和Aβ1-42组的游泳轨迹随着训练次数的增多趋向以围绕平台周围的搜索轨迹为主(见图3D)。


图3 免疫后各组APPswe/PSEN1dE9鼠Morris 水迷宫实验。 (A)可视平台实验中各组小鼠逃避潜伏期没有明显差异。隐藏平台实验中Ad-Aβ(3-10)10-CpG组和Aβ1-42组逃避潜伏期明显小于空载体组。(B)空间探索实验中Ad-Aβ(3-10)10-CpG组和Aβ1-42组穿越平台所在位置的次数明显多于空载体组。(C) Ad-Aβ(3-10)10-CpG组和Aβ1-42组在靶象限的停留时间明显长于空载体组。 和空载体组比较*P<0.05,和空载体组比较**P<0.01。 (D) 游泳轨迹图 (a)Aβ1-42组,(b) Ad-Aβ(3-10)10-CpG组,(c) 空载体组
2.3 血清和脑组织匀浆中可溶性Aβ42水平 Ad-Aβ(3-10)10-CpG组和Aβ1-42组脑组织匀浆中可溶性Aβ42水平明显高于空载体组(P<0.01),Ad-Aβ(3-10)10-CpG组和Aβ1-42组无明显差异(P>0.05)。Ad-Aβ(3-10)10-CpG组和Aβ1-42组血清可溶性Aβ42水平明显高于空载体组(P<0.05),Ad-Aβ(3-10)10-CpG组和Aβ1-42组无明显差异(P>0.05)(见图4)。
2.4 免疫治疗后转基因鼠脑内Aβ沉积变化 在皮质及海马区各采集4张400倍图像,用MetaMorph显微图像分析系统,计算Aβ沉积所占面积百分比。Ad-Aβ(3-10)10-CpG组和Aβ1-42组免疫治疗后脑组织Aβ沉积所占面积百分比与空载体组比较明显减少。Ad-Aβ(3-10)10-CpG组和空载体组相比皮质和海马区Aβ沉积所占面积百分比为分别减少38.6%和46.2%(P<0.01)。Aβ1-42组和空载体组相比皮质和海马区Aβ沉积所占面积百分比为分别减少43.8%和50.5%(P<0.01)。空载体组小鼠海马及皮质区Aβ沉积密集分布,呈深棕褐色,其中散在分布深棕褐色粗大颗粒状老年斑,皮质区Aβ沉积多于海马区。Ad-Aβ(3-10)10-CpG组和Aβ1-42组中Aβ沉积呈稀疏分布,呈浅棕褐色,散在分布浅棕褐色粗大颗粒状老年斑(见图5)。
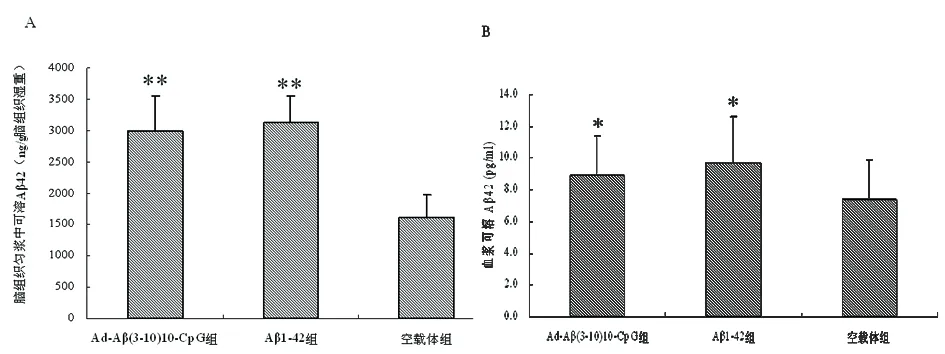
图4 脑组织匀浆和血浆中可溶性Aβ42水平。Aβ1-42组和Ad-Aβ(3-10)10-CpG组脑组织匀浆(A)和血清(B)中可溶性Aβ42水平明显高于空载体组,**和空载体组比较P< 0.01,*和空载体组比较P<0.05

图5 免疫后各组小鼠海马和皮质的Aβ沉积。和空载体组(A1,A2)比较,Ad-Aβ(3-10)10-CpG组 (B1,B2)和Aβ1-42组 (C1,C2)Aβ沉积明显减少。 (D) 海马和皮质Aβ沉积面积百分比的定量分析,和空载体组比较**P< 0.01,比例尺代表100μm
3 讨 论
本研究中,我们发现Ad-Aβ(3-10)10-CpG鼻粘膜免疫10月龄APPswe/PSEN1dE9鼠,可以诱导转基因鼠体内产生高滴度的抗Aβ抗体,但是抗体水平低于Aβ1-42组,这与既往的基因疫苗结果类似[8]。免疫治疗后IgG的亚型可以间接反映免疫应答中产生的细胞因子。在小鼠中,Th2型细胞因子诱导IgG1主要产生,IgG2a反映Th1型细胞因子参与免疫应答[8]。Ad-Aβ(3-10)10-CpG鼻粘膜免疫产生的抗体主要为IgG1型,IgG1/ IgG2a比值明显高于Aβ1-42组。说明Ad-Aβ(3-10)10-CpG鼻粘膜免疫诱导转基因鼠体内产生Th2型免疫应答,从而能避免与细胞免疫应答相关的脑内炎症反应。而且研究发现IgG1比IgG2a和 IgG2b清除脑内Aβ更有效[9]。
Morris水迷宫实验显示Ad-Aβ(3-10)10-CpG组和Aβ1-42组的逃避潜伏期随着训练次数的增加逐渐缩短,空间探索实验的穿越平台次数和在靶象限停留时间与空载体组差异显著。说明免疫治疗可以改善转基因鼠的学习记忆功能。这与既往以Aβ为靶点的免疫治疗结果相似[5,6,8,10]。而Ad-Aβ(3-10)10-CpG组和Aβ1-42组在水迷宫实验中主要指标差异不明显,说明Ad-Aβ(3-10)10-CpG与Aβ1-42疗效大致相似,尽管Ad-Aβ(3-10)10-CpG组小鼠产生的抗体明显低于Aβ1-42组。
AD的一个重要机制就是脑内Aβ清除障碍,针对Aβ的免疫治疗能够促进Aβ清除,多种机制参与,包括小胶质细胞和酶介导的难溶性Aβ降解,可溶的Aβ通过受体介导吸收入血,通过毛细血管周围和小动脉周围淋巴引流途径转运出脑[11]。Ad-Aβ(3-10)10-CpG组和Aβ1-42组免疫治疗后脑组织Aβ沉积所占面积百分比与空载体组比较明显减少,Ad-Aβ(3-10)10-CpG组和Aβ1-42组脑组织匀浆和血清中可溶性Aβ42水平明显高于空载体组,提示免疫治疗促进脑组织Aβ斑块解聚,可溶性Aβ42向外周循环转运,但Zou等[10]研究显示免疫治疗后脑组织匀浆中可溶性Aβ42与对照组水平无差异,其原因可能与脑组织标本处理方法有关。研究表明,抗Aβ抗体可能通过与直接与Aβ结合破坏β片层结构导致斑块解聚[12],或者通过免疫球蛋白的F(ab’)2段而非Fc段介导斑块结构破坏[13]。免疫治疗后Ad-Aβ(3-10)10-CpG组和Aβ1-42组血清可溶性Aβ增加,表明“外周沉槽机制参与脑内Aβ斑块的清除。外周沉槽机制的过程是外周循环的抗Aβ抗体与Aβ结合形”成免疫复合物,减少了外周游离Aβ的水平,促进Aβ由脑内向外周转运[14,15]。
综上所述,基因重组腺病毒疫苗Ad-Aβ(3-10)10-CpG鼻粘膜免疫APPswe/PSEN1dE9双转基因鼠,能够诱导Th2型的免疫反应,从而避免细胞免疫应答相关的脑内炎症反应,并且可以改善APPswe/PSEN1dE9双转基因鼠学习和记忆功能,减少转基因鼠脑内Aβ沉积,促进脑内Aβ清除。所以,基因重组腺病毒疫苗Ad-Aβ(3-10)10-CpG是一种治疗AD安全有效的候选疫苗.
[1]Janus C,Pearson J,McLaurin J,et al. A beta peptide immunization reduces behavioural impairment and plaques in a model of Alzheimer’s disease[J]. Nature,2000,408(6815):979-982.
[2]Orgogozo JM,Gilman S,Dartigues JF,et al. Subacute meningoencephalitis in a subset of patients with AD after Abeta42 immunization[J]. Neurology,2003,61(1):46-54.
[3]Nicoll JA,Wilkinson D,Holmes C,et al. Neuropathology of human Alzheimer disease after immunization with amyloid-beta peptide:a case report[J]. Nat Med,2003,9(4):448-452.
[4]Zago W,Buttini M,Comery TA,et al. Neutralization of soluble,synaptotoxic amyloid β species by antibodies is epitope specific[J]. J Neurosci,2012,32(8):2696-2702.
[5]Xing XN,Sha S,Chen XH,et al. Active Immunization with DNA Vaccine Reduced Cerebral Inflammation and Improved Cognitive Ability in APP/PS1 Transgenic Mice by In Vivo Electroporation[J]. Neurochem Res,2015,40(5):1032-1041.
[6]Sha S,Xing XN,Cao YP. Active immunotherapy facilitates Aβ plaque removal following through microglial activation without obvious T cells infiltrating the CNS[J]. J Neuroimmunol,2014,274 (1-2):62-70.
[7]Li Y,Ma Y,Zong LX,et al. Intranasal inoculation with anadenovirus vaccine encoding ten repeats of Aβ3-10induces Th2 immune response against amyloid-β in wild-type mouse[J]. Neurosci Lett,2011,505 (2):128-133.
[8]Lambracht-Washington D,Qu BX,Fu M,et al. DNA beta-amyloid(1-42) trimer immunization for Alzheimer disease in a wild-type mouse model[J]. JAMA,2009,302(16):1796-1802.
[9]Chauhan NB,Siegel GJ. Efficacy of anti-Abeta antibody isotypes used for intracerebroventricular immunization in TgCRND8[J]. Neurosci Lett,2005,3759(3):143-147.
[10]Zou J,Yao Z,Zhang G,et al. Vaccination of Alzheimer’s model mice with adenovirus vector containing quadrivalent foldable Abeta(1-15) reduces Abeta burden and behavioral impairment without Abeta-specific T cell response[J]. J Neurol Sci,2008,272(1-2):87-98.
[11]Diem AK,Tan M,Bressloff NW,et al. A Simulation Model of Periarterial Clearance of Amyloid-β from the Brain[J]. Front Aging Neurosci,2016,8:18.
[12]Solomon B,Koppel R,Frankel D,et al. Disaggregation of Alzheimer beta-amyloid by site-directed mAb[J]. Proc Natl Acad Sci USA,1997,94(8):4109-4112.
[13]Bacskai BJ,Kajdasz ST,McLellan ME,et al. Non-Fc-mediated mechanisms are involved in clearance of amyloid-beta in vivo by immunotherapy[J]. J Neurosci,2002,22(18):7873-7878.
[14]DeMattos RB,Bales KR,Cummins DJ,et al. Brain to plasma amyloid-beta efflux:a measure of brain amyloid burden in a mouse model of Alzheimer’s disease[J]. Science,2002,295 (5563):2264-2267.
[15]Lemere CA,Spooner ET,LaFrancois J,et al. Evidence for peripheral clearance of cerebral Abeta protein following chronic,active Abeta immunization in PSAPP mice[J]. Neurobiol,2003,14(1):10-18.
The therapeutic effect of multivalent adenovirus vaccine Aβ3-10after intranasal inoculation in AD transgenic mice
LIYu,ZHANGHui,LINLulu,etal.
(DepartmentofNeurology,TheSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China)
Objective To study the therapeutic effects of multivalent adenovirus vaccine Aβ3-10after intranasal inoculation in AD transgenic mice. Methods Eighteen ten-month old male transgenic mice were divided into three groups randomly and immunized with recombinant adenovirus vaccine Ad-Aβ(3-10)10-CpG,empty adenoviral vector and Aβ1-42peptide,representatively. Titers of anti-Aβ antibody and isotypes of immunoglobin in sera were determined with ELISA. Cognitive function of the transgenic mice was detected by Morris water maze tests. Aβ burden in brains of the mice was detected with Immunohistochemistry. Soluble Aβ42in plasma and brain homogenate was detected with ELISA. Results Sera from mice vaccinated with Ad-Aβ(3-10)10-CpG and Aβ1-42showed a steady increase in anti-Aβ antibody titer with each boost,reaching an average of (67.42±13.68) μg/ml and (93.41±14.01) μg/ml after the final immunization,respectively. Antibody titers from mice vaccinated with empty vector remained at background level. IgG1/IgG2a ratio of the Ad-Aβ(3-10)10-CpG group was much greater than that of the Aβ1-42group(P<0.05). Morris water maze tests:Ad-Aβ(3-10)10-CpG immunized mice showed shorter escape latency compared with the empty vector group (P<0.01). Ad-Aβ(3-10)10-CpG immunized mice spent significant more time in the target quadrant than empty vector immunized mice (P<0.01),Ad-Aβ(3-10)10-CpG immunized mice crossed the platform location significantly more often than empty vector immunized mice (P<0.05). Percentage of Aβ burden occupied area significantly reduced in mice immunized with Ad-Aβ(3-10)10-CpG compared with empty vector group. Soluble Aβ42levels significantly increased in the brain homogenates and plasma of the Ad-Aβ(3-10)10-CpG immunized mice compared with empty vector immunized mice (P<0.01). Conclusions Intranasal inoculation with a recombinant adenovirus vaccine Ad-Aβ(3-10)10-CpG could attenuate learning and memory deficts in APPswe/PSEN1dE9 mice and reduce Aβ deposition in the brain of transgenic mice by promoting its clearance. Adenovirus vaccine Ad-Aβ(3-10)10-CpG had low potential to cause cellular immune response mediated inflammatory response. Thus,Ad-×Aβ(3-10)10-CpG is a safe and effective candidate vaccine for immunotherapy in AD.
Alzheimer’s disease; Adenovirus vaccine; β-amyloid; Gene immunization
1003-2754(2017)01-0004-05
2016-07-10;
2016-12 -26
国家自然科学基金(No. 81371227)
(1.大连医科大学附属第二医院神经内科,辽宁 大连 116027;2.中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
曹云鹏,E-mail:cypcmu@163.com
R749.1+6
A
