带正电荷蛋白在纳米/微米草酸钙晶体上的吸附特性及其与带负电荷蛋白吸附的比较
2017-02-16温小玲孙新园欧阳健明
温小玲孙新园欧阳健明
带正电荷蛋白在纳米/微米草酸钙晶体上的吸附特性及其与带负电荷蛋白吸附的比较
温小玲孙新园欧阳健明*
(暨南大学生物矿化与结石病防治研究所,暨南大学化学系,广州510632)
研究尺寸分别为100nm和3μm的一水草酸钙(COM)和二水草酸钙(COD)晶体对带正电荷的蛋白溶菌酶(LSZ)的吸附差异,并与带负电荷的蛋白牛血清白蛋白(BSA)的吸附进行了比较。LSZ在纳米/微米COM和COD晶体上的吸附都很好的拟合了Langmuir模型,属于单分子层吸附。纳米/微米COM和COD对LSZ的最大吸附量顺序为COD-100nm>COM-100nm>COD-3μm>COM-3μm;晶体的比表面积越大,曲率越小,晶体表面所带电荷越负,晶体结晶水越多,均导致LSZ吸附量越大。体系离子强度和pH值亦影响LSZ的吸附。随着NaCl浓度增加,LSZ的吸附量减小,说明Na+离子能与带正电荷的蛋白LSZ竞争晶体表面的吸附位点,导致晶体表面吸附LSZ的位点减少。晶体对LSZ的最大吸附量都出现在LSZ的等电点附近(pH=10.7);在pH= 5~8(生理条件)时,LSZ的吸附量随pH值的增大而增大。本文结果提示,通过减小尿液的pH值或者适当增大尿液的离子强度,可以减小LSZ在尿微晶上的吸附量,有可能达到抑制草酸钙结石的效果。
草酸钙;带正电荷的蛋白;溶菌酶;竞争吸附;离子强度;pH值
0 引言
尿液中蛋白质可以影响草酸钙(CaOx)结石的形成[1-2],但之前的报道大多研究的是带负电荷的蛋白质[3-4],关于带正电荷的蛋白质对CaOx晶体生长影响的研究还很少[5]。然而,对结石基质中的有机成分分析表明,大多数蛋白质在生理条件下(pH=5~8)是带正电荷的[6-7]。在尿液中带正电荷的蛋白包括组织蛋白酶G(cathepsin G)、嗜酸性细胞阳离子蛋白(eosinophil cationic protein)和髓过氧化物酶前体(myeloperoxidase precursor)等[7],这些带正电荷的蛋白富含碱性氨基酸侧链如L-赖氨酸、L-精氨酸和L-组氨酸等。溶菌酶(LSZ)是带正电荷蛋白的代表物质,在肾结石中普遍存在。人体肾发生损伤时会导致LSZ浓度增加,LSZ在肾病患者尿液中的浓度(0.45~11.6mg·L-1)比正常人(0.08~0.13mg·L-1)高[8]。Farmanesh等[9]研究了LSZ对一水草酸钙(COM)结晶的影响,发现LSZ能促进COM晶体的生长,而且在较大的浓度范围(0~100μg·mL-1)内,LSZ都是作为COM晶体的生长促进剂。相比之下,带负电荷的牛血清白蛋白(BSA)是COM晶体的生长抑制剂[4],我们猜测蛋白质作为COM晶体生长促进剂或抑制剂与蛋白质本身的荷电情况有关。
前文[5,10]我们比较研究了不同尺寸(50nm、100nm、1μm、3μm和10μm)的COM和二水草酸钙(COD)晶体对阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)和非离子表面活性剂壬基酚聚氧乙烯醚(NP-40)的吸附差异。由于表面活性剂所带电荷不同,所以表面活性剂与晶体之间存在的相互作用也不同。CTAB分子主要依靠静电作用吸附到COM和COD晶体表面[5];而NP-40主要依靠氢键作用和配位作用吸附到COM和COD晶体表面[10]。CTAB和NP-40的吸附使得晶体的ζ电位绝对值增大,有利于抑制晶体的聚集。而且由于NP-40与晶体之间的作用力比CTAB的弱,导致NP-40的吸附量比CTAB少,所以NP-40对溶液中COD的稳定作用较差,会有部分的COD转化为COM晶体。
上述表面活性剂是小分子,这些小分子和尿微晶之间的相互作用可能与大分子不同,因为大分子可以通过多个位点与草酸钙晶体结合,并参与尿石形成,包括晶体成核、生长和聚集[11]。成核促进剂可以产生大量小晶体消除尿液的过饱和,而且小晶体在参与结石形成之前可以被冲出肾脏,但这种保护机制只有当抑制剂能抑制小晶体粘附到肾上皮细胞的情况下才能发挥作用[12]。LSZ带正电荷,而细胞膜带负电荷,细胞膜与LSZ分子之间存在静电相互作用,这可能导致吸附了LSZ的晶体更容易粘附到肾上皮细胞表面而滞留在肾脏中。基于此,本文研究了LSZ与不同尺寸COM、COD晶体之间的吸附特性和相互作用,并与带负电荷的蛋白BSA进行比较,期望通过控制尿液条件来达到抑制草酸钙肾结石的目的。
1 实验材料与方法
1.1 试剂与仪器
溶菌酶(LSZ,Amesco,北京梦怡美生物公司),PBS磷酸盐缓冲溶液(北京索莱宝科技有限公司),其它常规试剂为分析纯。实验用水为二次蒸馏水。
Varian Cary 500型紫外可见分光光度计(美国Varian公司)。Zetasizer Nano-ZS型纳米粒度仪(英国Malvem公司)。数字酸度计(PHS-3C,郑州宝晶电子科技有限公司)。
1.2 纳米/微米COM、COD晶体的合成方法
参照前文[13]合成尺寸分别约为100nm和3μm的COM、COD晶体,并分别用COM-100nm,COD-100nm,COM-3μm,COD-3μm表示。XRD和FTIR表明所合成的晶体为纯的目标产物。
1.3 LSZ标准曲线测定
参照文献[14]进行,取一组比色管,分别加入0.4, 0.8,1.2,1.6,2,2.4,3,4和5mL 1mg·mL-1的LSZ标准溶液,用PBS缓冲溶液(pH=7.3±0.1)定容至10mL,以PBS溶液为参比于280nm处测定LSZ溶液的吸光值(A)。以浓度为横坐标,吸光度为纵坐标,得到LSZ标准曲线,其线性方程为:y=1.9344x+0.0043;R2=0.9998。
1.4 LSZ吸附等温线测定
在文献[15]的基础上进行。称取50mg COM或COD晶体各9份于25mL烧杯中,分别加入预先配置好的浓度(C0)为0,2,4,6,8,10,12,15,20mg· mL-1的LSZ标准溶液10mL,超声10min至完全分散,密封后放入37℃恒温干燥箱中,吸附24h后取出离心;取上清液适量,测定剩余LSZ浓度(Ceq)和悬浮液的ζ电位。根据公式计算出晶体对LSZ的吸附量Qe。以C0为横坐标,Qe为纵坐标绘制吸附等温线。为了消除比表面积的影响,根据公式得到比表面积归一化的吸附量,即每单位面积上吸附的LSZ质量。
1.5 pH值对体系ζ电位的影响
参照文献[16-17]的方法测量不同pH值下LSZ的ζ电位。取8个小烧杯,各加入0.5mg·mL-1LSZ溶液10mL,用10μL微量注射器滴加浓度为0.25mol· L-1的HCl或NaOH调节其pH值分别至4,5,6,7, 8,9,10和11,然后取约1mL悬浮液加入电位池中,测量对应的ζ电位。COM和COD晶体的等电点记为PZCCaOx,LSZ的等电点记为PILSZ。
ζ电位的获得是通过测定体系的电泳迁移率,运用Smoluchowski方程计算出来,Smoluchowski方程如下:其中ζ是ζ电位,UE是电泳迁移率,ε是介电常数,η是粘度。
1.6 pH值对吸附的影响
称取50mg COM或COD晶体各8份于16个25mL烧杯中,分别加入初始浓度(C0)为1mg·mL-1LSZ标准溶液10mL。超声10min至完全分散后,调节pH值分别至4,5,6,7,8,9,10和11。密封后放入37℃恒温干燥箱中,吸附24h后,取出离心,取上清液适量测定剩余LSZ浓度(Ceq),计算出晶体对LSZ的吸附量(Qe)。以pH值为横坐标,Qe为纵坐标绘制吸附曲线。
1.7 离子强度对吸附的影响
参照文献[18]进行。准确称取6份各100mg LSZ固体,加入预先配制的用pH=7.3的PBS缓冲溶液溶解的不同浓度的NaCl溶液(浓度分别为0.01、0.1、1、10、100、1000mmol·L-1),定容至100mL,备用。取12个小烧杯,其中6份各加入50mg的COM,另6份各加入50mg的COD晶体,再加入10mL上述配制好的LSZ溶液,超声5min至完全分散,密封后,放入37℃水浴锅中吸附24h,离心,测量上清液剩余LSZ浓度(Ceq),同时测量悬浮液的ζ电位。根据公式计算出晶体对LSZ的吸附量(Qe)。以NaCl浓度的对数值(lgCNaCl)为横坐标,Qe为纵坐标绘制吸附曲线。
2 结果与讨论
2.1 吸附等温线
LSZ在纳米/微米COM和COD晶体上的吸附等温线如图1A所示。LSZ的最大吸附量(每克晶体吸附的LSZ质量)顺序为COD-100nm>COM-100nm>>COD-3μm>COM-3μm,即在纳米晶体上的吸附量远大于微米晶体(表1),说明LSZ的吸附量与晶体的比表面积呈正相关,因为纳米晶体的比表面积远大于微米晶体(表1)。

图1 LSZ在纳米/微米COM和COD的吸附等温线Fig.1Adsorption isotherms of LSZ on nano/micron COM and COD

表1 纳米/微米COM、COD的性质及其对蛋白质的最大吸附量Table 1Properties of nano/micron COM,COD and the maximum adsorption quantity to proteins
比表面积归一化后的吸附量如图1B所示。将表面积归一化,LSZ的最大吸附量(每平方米晶体表面吸附的LSZ质量)顺序变为COD-3μm>COM-3μm>COM-100nm≈COD-100nm,即微米晶体的吸附量远大于纳米晶体。这是因为微米晶体具有较高的电荷密度,其表面ζ电位更负(表1),因此,单位面积上可以吸附更多带正电的LSZ分子;表面曲率也是一个重要的影响因素,随着晶体尺寸的减小,粒子的曲率增加,使得LSZ分子与晶体之间的接触位点减少[19],即纳米晶体与LSZ分子之间存在更少的接触位点;加上纳米晶体的聚集比微米晶体严重[17],晶体的聚集减少了其用于吸附的暴露表面,因此比表面积归一化后,纳米晶体吸附量小于微米晶体。
由图1A可以看出,无论是纳米晶体还是微米晶体,COD对LSZ的吸附大于同尺寸的COM。这是因为纳米COD的比表面积大于COM(表1),使LSZ倾向于吸附COD上;而微米晶体的比表面积相近,LSZ倾向于吸附到ζ电位更负和亲水性更好的COD上。
比表面积归一化后,纳米COM的吸附量与纳米COD晶体相近(图1B),这是因为COM晶体接近中性(表1),导致覆盖在晶体表面的蛋白层密度更高[20],即LSZ倾向于吸附到纳米COM上;而亲水性使LSZ倾向于吸附到COD上,两种因素对LSZ的吸附作用刚好相反,使LSZ在纳米COM、COD上的吸附没有出现明显差异;对于微米晶体,COD的ζ电位更负(表1),且亲水性更好,所以微米COD的吸附大于微米COM。
前文[17]我们研究了带负电荷的蛋白牛血清白蛋白(BSA),与本文的带正电荷的蛋白LSZ相比(表1),对于纳米晶体,LSZ的吸附量比BSA小;而对于微米晶体,LSZ的吸附量比BSA的稍大。前者是因为纳米晶体的曲率比微米晶体大,而LSZ是内部结构稳定的蛋白(硬蛋白),使得LSZ分子与纳米晶体之间的接触位点较少。而BSA是具有低内聚力的蛋白(软性蛋白),可以通过改变其构象适应晶体表面,使得BSA分子能很好的吸附在纳米晶体表面。而对于微米晶体,晶体曲率的影响较小,主要是晶体与蛋白质之间相互作用的影响;由于LSZ吸附由静电力驱动,而BSA吸附由氢键驱动[17],静电作用比氢键作用强,所以LSZ的吸附量会稍大于BSA。这与文献[21]的结果一致,他们用电泳法证明BSA和LSZ均能结合到微米COM晶体上,且LSZ的吸附量稍大于BSA。
2.2 吸附等温线拟合
吸附模型最常用的是Langmuir模型和Freundlich模型,因此我们选择这两种模型处理实验数据。Langmuir模型等温吸附方程为模型等温吸附方程为lgCe+lgKf,其中Qe为平衡时的吸附量,Ce为平衡时的溶液浓度,Q0为饱和吸附量,b是Langmuir等温吸附方程式常数,Kf为吸附系数,n为常数[22]。根据吸附等温线方程,对吸附实验结果分别进行拟合,结果如图2所示,可以看出,4个晶体均很好地拟合了Langmuir模型(图2a,2c),而与Freundlich模型(图2b,2d)差异较大,说明LSZ在纳米/微米COM和COD晶体上的吸附属于单分子层吸附,LSZ的这种吸附等温线拟合结果与BSA的结果一致[17],推测蛋白质在COM和COD晶体上吸附均为单分子层吸附。

图2 纳米/微米COM和COD晶体对LSZ吸附等温线的拟合结果Fig.2Fitting results of adsorption isotherms of LSZ on nano/micron COM and COD
尿液中的蛋白质吸附在尿微晶表面后,可以封闭尿微晶表面的生长位点,改变晶体表面电荷密度,从而改变尿微晶的生长和聚集过程,影响CaOx结石的形成。Wesson等[23]研究了凝血酶原片段1(PTF1)、骨桥蛋白(OPN)和肾钙素(NC)这3种蛋白对CaOx晶体生长的影响,结果表明这些蛋白都能促进COD的形成,从而减小晶体与细胞的粘附;Grover等[24]比较了TH蛋白、人血清白蛋白(HSA)、α1-微球蛋白和PTF1对草酸钙晶体聚集的影响,表明这4种蛋白都能抑制草酸钙晶体的聚集,且PTF1抑制草酸钙的聚集的能力最强,能显著抑制草酸钙晶体的沉积。这些结果表明,上述蛋白质可以抑制草酸钙肾结石的形成。
2.3 吸附LSZ后ζ电位变化
图3为纳米/微米COM和COD吸附LSZ后的ζ电位变化,各晶体的ζ电位绝对值顺序为:COD-100nm>COM-100nm>COD-3μm>COM-3μm,与吸附量顺序(图1A)一致,这进一步验证了晶体对于LSZ的吸附,因为吸附的LSZ分子越多,晶体表面的正电荷越大,对应的ζ电位越正。由于微米晶体自身的ζ电位较负(表1),且吸附量较少,所以在吸附LSZ后仍为负值或带少量的正电荷。LSZ分子比BSA小[25],使得单位面积的晶体表面吸附更多的LSZ分子,所以LSZ的吸附能明显改变晶体的ζ电位,甚至使带负电荷的晶体变成带正电荷的。这与Kandori等的研究一致[26],他们研究不同蛋白质在钙羟基磷灰石上的吸附,虽然LSZ的吸附量比BSA小,但是吸附LSZ后晶体的ζ电位变化值却比BSA大。
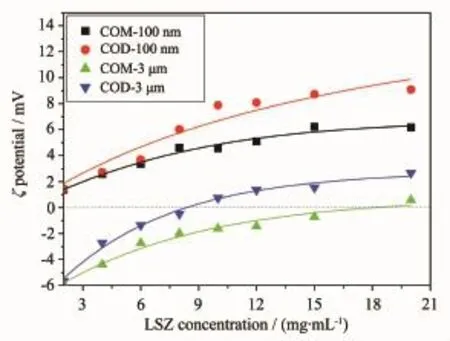
图3 纳米/微米COM和COD晶体吸附LSZ后的ζ电位Fig.3ζ potential of nano/micron COM and COD after LSZ adsorption
吸附的LSZ晶体表面的ζ电位变正,而吸附BSA后晶体表面的ζ电位变负[17]。这是因为LSZ是带正电荷的蛋白,等电点(pI)大于10.5[27],所以在pH=7.3(人体pH值)的PBS溶液中带正电荷;而BSA是带负电荷的蛋白,等电点为4.8,所以在pH=7.3的PBS溶液中带负电荷。
2.4 离子强度对吸附量和ζ电位的影响

图4 离子强度对LSZ吸附量及体系ζ电位的影响Fig.4Effect of ionic strength on LSZ adsorption quantity and ζ potential of the system
图4为离子强度对LSZ吸附量及体系ζ电位的影响。LSZ在纳米/微米COM、COD晶体表面的吸附量随NaCl浓度的增加而减小(图4a),但对应的体系ζ电位随NaCl浓度的增加而变正(图4b),说明Na+吸附到了纳米/微米COM、COD晶体表面,使得晶体表面ζ电位变正,由于静电斥力导致其对带正电荷的蛋白LSZ的吸附量减少。
离子强度影响LSZ在草酸钙晶体表面吸附的模型如图5所示。没有加NaCl时(图5a),LSZ带正电的基团与CaOx晶体表面带负电的位点结合,通过静电引力吸附到晶体表面。加入NaCl后,Na+离子和LSZ形成竞争吸附(图5b),晶体表面的部分吸附位点被Na+占据(图5c),导致LSZ的吸附量随NaCl浓度的增加而减小。这与文献[28]报道的一致:当Na+离子浓度足够大时,它可以取代特定的被吸附物质。
2.5 pH值对吸附的影响
在pH=4~11范围内纳米/微米COM、COD对LSZ的吸附量(Qe)如图6所示。4种晶体对LSZ的最大吸附量都出现在LSZ的等电点附近(pH=10.7)。这是因为在等电点附近LSZ分子显中性,吸附在晶体表面的LSZ分子之间的静电斥力最小,吸附层的LSZ分子最紧凑排列,所以吸附量达到最大。当pH<10.7时,LSZ的吸附量随pH值的增大而增大。
在pH<PZCCaOx时,随着pH值的增大,LSZ和晶体的ζ电位绝对值均减小,使得晶体与LSZ之间的静电斥力和LSZ分子之间的横向静电排斥作用减小,所以吸附量随pH值的增大而增大;而在pH>pILSZ(10.7)时,随着pH值的增大,LSZ和晶体的ζ电位绝对值增大,使得晶体与LSZ之间的静电斥力和LSZ分子之间的横向静电排斥作用增大,所以吸附量随pH值的增大而减小。
在PZCCaOx<pH<pILSZ时,LSZ分子的ζ电位绝对值随pH值的增大而减小,导致LSZ分子之间的静电排斥作用减小,所以吸附量随pH值的增大而增大。这与BSA吸附的结果不同[17],这是因为在pIBSA<pH<PZCCaOx时,BSA分子的ζ电位绝对值随pH值的增大而增大,使得BSA-CaOx之间的静电作用和BSA-BSA之间的横向静电排斥作用增大,吸附量随pH值的增大而减小。

图5 离子强度影响LSZ在草酸钙晶体表面吸附的模型图Fig.5Model of LSZ adsorption on nano/micron COM and COD affected by ionic strength
以COM-3μm晶体为例(表2),用ζ电位数据来表征LSZ与COM、COD晶体之间的相互作用,其他晶体情况与此晶体类似。在pH=4或pH=11时,COM-3μm和LSZ带相同电荷,静电斥力作用使得吸附量下降。而在pH值为9和10时,COM-3μm带负电荷,LSZ带正电荷,晶体与蛋白之间存在静电引力作用,吸附量上升。由于在pH值为10时,LSZ的ζ电位(+2.20mV)小于其在pH值为9时的ζ电位(+4.49mV),因此,pH=10时,LSZ分子之间的横向静电斥力较小,吸附量则较大。
由图6可知,在生理条件下(pH=5~8),LSZ的吸附量随pH值的增大而增大,相比之下,BSA的吸附量随pH值的增大而减小[17]。推测人体尿液pH值升高时,会增大LSZ在尿微晶上的吸附,并减小BSA在尿微晶上的吸附,从而增加草酸钙结石形成的风险。
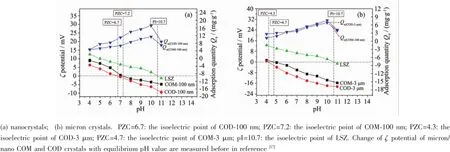
图6 pH值对LSZ在纳米/微米COM、COD表面吸附量的影响及不同pH值下晶体和LSZ的ζ电位Fig.6Change of LSZ adsorption quantity and ζ potential of nano/micron COM and COD crystals with equilibrium pH value

表2 不同pH值下COM-3μm、LSZ的ζ电位及对应的LSZ吸附量Table 2ζ potential of COM-3μm and LSZ at different pH values and corresponding adsorption quantities of LSZ
3 结论
纳米/微米COM、COD晶体对带正电荷的蛋白LSZ的吸附等温线很好的拟合了Langmuir模型,表明LSZ是单分子层吸附。LSZ的吸附量与晶体的性质密切相关,当晶体的比表面积越大,曲率越小,晶体表面所带电荷越负,晶体亲水性越好时,其对LSZ吸附量越大;当晶面电荷接近中性时,吸附量也会增大。LSZ的吸附量还与体系的条件有关,体系离子浓度增加会导致LSZ的吸附量减小;当体系pH值在LSZ的等电点附近时,吸附量最大。通过减小溶液的pH值或增大溶液离子强度可以减少LSZ在纳米/微米COM和COD晶体上的吸附,有可能达到抑制草酸钙结石形成的效果。
[1]Farmanesh S,Ramamoorthy S,Chung J,et al.J.Am.Chem. Soc.,2013,136(1):367-376
[2]Worcester E M,Nakagawa Y,Wabner C L,et al.Am.J. Physiol.,1988,255:F1197-F1205
[3]Taller A,Grohe B,Rogers K A,et al.Biophys.J.,2007,93(5):1768-1777
[4]Liu J,Jiang H,Liu X Y.J.Phys.Chem.B,2006,110(18): 9085-9089
[5]GAN Qiong-Zhi(甘琼枝),WEN Xiao-Ling(温小玲),DING Yi-Ming(丁一鸣),et al.J.Inorg.Mater.(无机材料学报), 2016,31(2):160-164
[6]Canales B K,Anderson L,Higgins L A,et al.Urol.Res., 2009,37(6):323-329
[7]Canales B K,Anderson L,Higgins L,et al.J.Endourol.,2008,22(6):1161-1168
[8]Houser M T.Clin.Chem.,1983,29(8):1488-1493
[9]Farmanesh S,Chung J,Sosa R D.J.Am.Chem.Soc.,2014, 136(36):12648-12657
[10]WENXiao-Ling(温小玲),GANQiong-Zhi(甘琼枝),OUYANG Jing-Ming(欧阳健明).Chinese J.Inorg.Chem.(无机化学学报),2015,31(10):2021-2029
[11]Walton R C,Kavanagh J P,Heywood B R,et al.Biochim. Biophys.Acta Gen.Subj.,2005,1723(1/2/3):175-183
[12]Baumann J M,Affolter B,von Arx U,et al.Urolithiasis, 2013,41(6):467-474
[13]Sun X Y,Ouyang J M,Liu A J,et al.Mater.Sci.Eng.C, 2015,57:147-156
[14]Tong X D,Xue B,Sun Y.Biotechnol.Progr.,2001,17(1): 134-139
[15]Liu J,Li C,Yang Q,et al.Langmuir,2007,23(13):7255-7262
[16]Bharti B,Meissner J,Findenegg G H.Langmuir,2011,27(16):9823-9833
[17]WEN Xiao-Ling(温小玲),OUYANG Jing-Ming(欧阳健明). Chinese J.Inorg.Chem.(无机化学学报),2016,32(1):103-110
[18]AlkanM,DemirbasÖ,DoanM,etal.Microporous Mesoporous Mater.,2006,96(1):331-340
[19]Weichsel U,Segets D,Janeke S,et al.Cryst.Growth Des., 2015,15(8):3582-3593
[20]Rezwan K,Meier L P,Rezwan M,et al.Langmuir,2004,20(23):10055-10061
[21]Chiangjong W,Thongboonkerd V.Talanta,2012,101:240-245
[22]Cheng Z,Wu C,Yang W,et al.Ind.Eng.Chem.Res., 2010,49(18):8741-8748
[23]Wesson J A,Worcester E M,Wiessner J H,et al.Kidney Int.,1998,53:952-957
[24]Grover P K,Moritz R L,Simpson R J,et al.Eur.J.Biochem., 1998,253:637-644
[25]Kandori K,Oda S,Tsuyama S.J.Phys.Chem.B,2008,112(8):2542-2547
[26]Kandori K,Murata K,Ishikawa T.Langmuir,2007,23(4): 2064-2070
[27]Laible N J,Germaine G R.Infect.Immun.,1985,48(3): 720-728
[28]van der Veen M,Norde W,Stuart M C.Colloids Surf.B, 2004,35(1):33-40
Adsorption Properties of Cationic Protein on Nano/Micron Calcium Oxalate Crystals and a Comparison with Anionic Protein Adsorption
WEN Xiao-LingSUN Xin-YuanOUYANG Jian-Ming*
(Institute of Biomineralization and Lithiasis Research,Jinan University,Guangzhou 510632,China)
The adsorption difference of cationic protein lysozyme(LSZ)on calcium oxalate monohydrate(COM) and calcium oxalate dihydrate(COD)crystals with a size of 100nm and 3μm,respectively,were investigated and compared with that of anionic protein bovine serum albumin(BSA).All of the adsorption isotherms were fitted better with Langmuir model,indicating a monolayer adsorption of LSZ on nano/micron COD and COM surface.The maximum adsorption quality of LSZ follows the order:COD-100nm>COM-100nm>COD-3μm>COM-3μm.That is,the greater the specific surface area is,the smaller the crystal curvature would be,so the greater of LSZ adsorption amount was generated;and the more negative charges and the more crystal water on crystal surface also result in the greater of LSZ adsorption.The ionic strength and pH value of system can also affect LSZ adsorption.With the concentration of NaCl increases,the adsorption quantity of LSZ reduced,it indicated that Na+ions and cationic LSZ form a competitive adsorption,which reducing the adsorption sites of LSZ.The maximum adsorption of LSZ appears at the isoelectric point of LSZ(pH=10.7).In pH=5~8(physical condition),LSZ adsorption quantity increases with the increase of pH value.The results suggest that the adsorption quality of LSZ on nano/micron COM and COD crystals can be reduced by reducing the pH value orincreasing the ionic strength of urine appropriately,and thus the formation of CaOx urinary stones maybe inhibited.
calcium oxalate;cationic protein;lysozyme;competitive adsorption;ionic strength;pH value
R69;R329;O614.23+1
A
1001-4861(2017)01-0049-08
10.11862/CJIC.2017.013
2016-05-14。收修改稿日期:2016-11-11。
国家自然科学基金(No.21371077)资助项目。
*通信联系人。E-mail:toyjm@jnu.edu.cn
