基于DO-stat流加培养控制的海藻糖合成酶发酵条件研究
2017-02-16段莹莹曹大鹏张曰辉
段莹莹,曹大鹏,任 峰,张曰辉,赵 伟*
(山东福洋生物科技有限公司,山东德州253100)
基于DO-stat流加培养控制的海藻糖合成酶发酵条件研究
段莹莹,曹大鹏,任 峰,张曰辉,赵 伟*
(山东福洋生物科技有限公司,山东德州253100)
溶氧浓度对重组大肠杆菌的生长和外源蛋白的高效表达影响较大,为进一步增加菌体量和重组蛋白表达量,该研究采用DO-stat流加培养进行控制,分别研究了溶氧浓度20%、30%、35%和40%条件下大肠杆菌的生长情况以及海藻糖合成酶的表达情况。结果表明,当发酵罐中溶氧浓度控制在30%时,发酵40 h,菌体干质量可达53.9 g/L,是分批发酵时的6倍,海藻糖转化率达到80.9%,是分批发酵时的2.25倍。
高密度发酵;DO-stat;海藻糖合成酶
海藻糖(trehalose)是一种二糖,由两个葡萄糖分子通过α-1,1-糖苷键连接而成,作为一种添加剂、稳定剂和甜味剂已经广泛应用于食品、化妆品和医药工业等领域[1-2]。海藻糖目前的生产方法主要为酶法,其中较为简便的海藻糖生产方法[3]是利用海藻糖合成酶的分子内转糖基化作用将麦芽糖转化为海藻糖。
生产大肠杆菌(Escherichia coli)或以其构建的基因工程菌的表达产物时采用一般的发酵工艺,大肠杆菌的菌体生物量、蛋白表达量、代谢产物在发酵液中和菌体内的浓度都比较低,很难得到理想的生产效率。高密度发酵重组大肠杆菌可获得较高的生物量,但对发酵条件的要求非常高。影响高密度发酵的因素非常多,如细胞生长所需要的营养物质、发酵过程中积累的生长抑制物、培养温度、溶氧浓度、发酵液的pH值、补料方式、诱导方式等。
在大肠杆菌的高密度发酵过程中,培养液中的溶氧量对大肠杆菌生长过程中的调控具有重要的作用[4],能很好的反应大肠杆菌的生长状态。DO-stat流加培养控制的基本原理是将由于底物缺失造成的溶氧浓度上升作为补加底物的信号[5],是应用较多的一种反馈控制方式。重组大肠杆菌发酵过程中溶解氧浓度过高或过低均会抑制菌体的生长代谢,不利于产酶,为进一步增加海藻糖合成酶的表达量,提高海藻糖的转化率,采用了DO-stat法用溶氧浓度作为反馈指标来流加营养物质的发酵方式[6]。当发酵液中的底物消耗到一定程度时,细胞由于营养缺失而耗氧下降导致溶氧浓度迅速上升,但是,通过补加底物,溶氧浓度又开始下降[7]。通过这种方式,可以维持溶氧浓度在一个恒定的水平。胡沛臻等[8]采用了溶氧反馈-补料分批技术在培养基因重组工程菌E.coliBL21/pET-MHM的过程中并取得了很好的效果,菌体的密度达到了70 g/L以上,目的蛋白的表达量>菌体蛋白总量的38%。KORZ D J等[9]通过溶氧值的变化情况进行补料控制高密度培养大肠杆菌发酵过程,在补料培养阶段大肠杆菌始终处于碳源限制性生长的状态,保持着恒定的比生长速率,大肠杆菌的最终菌体密度达到148 g/L。本研究利用DO-stat流加控制方式探讨了不同溶氧浓度对重组海藻糖合成酶工程菌的发酵过程的影响,研发出了稳定高效的高密度发酵工艺,为海藻糖工业化生产提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
大肠杆菌(E.coli):山东福洋生物科技有限公司。
1.1.2 培养基
种子培养基:蛋白胨1%,酵母粉0.5%,NaCl 1%,氨苄西林钠0.01%,pH 7.0。
发酵培养基:葡萄糖2%,NaH2PO40.3%,K2HPO41%,MgSO4·7H2O 0.12%,NH4Cl 0.1%,CaCl20.001%,玉米浆0.2%,氨苄西林钠0.01%,pH 7.0。
1.1.3 试剂
海藻糖标准品:美国Sigma公司;乙腈(色谱纯):西陇化工股份有限公司;磷酸氢二钾、磷酸二氢钠、酵母粉、蛋白胨:国药集团化学试剂有限公司;葡萄糖:山东西王糖业有限公司;氯化钠、氯化铵、氯化钙、硫酸镁:天津市河东区红岩试剂厂;氨苄西林钠:山东鲁抗医药股份有限公司。
1.2 仪器与设备
15L发酵罐和过程参数检测与控制系统:上海国强生化工程;PAS7000型生物尾气分析系统:重庆哈特曼科技有限公司;Waters515泵、Waters2414型示差折光检测器的高效液相色谱仪(high performance liquid chromatography,HPLC):美国Waters公司;TP-114型电子天平:丹佛仪器有限公司;FE-20型pH计:梅特勒-托利多仪器有限公司;AH-BASIC型匀浆机:ATS工业系统有限公司;DHZ-DA型冷冻恒温振荡器:太仓市实验设备厂;SW-CJ-2D型净化工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 种子培养方法
将甘油保存液中保存的菌株以1%的接种量接到含有150 mL种子培养基的500 mL三角瓶中,37℃、200 r/min振荡培养6 h。
1.3.2 分批发酵培养方法
15 L全自动发酵罐,装液量10 L,接种量10%,接种前发酵罐内加入氨苄西林钠至100 μg/mL,设定发酵罐温度37℃,空气通量300 L/h,罐压0.02 MPa,流加25%的氨水调节pH使其维持在7.0±0.2。
1.3.3 DO-stat流加控制培养方法
在分批培养的基础上,当发酵液中的葡萄糖浓度下降且溶氧浓度上升时,通过蠕动泵自动向发酵罐内流加500 g/L的葡萄糖溶液。据报道,溶氧量维持在30%~40%[10]有利于重组大肠杆菌的生长和外源蛋白的高效表达,所以考察了20%、30%、35%和40%这几个溶氧水平对重组海藻糖合成酶工程菌发酵过程的影响。
1.3.4 测定方法
菌体干质量:取不同发酵时间的菌液15mL,10000r/min离心10 min,蒸馏水清洗2次,105℃烘干至质量恒定,用微量分析天平称量菌体干质量。
残糖:采用斐林试剂法测残糖含量,同一样品做平行实验3次。
残糖含量(%)=[空白消耗葡萄糖溶液体积(mL)-样品消耗葡萄糖溶液体积(mL)]×2×标准葡萄糖溶液的质量浓度(1 g/L)×样品稀释倍数
海藻糖转化率:准确称取转化液1.000 0 g,超纯水定容至100 mL,摇匀后超声混匀20 min,进样前用0.22 μm的滤膜过滤。HPLC测定转化液中的海藻糖含量。
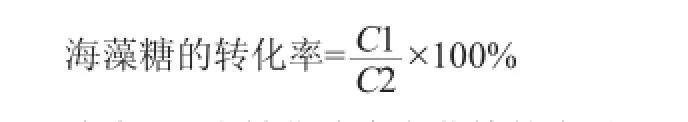
式中:C1为转化液中海藻糖的含量,g/mL;C2为发酵底物中麦芽糖的含量,g/100g。
2 结果与分析
2.1 分批发酵培养方法
在分批发酵过程中,初始糖度为25 g/L,当发酵液中葡萄糖质量浓度<10 g/L时,开始手动补加葡萄糖,使发酵液中葡萄糖浓度维持在10 g/L左右,其分批发酵过程曲线见图1。

图1 重组海藻糖合成酶工程菌分批发酵过程曲线Fig.1 Process curve of batch fermentation with trehalose synthase recombinant engineering strain
由图1可知,0~8 h为菌体生长延迟期,此时菌体正慢慢适应外界环境,糖耗速率较慢,基本不产酸;9~22 h为菌体对数生长期,此时菌体的生长速率达到最大值并保持较大值,糖耗速率明显加快,溶氧迅速下降,15 h时发酵液中葡萄糖质量浓度下降到最低值,此阶段开始周期性补加葡萄糖;23~32 h为菌体减速生长期,25 h时加入乳糖降温诱导表达海藻糖合成酶;33~40 h为细胞稳定生长期,此间糖耗速率减慢,溶氧回升,分批发酵结束,下罐后菌体干质量为8.85 g/L,海藻糖转化率为35.9%。
2.2 DO-stat流加控制培养方法
2.2.1 不同溶氧量对菌体干质量的影响
从图2可知,溶氧量对菌体干质量影响较大,发酵初期即菌体生长延迟期同分批发酵过程,控制不同溶氧水平后菌体生长差异较大。30%溶氧条件下菌体生长最快,明显优于20%、35%和40%这三个溶氧水平,发酵40 h时,菌体干质量可达53.9 g/L。

图2 不同溶氧量对菌体干质量的影响Fig.2 Effect of different dissolved oxygen concentration on cell growth
2.2.2 不同溶氧量对海藻糖转化率的影响
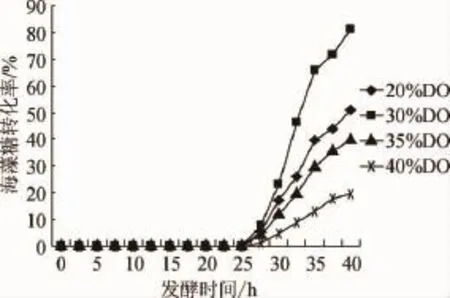
图3 不同溶氧量下产生的海藻糖合成酶随时间的变化曲线Fig.3 Change curve of trehalose synthase at different dissolved oxygen concentrations
由图3可知,发酵对数中期约25 h时加入乳糖降温诱导表达海藻糖合成酶,不同溶氧浓度下海藻糖合成酶的表达量呈现出明显的差异。当溶氧浓度控制在30%,发酵40 h时海藻糖转化率最高,达到80.9%;溶氧浓度控制在20%、35%,发酵40 h时海藻糖转化率分别为50.8%和39.8%;溶氧浓度控制在40%,发酵40 h时,其海藻糖转化率最低,可能是发酵液中溶氧浓度过高或过低均不利于海藻糖合成酶的表达。
3 结论
通过DO-stat流加策略研究溶氧浓度20%、30%、35%和40%条件下大肠杆菌的生长情况以及海藻糖合成酶的表达情况,结果表明,当发酵罐中溶氧浓度控制在30%,发酵40 h时,菌体干质量可达53.9 g/L,是分批发酵(8.85 g/L)时的6倍,海藻糖转化率达到80.9%,是分批发酵(35.9%)时的2.25倍。重组大肠杆菌发酵生产海藻糖合成酶过程中采用DO-stat流加培养控制方式,一方面可以更好地控制溶氧浓度,满足菌体生长及代谢所需的溶氧水平,另一方面可以在较短的发酵时间内实现重组大肠杆菌的高密度高表达,为工业化生产海藻糖提供理论依据和技术支持。
[1]罗明典.微生物生产海藻糖及其应用前景[J].微生物学通报,1996,23(4):252-254.
[2]李爱民,张银志,徐晖.海藻糖的研究与应用[J].汉中师范学院学报,2003,21(2):89-94.
[3]汤兴俊.海藻糖的酶法合成及在食品工业中的应用[J].中国食品添加剂,2003:35(2):19-24.
[4]俞俊棠,唐孝宣,邬行彦,等.新编生物工艺学(上)[M].北京:化学工业出版社,2003:25-30.
[5]YANO T,KUROKAWA M,NISHIZAWA Y.Optimum substrate feed rate in fedbatch culture with the DO-stat method[J].J Ferment Bioeng, 1991,71(5):345-349.
[6]YANO T,ENDO T,TUJI T,et al.Fed-batch culture with a modified DO-stat method[J].J Ferment Bioeng,1991,71(1):35-38.
[7]YANG F C,MAA D W.Fed-batch culture of yeastSaccharomyces cerevisiaewith a DO-stat method by a fuzzy controller[J].Bioproc Biosyst Eng,1998,18(2):79-82.
[8]胡沛臻,温江田,路凡,等.溶氧反馈-补料分批技术高密度培养基因重组MAGEl/HSP70/MAGE3工程菌[J].第三军医大学学报,2007,29(16):1576-1579.
[9]KORZ D J,RINAS U,HELLMUTH K,et al.Simple fed-batch technique for high cell density cultivation ofEscherichia coli[J].J Biotechnol, 1995,39(1):59-65.
[10]陈理,杨渐,俞昌喜.重组人胰岛素样生长因子-1-大肠杆菌高密度发酵研究[J].福建医科大学学报,2013,47(1):6-10.
[11]OLIVEIRA R,CUNHA A,CLEMENTE J,et al.Adaptive DO-based control of substrate feeding in high cell density cultures operated under oxygen transfer limitation[J].Adapt Nat Comp Algorithm,2005,35 (2):300-303.
[12]陈超.重组大肠杆菌高密度发酵过程建模与控制[D].大连:大连理工大学,2010.
[13]赵伟,段莹莹,张曰辉,等.HPLC法检测海藻糖的研究[J].中国酿造,2014,33(10):148-150.
[14]张曰辉,张虎,曹大鹏,等.海藻糖转化条件优化的研究[J].食品工业,2014,35(11):96-98.
[15]高超,张山,何永志,等.改造大肠杆菌合成海藻糖途径以高效合成海藻糖[J].生物工程学报,2015,31(12):1-5.
[16]陈颖,杨丽维,齐欣,等.重组海藻糖合酶工程菌高密度发酵条件的研究[J].食品工业科技,2012,33(17):154-158.
Research on trehalose synthase fermentation conditions based on DO-stat culture-feeding strategy
DUAN Yingying,CAO Dapeng,REN Feng,ZHANG Yuehui,ZHAO Wei*(Shangdong Fuyang Biotechnology Co.,Ltd.,Dezhou 253100,China)
Dissolved oxygen concentration has great effect on recombinantEscherichia coligrowth and high-efficiency expression of heterologous protein.In order to further increase the cell content and recombinantE.coliexpression,DO-stat feeding strategy was adopted.The effect of dissolved oxygen concentration(20%,30%,35%and 40%)onE.coligrowth and trehalose synthase expression were investigated respectively.Results showed that the cells dry mass reached 53.9 g/L,which was 6 times of those in fed-batch fermentation,the conversion rate of trehalose reached 80.9%,which was 2.25 times of those in fed-batch fermentation,when dissolved oxygen concentration was controlled at 30%for 40 h fermentation.
high density fermentation;DO-stat;trehalose synthase
TQ920.1
0254-5071(2017)01-0135-03
10.11882/j.issn.0254-5071.2017.01.028
2016-08-10
段莹莹(1985-),女,工程师,硕士,研究方向为微生物发酵。
*通讯作者:赵伟(1979-),女,工程师,硕士,研究方向为微生物发酵。
