干扰因子调控细菌纤维素微观结构影响研究
2017-02-16陈春涛朱春林许威震孙东平
顾 焱,陈春涛,朱春林,许威震,孙东平*
(南京理工大学化工学院,江苏南京210000)
干扰因子调控细菌纤维素微观结构影响研究
顾 焱,陈春涛,朱春林,许威震,孙东平*
(南京理工大学化工学院,江苏南京210000)
在驹形杆菌发酵过程中,通过加入二硫苏糖醇、氯霉素、吐温-80、乳化剂OP-10、石英砂和纳米二氧化硅等干扰因子对其发酵过程进行结构调控,考察产物微观形态的变化。结果表明,干扰因子可以明显改变细菌纤维素的网络结构,但是却没有对细菌纤维素的晶型产生明显的影响。在持水性方面,吐温-80可以将细菌纤维素含水量从原有的90倍提高至105倍自身质量,二硫苏糖醇和OP-10会稍微降低细菌纤维素的含水量,氯霉素和纳米二氧化硅会将持水能力降至70倍自身质量。
细菌纤维素;干扰因子;结构调控;微观结构
纤维素(cellulose)是存在于生活中一种常见的大分子多糖,不溶于水或者有机溶剂。一般树木、稻草、芦苇等作物中含有较多的纤维素。低等生物(如藻类、细菌)也会在自身的生长代谢中生成纤维素[1]。作为一种可再生材料,纤维素因其同时具有良好的生物可降解性,可以被用于生物材料研发。除此之外,纤维素在其他领域中,如化妆品、建筑材料、造纸、食品等也拥有着不可替代的地位[2]。
目前,人们可以通过四种途径获得纤维素[3],包括两种生物合成,一种是通过绿色植物进行光合作用,人们对于这类合成途径进行调控的手段起源很早,但效果不够明显;微生物合成是第二种生物合成途径,人们对于微生物的研究历史悠久,但是利用微生物获得纤维素历史不长,因此通过研究这类途径获得能够利用的纤维素前景广阔;另外两种是通过非生物的方法进行人工合成,在生物体外由纤维二糖氟化物经酶催化合成或由新戊酰衍生物开环成葡萄糖在合成纤维素[4]。人工合成纤维素聚合程度较低,难以达到自然界中纤维素聚合程度,同时合成过程中消耗的化学原料较多,容易带来较大的环境污染。植物合成的纤维素成分复杂,还有较多的木质素和半纤维素等杂质,在利用之前需要对其进行复杂的预处理。细菌纤维素不同于人工合成和天然植物合成的纤维素,不具备上述所述的缺点。一些细菌,如木醋杆菌[5],具有较高的纤维素合成能力。
传统的细菌纤维素应用方向特点是产品的附加值不够,仅仅适用于日常生活中,例如纺织和造纸。快速发展的生物纳米技术,对细菌纤维素的结构改性做出了巨大的改善使得细菌纤维素被广泛地应用于功能材料领域。WANG J等[6]利用细菌纤维素具有良好强度的特点,在其表面进行负载固定化实验,将羟基磷灰石等固定在细菌纤维素外面,得到了类似于人体骨组织质地的模型,显示了细菌纤维素在生物医学领域的良好适用性;SEOK H Y等[7]利用了碳元素具有良好的导电性的特点,将其与细菌纤维素进行复合,把原先不导电的细菌纤维素改造成导电性能良好的碳纳米管纤维,拓宽了细菌纤维素应用领域至光电材料方面;SUN D P等[8]以细菌纤维素为基础,利用PdCl2和CuCl2的水溶液浸泡细菌纤维素,再用硼氢化钾还原纤维素,将Pd-Cu合金均匀分布于细菌纤维素纤维上,利用该复合膜可以有效脱除水中的氮,显示出细菌纤维素在催化材料领域的优势;由于细菌纤维素具有较高的杨氏模量,其还可以作为复合材料的增强体。除了以上的几个方面,人们还将细菌纤维素应用于前沿科技方面,例如超级电容器、影音材料、渗透汽化、高端奢侈品等领域。
从细菌纤维素进入人们的视野以来,对于其研究和改性方法的探索层出不穷,以探索其在不同领域的更多应用。朱清梅等[9]提出,可以通过向培养基中添加一些特殊的小分子,例如荧光增白剂,从而影响细菌纤维素的聚集,达到对细菌纤维素改性的目的。KESHK S等[10]利用向发酵液中添加木素磺化盐的方法,抑制发酵生产中副产物葡萄糖酸的产生,从而提高细菌纤维素的聚合度。利用纤维素酶处理细菌纤维素,可以提高纤维素间的结合力,但是纤维素酶会降解纤维素链[11]。廖瑞金等[12]利用纳米Al2O3和ZnO对绝缘纤维素进行改造,研究了纳米改性对纸样空间的电荷行为产生的原因。蒋伟娜等[13]将梧桐树等木质纤维素经2,4,6-三氯-1,3,5-三嗪改性后,可以增加木质纤维素对木瓜蛋白酶的固定化效果。蓝舟琳等[14]利用绿色木霉对玉米秸秆进行固态发酵,发现了绿色木霉改性玉米秸秆的最佳条件,使改性材料的吸油量达到了未改性材料的两倍以上。
目前,较为常见的纤维素改性方法分为以下三类:物理改性(如干法或湿法研磨);化学改性(如酯化和醚化);生物改性(如酶水解、氧化)[15]。本研究采用化学改性方法,向发酵液中加入干扰因子,改变纤维素交联聚合方式,探究其微观结构图特征、结晶形态、含水量以及复水率在改性前后的变化。期望通过这一系列的研究,更加深入地了解微生物代谢制备纳米纤维素的过程,为实际应用提供指导。
1 材料与方法
1.1 材料与试剂
驹形杆菌(Komagataeibactersp.):本实验室自行筛选;葡萄糖、蔗糖、磷酸二氢钾、硫酸铵、硫酸镁、柠檬酸、磷酸二氢钠、琼脂粉、石英砂(50目)、纳米二氧化硅:国药集团化学试剂有限公司;蛋白胨:上海博微生物科技有限公司;酵母浸粉:北京奥博星生物技术有限公司;羧甲基纤维素钠:成都市科龙化工试剂厂;二硫苏糖醇(DL-dithiothreitol,DTT):北京浩克生物科技有限公司;氯霉素:湖北中料化工有限公司;吐温-80:郑州康源化工产品有限公司;乳化剂OP-10:衢州市瑞尔丰化工有限公司。所用试剂均为分析纯或生化试剂。
固体培养基组成:葡萄糖2.0g/100mL,蔗糖1.0g/100mL,硫酸镁0.04 g/100 mL,柠檬酸0.11 g/100 mL,磷酸二氢钠0.25 g/100 mL,蛋白胨1.0 g/100 mL,琼脂1.8 g/100 mL,酵母浸粉0.1 g/100 mL,pH 6.0,121℃灭菌20 min。
种子液组成:葡萄糖2.0g/100mL,硫酸铵0.6g/100mL,磷酸二氢钾0.1 g/100 mL,硫酸镁0.04 g/100 mL,蛋白胨0.3 g/100 mL,酵母浸粉0.225 g/100 mL,羧甲基纤维素钠0.04 g/100 mL,121℃灭菌20 min。
发酵液组成:葡萄糖2.25g/100mL,蔗糖2.75g/100mL,硫酸铵0.1 g/100 mL,磷酸二氢钾0.5 g/100 mL,硫酸镁0.07 g/100 mL,乳酸钙0.02 g/100 mL,蛋白胨1.0 g/100 mL,酵母浸粉0.75 g/100 mL,醋酸0.15 g/100 mL,羧甲基纤维素钠0.04 g/100 mL,柠檬酸0.06 g/100 mL,pH 6.0。
1.2 仪器与设备
ALC-110.4分析天平:德国艾科勒公司;雷磁PHSJ-5型pH计:上海仪电科学仪器股份有限公司;莱玻特瑞ZHPW-70恒温培养箱:天津市莱玻特瑞仪器设备有限公司;FD-1B-50冷冻干燥机:北京博医康实验仪器有限公司;JEOL JSM-6380LV扫描电子显微镜(scanning electron microscope,SEM):日本电子株式会社。
1.3 方法
1.3.1 原位修饰的纤维素膜的制作方法
将-80℃、30%甘油中保存的Komagataeibactersp.取出,于30℃条件下静置20 min,用接种环挑取一环菌种划线于固体平板培养基中,将平板培养基于30℃培养箱中静置培养36 h。
用接种环挑取已经活化的Komagataeibactersp.两环,接种到装有1/5种子液的500mL锥形瓶中,30℃条件下150r/min培养24 h。
把种子液接种到含有装有1/5发酵液的500 mL锥形瓶中,30℃条件下160 r/min进行72 h动态培养。动态培养的同时,加入不同的干扰因子,对整个细菌纤维素的生产发酵过程进行干扰。
在此过程中,能够获得经过干扰因子干扰的非正常聚集的细菌纤维素。为了能够更好的得到原位修饰的细菌纤维素,本实验将干扰因子的量设置为:二硫苏糖醇15.4 mg、氯霉素9.7 mg、吐温-80 500 mg、乳化剂OP-10 500 mg、石英砂2 g、纳米二氧化硅400 mg。为以上改性过的产物命名为BC-A、BC-B、BC-C、BC-D、BC-E和BC-F。
后处理:用1 mol/L的NaOH于80℃水浴60 min,取出后用醋酸中和多余的NaOH,用水将多余的醋酸冲洗干净,冷冻干燥机干燥24 h,放置于干燥器内备用。
1.3.2 微观结构形态的表征
对所得原位修饰细菌纤维素进行扫描电镜观察。将样品进行冷冻干燥,剪取一块5 mm×5 mm的样品,用导电胶将其固定于样品台,在真空的条件下对其进行喷金操作处理,将倍率调节至10 000倍,进行微观结构的观察。
1.3.3 结晶状态表征
将所得原位修饰细菌纤维素进行X射线衍射分析(Bruker AxS GmbH D8),可以得到改性材料的晶体结构。把冻干之后的细菌纤维素,贴上双面胶然后固定在样品台中央,利用铜靶发出的Kα射线,将波长设置为1.540 6 。以0.05°/0.1s、40kV、40mA、2θ为10~40°条件下进行扫描。
1.3.4 测定方法
为了去除不必要的水分,将含有较多水分的改性纤维素常温常压静置5 min,然后再用滤纸将残余的水分全部吸收干净。滤纸吸收过后的纤维素质量,将其记为Wwet;将称完的细菌纤维素利用冻干机进行冻干,得到绝干质量并记为Wdry。按照公式(1)计算即可得到纤维素含水量:

在去离子水中对纤维素进行复水能力测试,将冻干的纤维素进行反复浸泡,反复称质量,直到其质量不再增加,将最后一次称得的质量记为Wrwet。按照公式(2)计算即可得到纤维素的复水率:
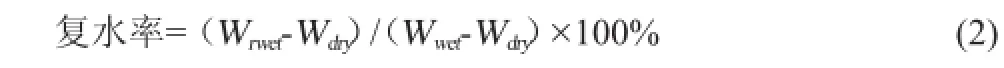
2 结果与分析
2.1 原位修饰纤维素的微观形态结构
将不同的干扰因子进行原位修饰过的细菌纤维素放在扫描电镜下进行观察,并和没有加入干扰因子的细菌纤维素进行对比,结果如图1所示。

图1不同干扰因子干扰的纤维素SEM图Fig.1 SEM images of bacterial cellulose interfered by different interference factors
图1 (a)对应的是经过生物还原剂二硫苏糖醇(DTT)修饰的细菌纤维素,将其和未修饰的纤维素SEM图对比,不难看出,原本有序的结构变得相对混乱,纤维和纤维之间的孔隙也较未加入干扰因子的要大许多。与二硫苏糖醇修饰的细菌纤维素不同,氯霉素对细菌纤维素的影响主要体现在,它能够减少单位体积内的纤维素数量,同时形成相对较大的结团,使纤维素质地分布更加不均匀,如图1(b)所示。文献报道[16]指出,二硫苏糖醇和氯霉素都能够让细菌的形态发生一定的变化,不同的是,二硫苏糖醇会使细胞变得短小,而氯霉素则是会使细胞变得修长。变长的细胞在产生纤维的时候,两个细胞缠结在一起的概率会增大,从而产生的纤维素也就更加容易结团。
同时发现,同时具有亲水基团和疏水基团的表面活性剂吐温-80会让原本尺寸大小均匀的细菌纤维素变得粗细不一,同时失去三维立体轮廓,如图1(c)所示。因为表面活性剂能在纤维之间产生作用[17],让原本相互分离的根状纤维中间生成薄膜状或者是片状联结。图1(d)显示的是乳化剂OP-10进行原位修饰的细菌纤维素SEM图。由图1(d)可以看出,乳化剂OP-10修饰的细菌纤维素微观结构与未修饰的细菌纤维素最相似,只不过略微增大了细菌纤维素的尺寸。
由图1(e)可以看出,加入石英砂之后,整个纤维素网络结构显得更加致密,伴随着明显的纤维素的尺寸增大。因为石英砂的加入使得整个体系的扰动程度更高,随之而来的是更加剧烈的细菌运动,这样两个细菌运动到同一点的概率也会随之增加,带状纤维素也就更加容易联结在一起。细菌所处的环境扰动程度越大,其产生的纤维素直径就会越小,而增加体系环境的剪切力则会增大生成产物的尺寸。最终在SEM图上显示的结果是石英砂的加入会使纤维素带的尺寸较未加入的增大,这说明,石英砂带来的体系扰动效果要远远小于其为体系增加的剪切力。
纳米二氧化硅的加入让纤维素丝状结构变得绵密、修长,同时还增加了纤维素形成时候的方向性。原因在于加入的干扰因子表面具有丰富的可以形成氢键的羟基基团,这些基团和发酵过程中生成的纤维素之间形成作用力非常强的氢键,破坏了纤维素原有的聚集方式,同时,这种氢键的存在还具有一定的诱导效果,这就令纤维素在最终成膜的时候具有更好的方向性,如图1(f)所示。
由图1(g)可以看出,不添加任何干扰因子的细菌纤维素网络结构清晰、相对较为疏松,纤维直径变化较为均匀。
2.2 原位修饰纤维素的晶体结构
原始细菌纤维素与经过干扰因子原位修饰后产物的X射线衍射图谱见图2。不同干扰因子对细菌纤维素结晶度影响见表1。
从图2可以得到,当2θ角为22.7°和14.6°时,生成了两个突出的衍射峰,其中22.7°的衍射峰对应的为(200)晶面,14.6°对应的为(110)晶面。这证明未修饰的细菌纤维素为聚合度非常高的天然纤维素,即Ⅰ型纤维素。由于22.7°和14.6°的峰存在于每一种纤维素中,说明干扰因子并没有对细菌纤维素的晶型产生明显的影响变化。但是,纤维素的聚合度会受到一定的影响,这一点从(110)晶面衍射角的偏移与强度的变化可以推测,其中,BC-A、BC-C、BC-D的SEM图中的14.6°的衍射峰的偏移和强度变化最明显,说明这三种干扰因子对于纤维素的聚合度有重要影响。BC-F的SEM图在22.7°处的峰强度变得更大,说明该改性纤维素在(200)晶面形成速度比较快。除了上述两个角度的吸收峰之外,在16.8°的时候有一个(110)晶面吸收峰,干扰因子中的五个都减弱了这一晶面的生长,纳米二氧化硅除外。
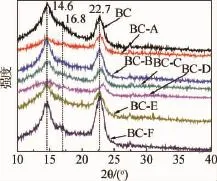
图2 不同干扰因子干扰的纤维素的X射线衍射图谱Fig.2 X-Ray diffraction spectrum of bacterial cellulose interfered by different interference factors
可以利用式(3)计算纤维素的结晶度[18]:
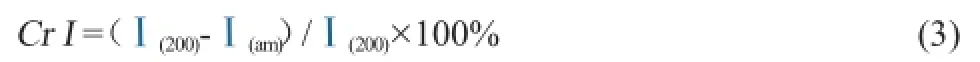
式中:Cr I表示结晶指数,%;Ⅰ(200)表示(200)晶面峰强;Ⅰ(am)表示无定形区峰强。

表1 不同干扰因子干扰的纤维素的结晶指数Table 1 Crystallinity indexes of bacterial cellulose interfered by different interference factors
由表1可知,一般采用摇瓶作为动态培养的条件,得到的细菌纤维素的结晶度达81%,在这次试验中,不管是否添加了干扰因子,纤维素膜结晶度骤降至50%左右,很大一部分原因是干燥方式的变化导致了结晶度的下降[19],因为试验中采用了冻干来去除水分,导致水在凝固的过程中撑大了纤维素的内部结构,从而让结构变得疏松,结晶度下降。
因为二硫苏糖醇和氯霉素仅仅只是对细菌的形态产生了一定的影响,几乎没有改变系统的内部作用力,所以对纤维素晶体结构产生的影响很小。表面活性剂的加入,打乱了原有的相对有序的结晶过程,而且其能够和纤维素链产生一定的相互联结作用,这种作用会使得纤维素之间的相互聚集受到一定的阻碍,从而干扰了纤维素的自组装过程。石英砂的加入破坏了利于结晶形成的稳定环境,从而降低了纤维素的结晶度。结晶度有所提高的是纳米二氧化硅的加入,因为纳米二氧化硅表面有很多的亲水基团,和纤维素作用之后能够让纤维素的组装变得更加具有方向性,提高结晶度。
2.3 原位修饰纤维素含水量和复水率的变化
添加不同干扰因子对纤维素生产过程进行原位修饰,修饰后的细菌纤维素含水量可见图3。原始细菌纤维素是一种非常好的持水材料,因为其外表有很多亲水基团,这些基团能够牢牢地锁住水分,当含水量最大时,细菌纤维素中的水的质量可以达到自身的90倍。改变原始含水量可以将细菌纤维素应用到更多的方面。
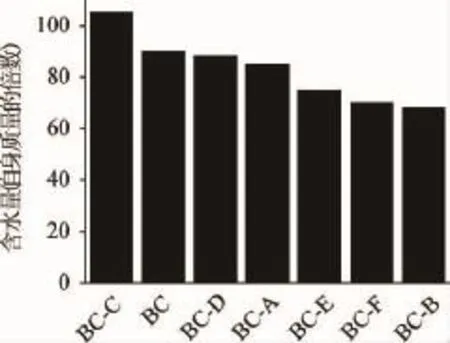
图3 不同干扰因子干扰的纤维素的含水量Fig.3 Water holding capacity of bacterial cellulose interfered by different interference factors
从图3可以看出,BC-C的含水量明显提高,BC-D、BC-A的含水量较未加入干扰因子前变化不大,而BC-B的含水量大大降低,仅为自身质量的70倍左右。
冷冻干燥技术可以在不破坏细菌纤维素原有的三维网状结构的前提下,对细菌纤维素进行啊最大限度的除水。如需测得细菌纤维素复水率,只需将冻干后的纤维素浸泡在去离子水中,这样干膜能快速吸水,在短时间内负载大量的水分子。不同原位修饰的细菌纤维素短时间(10 min)的复水能力及最终的复水率(24 h)见图4。
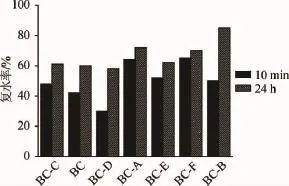
图4 不同干扰因子干扰的纤维素的复水率Fig.4 Rehydration ratio of bacterial cellulose interfered by different interference factors
从图4可以看出,除了BC-D在10 min复水量稍微小一些,仅有30%左右,另外5个干扰因子干扰得到的细菌纤维素的快速复水能力均可以达到50%以上。10 min内附水量最快的是BC-A和BC-F。24 h后,认为细菌纤维素已经复水完全,发现5种原位修饰纤维素均能够恢复60%含水量,只有BC-D除外。最终复水能力最强的是BC-B,为80%。
3 结论
本研究在Komagataeibactersp.产纳米纤维素的代谢过程中加入干扰因子,通过干扰因子和纳米纤维素间的相互作用,一定程度改变发酵体系微扰动程度,从而对纳米纤维素表面的三维微结构进行调控。由于其未改变纳米纤维素的晶型,故仍然可以认为改性后的纤维素为Ⅰ型天然纤维素。改性后的纳米纤维素含水量和复水率都发生了一定的变化,本研究为以后探索纳米纤维素的改性和应用提供了一定参考依据。
[1]孙勇慧,刘鹏涛,刘忠.细菌纤维素的应用进展[J].材料导报,2015,29(5):62-67.
[2]罗成成,王晖,陈勇.纤维素的改性及应用研究进展[J].化工进展,2015,34(3):767-773.
[3]KLEMM D,SCHUMANN D,UDHARDT U,et al.Bacterial synthesized cellulose-artificial blood vessels for microsurgery[J].Progr Polym Sci, 2001,26(9):1561-1603.
[4]王银存,李利军,马英辉,等.细菌纤维素生产及应用研究进展[J].中国酿造,2011,30(4):20-23.
[5]余晓斌,全文海.细菌纤维素的商业化用途[J].纤维素科学与技术,1999,7(3):42-46.
[6]WANG J,WAN Y Z,HAN J,et al.Nanocomposite prepared by immobilising gelatin and hydroxyapatite on bacterial cellulose nanofibers[J]. Micro Nano Lett,2011,6(3):133-136.
[7]SEOK H Y,JIN H J,KOOK M C,et al.Electrically conductive bacterial cellulose by incorporation of carbon nanotubes[J].Biomacromolecules, 2006,7(4):1280-1284.
[8]SUN D P,YANG J Z,LI J,et al.Novel Pd-Cu/bacterial cellulose nanofibers:Preparation and excellent performance in catalytic denitrification[J].Appl Surf Sci,2010,256(7):2241-2244.
[9]朱清梅,冯玉红,林强,等.细菌纤维素改性研究进展[J].现代化工,2009(8):34-37.
[10]KESHK S,SAMESHIMA K.Influence of lignosulfonate on crystal structure and productivity of bacterial cellulose in a static culture[J]. Enzyme Microb Tech,2006,40(1):4-8.
[11]赵艳锋.纤维素的改性技术及进展[J].天津化工,2006,20(2):11-14.
[12]廖瑞金,聂仕军,周欣,等.物理改性纤维素绝缘材料亲水性行为的分子动力学模拟[J].高电压技术,2013,39(1):1-7.
[13]蒋伟娜,邱业先,李琳.改性树木纤维素固定化木瓜蛋白酶的研究[J].食品工业科技,2013,34(8):131-134.
[14]蓝舟琳,彭丹,郭楚玲,等.绿色木霉改性玉米秸秆溢油吸附剂的制备及其性能研究[J].环境科学,2013,34(4):1605-1610.
[15]罗成成,王晖,陈勇.纤维素的改性及应用研究进展[J].化工进展,2015,34(3):767-773.
[16]YAMANAKA S,SUGIYAMA J.Structural modification of bacterial cellulose[J].Cellulose,2000,7(3):213-225.
[17]HUANG C H,LI C C,SHIH B L,et al.In situ modification of bacterial cellulose network structure by adding interfering substances during fermentation[J].Bioresource Technol,2010,101:6084-6091.
[18]FOCHER B,PALMA M T,CANETTI M,et al.Structural differences between non-wood plant celluloses:evidence from solid state NMR,vibrational spectroscopy and X-ray diffractometry[J].Ind Crop Prod, 2001,13(3):193-208.
[19]CLASEN C,SULTANOVA B,WILHELMS T,et al.Effect of different drying processes on material properties of bacterial cellulose membranes[J].Macromol Symp,2006,244:48-58.
Effect of interference factors on the regulation of bacterial cellulose microstructure
GU Yan,CHEN Chuntao,ZHU Chunlin,XU Weizhen,SUN Dongping*(School of Chemical Engineering,Nanjing University of Science and Technology,Nanjing 210000,China)
During the fermentation ofKomagataeibactersp.,the regulation and change of bacterial cellulose microstructure were investigated using dithiothreitol,chloramphenicol,Tween-80,emulsifier OP-10,quartz sand and nano-silica as interference factors.The results showed that interference factorscould obviouslychange bacterialcellulose'snetwork structure,butcould not significantlyaffect the crystalline phase of bacterial cellulose.In the aspect of water holding capacity,Tween-80 could improve water content from 90 to 105 times of its own mass,dithiothreitol and OP-10 could decrease bacterialcellulose water contentslightly,butchloramphenicoland nano-silica could decrease the water holdingcapacityto 70 timesofitsown mass.
bacterial cellulose;interference factors;structure regulation;microstructure
TQ92
0254-5071(2017)01-0044-05
10.11882/j.issn.0254-5071.2017.01.009
2016-07-14
国家自然科学基金(21206076,5157212);江苏高校优势学科建设工程资助项目
顾焱(1992-),男,硕士研究生,研究方向为细菌纤维素的改性应用。
*通讯作者:孙东平(1970-),男,教授,博士,研究方向为化学生物学与功能材料。
