枯草芽孢杆菌PNG27生产凝乳酶的发酵工艺优化及分离纯化研究
2017-02-15陈蕊别小妹吕凤霞赵海珍张充陆兆新
陈蕊,别小妹,吕凤霞,赵海珍,张充,陆兆新
(南京农业大学,江苏 南京,210095)
枯草芽孢杆菌PNG27生产凝乳酶的发酵工艺优化及分离纯化研究
陈蕊,别小妹,吕凤霞,赵海珍,张充,陆兆新*
(南京农业大学,江苏 南京,210095)
通过单因素试验、Plackett-Burman试验设计、Box-Behnken响应面试验设计对培养基成分及发酵条件进行了优化,使最终发酵液凝乳酶活力达到222.34 ± 4.99 U/mL。采用乙醇分级沉淀、DEAE-纤维素离子交换柱层析和Sephadex G-100分子筛等分离手段对枯草芽孢杆菌PNG27凝乳酶进行分离纯化,得到电泳纯的凝乳酶。结果表明,酶的比活力达到794.30 U/mg,纯化倍数为8.29倍,最终回收率为4.25%,SDS-PAGE电泳分析凝乳酶分子质量约为42 kDa。
枯草芽孢杆菌;凝乳酶;发酵优化;分离纯化
干酪生产所用的凝乳酶主要是从未断奶的小牛第四胃中提取的活性皱胃酶,随着干酪市场的发展,凝乳酶的需求量大增,单纯依靠屠宰大量小牛获取凝乳酶显然与现代工业的发展需求不相符[1-3]。因此,研究开发不同来源的凝乳酶替代小牛凝乳酶已成为当前干酪工业发展的重点[4]。目前,国际市场上的凝乳酶主要有动物源凝乳酶、植物源凝乳酶以及微生物源凝乳酶[5]。动物源凝乳酶的凝乳活力与蛋白水解能力的比值高,但是动物生长较慢且价格较高,不适应当今发展的需要;植物源凝乳酶凝乳能力强,脂肪损失少,但其制成的干酪有一定的苦味且生产受时间、地域等条件制约[6-8];而微生物源凝乳酶凭借其凝乳活力高、产量大、生长期短、成本低、制备简单、易于控制等优点成为当前的研究热点[9]。
自1968年ARIMA[10]发现真菌微小毛霉(Mucorpusillus)可产生高活力的凝乳酶后,国外研究者对真菌来源凝乳酶进行了大量研究,陆续发现毛霉属、曲霉属等真菌可产凝乳酶。目前已发现有100余种微生物可生产一定活力的凝乳酶,主要是真菌、放线菌、细菌等。相对于真菌的固态发酵,细菌深层发酵产酶拥有更高的材料利用率且更易于控制[11],目前细菌凝乳酶的研究报道主要包括枯草芽孢杆菌(Bacillussubtilis)[12]、蜡样芽孢杆菌(Bacilluscereus)[13]、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)[14]和地衣芽孢杆菌(Bacilluslicheniformis)[15]等等。
枯草芽孢杆菌是一种非常重要的产酶菌,主要原因在于它能够产生和分泌大量的胞外酶,也是目前国内外报道较多的产凝乳酶的细菌[6]。枯草芽孢杆菌所产凝乳酶热稳定性好且对牦牛乳具有更高的凝乳活性,所以运用枯草芽孢杆菌生产凝乳酶的相关研究对牦牛乳工业具有比较深远的意义[12]。
本研究利用枯草芽孢杆菌PNG27发酵生产凝乳酶,通过单因素试验、PB试验设计、Box-Behnken响应面试验设计对培养基成分及发酵条件进行了优化;并对发酵液采用乙醇分级沉淀,DEAE-纤维素离子交换层析和Sephadex G-100分子筛层析得到电泳纯的凝乳酶,为后续的实践应用奠定了基础。
1 材料与方法
1.1 材料与试剂
菌种: 枯草芽孢杆菌PNG27,本实验室保存。
培养基: 营养琼脂(NA)培养基;BPY培养基;发酵培养基:麸皮40.0 g,蔗糖40.0 g,NaCl 10.0 g,蒸馏水1 000 mL,pH=7.0。
1.2 仪器与设备
恒温培养箱、全温摇瓶柜、高速冷冻离心机、DF-1集热式磁力加热搅拌器、HL-2恒流泵、DBS-100电脑全自动部分收集器、UV-2450型紫外分光光度计、数显恒温水浴锅、荧光酶标仪。
1.3 实验方法
1.3.1 菌种活化及种子液制备
从保藏的枯草芽孢杆菌PNG27中挑取部分接到NA斜面,于37 ℃培养24 h,然后将BPY培养基作为种子培养基,从活化后的菌株斜面上转移菌株至BPY培养基中(接种量为2环),37 ℃,180 r/min条件下培养11 h作为种子液。
1.3.2 培养基优化
1.3.2.1 单因素试验
按1.3.1 方法制备种子液,产凝乳酶的培养基成分及发酵条件根据具体实验设计改变各参数的变量。在单因素试验中,麸皮含量为1%、2%、3%、4%、5%;选取最适麸皮含量后以20 g/L的葡萄糖、蔗糖、小麦粉、玉米粉和乳糖作为复合碳源添加,考察复合碳源对产酶的影响,选取最适复合碳源,研究碳源浓度对产酶的影响;确定碳源后以10 g/L的NaCl、CaCl2、MgCl2、KCl、ZnCl2作为金属离子添加,考察金属离子对产酶的影响,选取最适金属离子研究其浓度对产酶的影响。
确定最佳麸皮含量、复合碳源和金属离子后,试验同样采用单因素优化的方法对枯草芽孢杆菌PNG27液体发酵产凝乳酶的培养条件包括接种量、装液量、初始pH、发酵温度和发酵时间进行优化研究。分别以1%、2%、3%、4%、5%、6%的接种量接种;100 mL 三角瓶中的装液量依次采用10、20、30、40、50 mL;培养基初始pH 依次采用5、6、7、8、9;培养温度依次采用27、30、33、37、40 ℃;发酵时间依次采用12、24、36、48、60 h,摇床培养后分别测定凝乳酶活力,每个试验均为平行试验取平均值。
1.3.2.2 PB试验设计
依据1.3.2.1中对碳氮源、金属离子及发酵条件的筛选,枯草芽孢杆菌PNG27的发酵培养基的影响因素为麸皮、蔗糖、NaCl的添加量,发酵条件为接种量、初始pH、发酵温度、发酵时间和装液量。试验设计、数据分析和模型建立都采用软件Design-Expert(Version8.0.5,Stat-Ease Inc),每组试验3次重复,结果取平均值。
1.3.2.3 Box-Behnken响应面试验设计
根据PB试验结果中筛选出对凝乳活性影响显著的因素,结合因素的效应大小和试验中的实际情况,选择中心点和各水平的步长,各水平及代码。借助试验设计及分析软件Design-Expert(version8.0.5,Stat-Ease Inc.),每组试验重复3次,结果取平均值。
1.3.3 分离纯化
1.3.3.1 乙醇分级沉淀
1 000 mL枯草芽孢杆菌凝乳酶的发酵液经8 000 r/min 离心10 min,离心温度4 ℃,收集上清液。将上清液置于磁力搅拌器中搅拌,冰浴条件下,缓慢加入预先冷却的乙醇,使其体积分数达到50%,8 000 r/ min 离心10 min,离心温度4 ℃,收集上清液。冰浴条件下继续向上清液中缓慢加入预先冷却的乙醇,使其饱和度达到70%,4 ℃静置过夜。8 000 r/ min 离心15 min,离心温度4 ℃,弃上清液,沉淀溶于0.05 mol/L的磷酸钠缓冲液中即得粗酶液。
1.3.3.2 DEAE-纤维素离子交换层析
取1 mL 粗酶液,采用高盐离子浓度梯度分离纯化蛋白,DEAE-纤维素离子交换层析柱预先用0.05 mol/L,pH值为6.8的磷酸钠缓冲液平衡,以含有不同NaCl浓度(0、0.1、0.3、0.5 mol/L)的0.05 mol/L,pH值为6.8的磷酸钠缓冲液进行梯度洗脱(0.5 mL/min),收集合并吸收峰,超滤浓缩后测定酶活力。
1.3.3.3 Sephadex G-100分子筛层析
Sephadex G-100装柱后先用0.05 mol/L,pH值为6.8的磷酸钠缓冲液平衡,取1 mL DEAE-纤维素离子交换柱收集的酶液上柱,用0.05 mol/L,pH值为6.8的磷酸钠缓冲液洗脱(0.5 mL/min),检测波长280 nm,收集合并洗脱峰,超滤浓缩后测定酶活力。
1.3.4 SDS-PAGE 电泳
取30 μL样品与10 μL上样缓冲液混合,沸水浴5 min,5 000 r/ min 离心5 min,取20 μL上清进行SDS-PAGE电泳(分离胶浓度12%,浓缩胶为3%)。电泳结束后凝胶用考马斯亮蓝R-250染色,脱色液脱色。
1.3.5 蛋白含量测定
蛋白含量测定采用考马斯亮蓝法[16]。1 mL样品加入5 mL蛋白试剂(100 mg考马斯亮蓝G-250溶于50 mL 95%乙醇中,再加100 mL85%磷酸,用双蒸水补至1 000 mL),充分振荡混匀,2 min后于595 nm处测定光吸收值。以1 mL重蒸水作为空白对照。
1.3.6 蛋白水解活力测定
蛋白水解活力测定采用Twinning法[17],制作异硫氰酸荧光素标记的蛋白样品,20 μL标记蛋白中加入20 μL pH 6.0的0.01 mol/L磷酸盐缓冲液和10 μL酶液,37 ℃,180 r/min反应1 h后加入120 μL预冷的5%TCA,室温静置1 h后离心取上清,利用荧光酶标仪在激发波长490 nm、发射波长525 nm条件下测定荧光强度。把37 ℃,1 h水解1 μg荧光标记蛋白所需的酶量定义为1个酶活力单位。
1.3.7 凝乳酶活力检测
凝乳酶活性测定采用ARIMA[10]方法。具体如下:用0.01 mol/ L CaC12溶液配制10% 的脱脂乳液。该溶液配制后在室温静置40 min后使用。取5 mL 10%脱脂乳液于试管中,35 ℃保温10 min,加入1 mL适当稀释的酶液(酶液35℃保温10 min),立刻摇匀,开始计时,倾斜试管并旋转,记录从开始到试管壁出现絮状物的时间(s),把40 min凝结1 mL 10%脱脂乳液的酶量定义为1个索氏单位(Soxhlet unit)。酶活力及酶活力回收率计算公式如下:

(1)
(2)
式中:t为凝乳时间,s;n为稀释倍数。
2 结果与分析
2.1 单因素试验
2.1.1 麸皮质量浓度
如图1所示,随着麸皮质量浓度的增加,凝乳酶活力增加,当浓度达到40 g/L时,凝乳酶的活力达到最高值,之后随着麸皮浓度的增加凝乳酶活力降低。麸皮含有15%左右的蛋白质以及硫胺素、核黄素、尼克酸等微生物生长必须的生长素,本身的C/N比适宜,适于枯草芽孢杆菌发酵,而且价格低廉,所以选择麸皮作为基础的培养基成分。
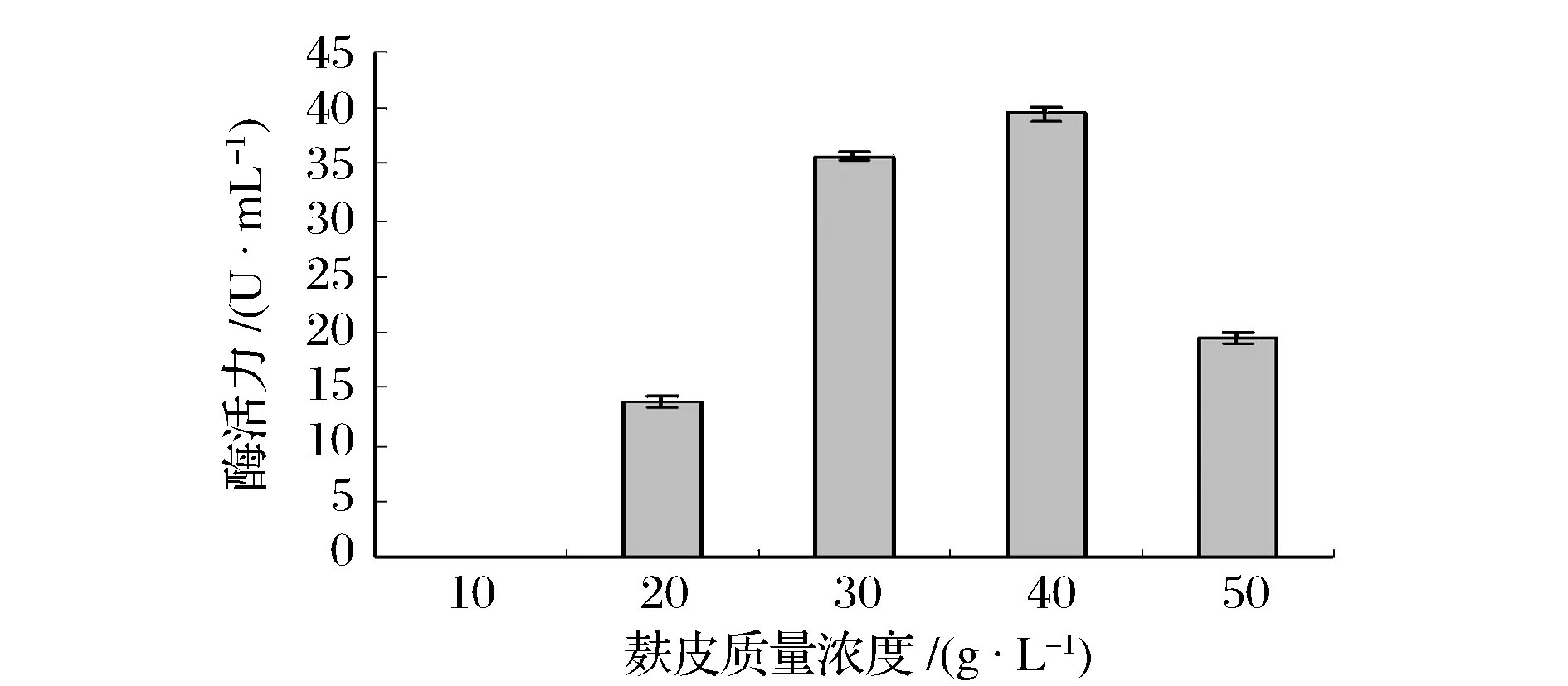
图1 麸皮质量浓度对凝乳酶活力的影响Fig.1 Effect of wheat bran concentration on MCE activity
2.1.2 复合碳源确定
如图2所示,葡萄糖、蔗糖作为复合碳源时所得酶活力都比对照组高,且蔗糖作为复合碳源时,菌株产凝乳酶活力最高,说明其更易于被枯草芽孢杆菌PNG27利用,为其发酵过程提供能量,故选择蔗糖作为培养基的复合碳源。随后对蔗糖添加量进行研究,将培养基中蔗糖添加量调整为10、20、30、40、50 g/L,如图3所示,随着蔗糖添加量的增加,凝乳酶活力也在增加,当蔗糖浓度达到40 g/ L 时,凝乳酶活力达到最大值61.66 ± 1.5 U/ml,随后随着蔗糖添加量的增加凝乳酶活力降低,说明蔗糖添加量为40 g/L时更利于枯草芽孢杆菌PNG27产酶。
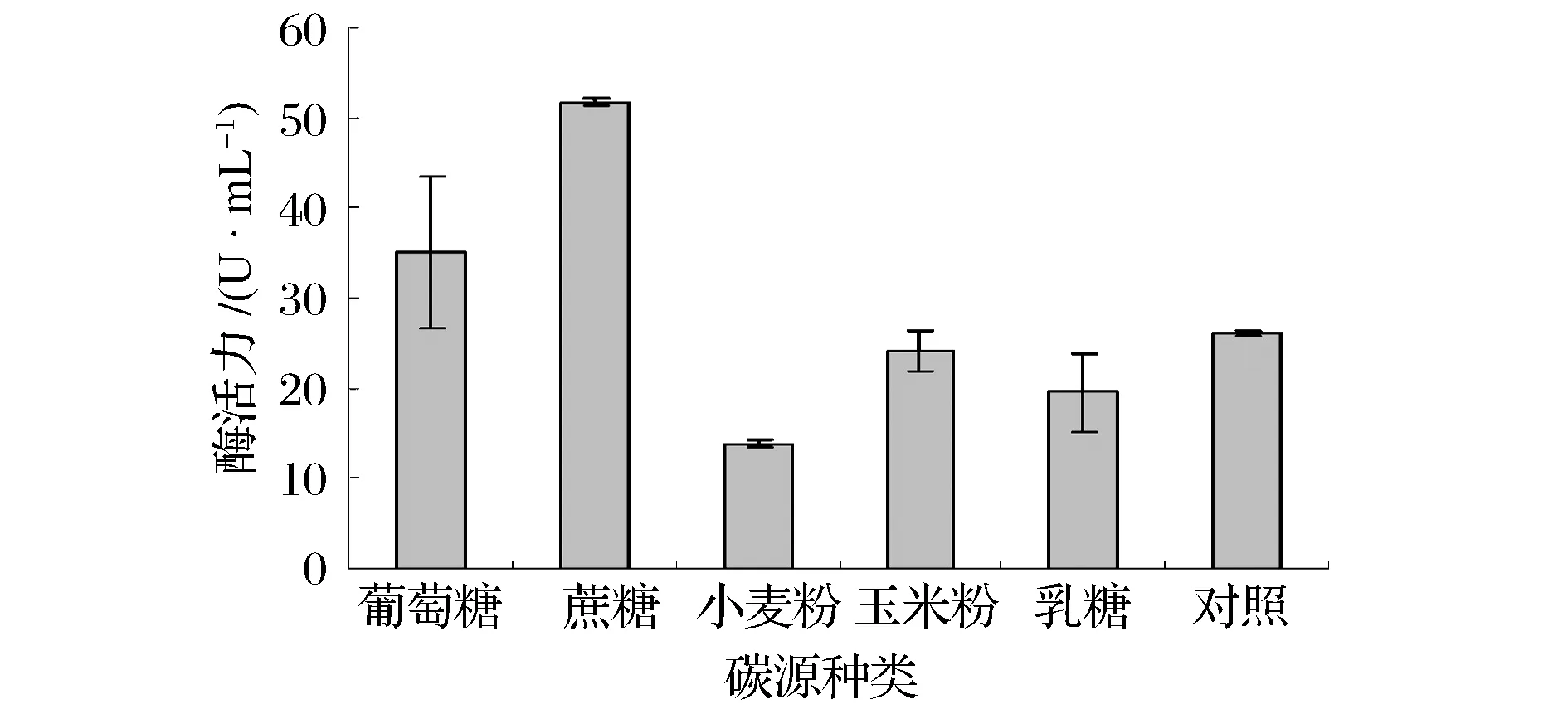
图2 不同复合碳源对产凝乳酶活力的影响Fig.2 Effect of different carbon sources on MCE activity

图3 蔗糖质量浓度对凝乳酶活力的影响Fig.3 Effect of sugar contents on MCE activity
2.1.3 金属离子确定
如图4所示,CaCl2、KCl和NaCl作为金属离子添加时相对于对照组酶活力显著提高,当NaCl质量浓度为10 g/L时酶活力达到100.73 ± 4.29 U/mL,高于CaCl2、KCl,所以选择NaCl作为培养基的金属离子。随后对NaCl添加量进行研究,将培养基中NaCl添加量调整为0、10、20、30、40 g/L,如图5所示,当NaCl 添加量为10 g/L时,凝乳酶活力达到最大值,随着NaCl添加量的增加,凝乳酶活力逐渐降低。

图4 不同金属离子对凝乳酶活力的影响Fig.4 Effect of different metal ions on MCE activity

图5 NaCl添加量对凝乳酶活力的影响Fig.5 Effect of NaCl content on MCE activity
2.1.4 发酵条件优化
如图6所示,酶活力随着接种量、pH、发酵温度、发酵时间的增加呈现先上升后下降的趋势,酶活力分别在接种量4%、初始pH 7、发酵温度33 ℃、发酵时间48 h时达到最大值,而装液量为100 mL/L时,酶
活力最高。枯草芽孢杆菌是好氧细菌,低的装液量可以使得液体培养基中溶解更多氧,满足菌体生长以及代谢的需要,使得凝乳酶的产量增加。
2.2 PB试验设计
选用N=12的PB设计安排,对培养基组分:麸皮、蔗糖、NaCl添加量和发酵条件:接种量、发酵温度、装液量、pH和发酵时间共8个因素进行研究,根据前期实验确定各因素的水平。各因素及其代码、编码水平如表1所示,响应值为凝乳酶活力。PB试验设计结果和显著性检验如表1和表2所示。
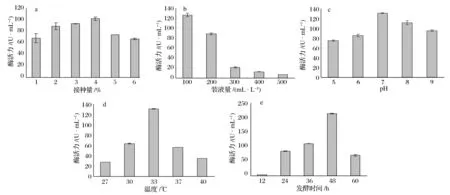
图6 接种量(a)、装液量(b)、初始pH(c)、温度(d)、时间(e)对凝乳酶活力的影响Fig.6 Effect of inoculums size(a), liquid volume(b), initial pH(c), temperature(d), time(e) on MCE activity
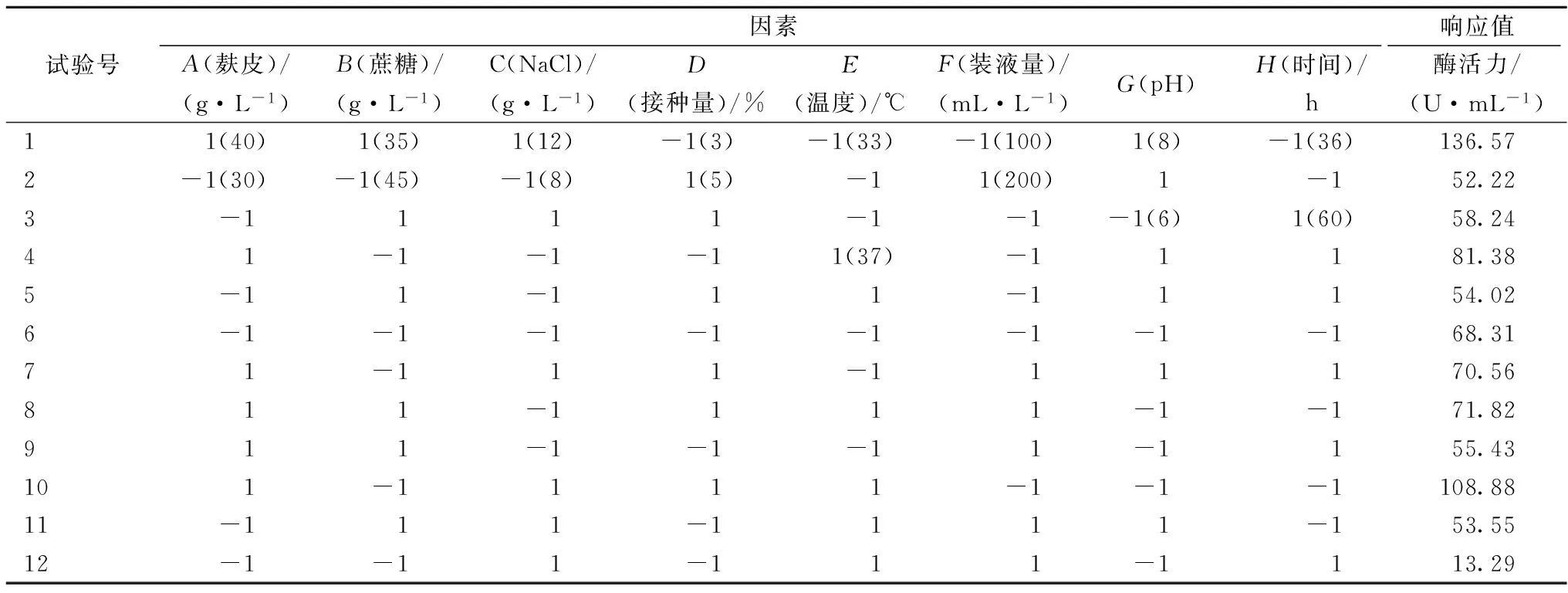
试验号因素响应值A(麸皮)/(g·L-1)B(蔗糖)/(g·L-1)C(NaCl)/(g·L-1)D(接种量)/%E(温度)/℃F(装液量)/(mL·L-1)G(pH)H(时间)/h酶活力/(U·mL-1)11(40)1(35)1(12)-1(3)-1(33)-1(100)1(8)-1(36)136.572-1(30)-1(45)-1(8)1(5)-11(200)1-152.223-1111-1-1-1(6)1(60)58.2441-1-1-11(37)-11181.385-11-111-11154.026-1-1-1-1-1-1-1-168.3171-111-111170.56811-1111-1-171.82911-1-1-11-1155.43101-1111-1-1-1108.8811-111-1111-153.5512-1-11-111-1113.29
利用Design-Expert对其结果进行方差分析(如表2所示),对枯草芽孢杆菌发酵液凝乳酶活力测定结果显示麸皮(P=0.000 2)、蔗糖(P=0.0403)、NaCl(P=0.0105)、发酵温度(P=0.010 2)、装液量(P=0.003)、pH(P=0.005 6)、发酵时间(P=0.000 6),它们在α=0.05的概率水平上差异显著,其他因子在此水平上不显著。其中麸皮、装液量、发酵时间、pH对其凝乳活力的影响都是极显著的,考虑到枯草芽孢杆菌是好氧菌,后期用发酵罐可以忽略装液量这一影响因素,pH的可变动性小,且发酵过程中会不断变化,最终选择麸皮浓度、发酵温度、发酵时间3个因素进行响应面设计。

表2 PB试验设计回归模型及其显著性检验
注: *该因子效应显著(P<0.05); **该因子效应极显著(P<0.01)。
2.3 响应面试验设计及结果分析
根据PB试验结果和Box-Behnken的试验设计原理,做3因素3水平的响应面分析,试验设计及结果如表3所示。利用Design-Expert软件对表3中的数据进行回归分析,得二次多项式方程:Y=211.60+34.98A+12.22B-11.47C-26.61BC-41.03A2-43.22B2-35.90C2。从上述结果来看,本试验所选用的模型对凝乳酶活力具有高度的显著性(P<0.000 1),失拟项反映的是实验数据与模型不相符的情况,P=0.769 8>0.1,失拟不显著,因此模型选择正确。其预测值(R2=0.956 4)和试验值(R2=0.976 9)之间有高度的相关性。麸皮与时间和温度之间的交互作用不显著,时间与温度的交互作用显著(P<0.000 1)。
对于模型方程,采用Design-Expert软件进行分析,得出曲面的极值点,对应的发酵条件为麸皮42.22 g/ L、发酵时间41.0 h、发酵温度33.12 ℃,此时发酵液酶活力达到222.30 U/mL,为了检测响应面的可靠,采用上述的条件进行了3次重复的验证实验,得出酶活力为222.34 ± 4.99 U/mL,与预测值都十分相近,说明模型方程与实际情况拟合较好。
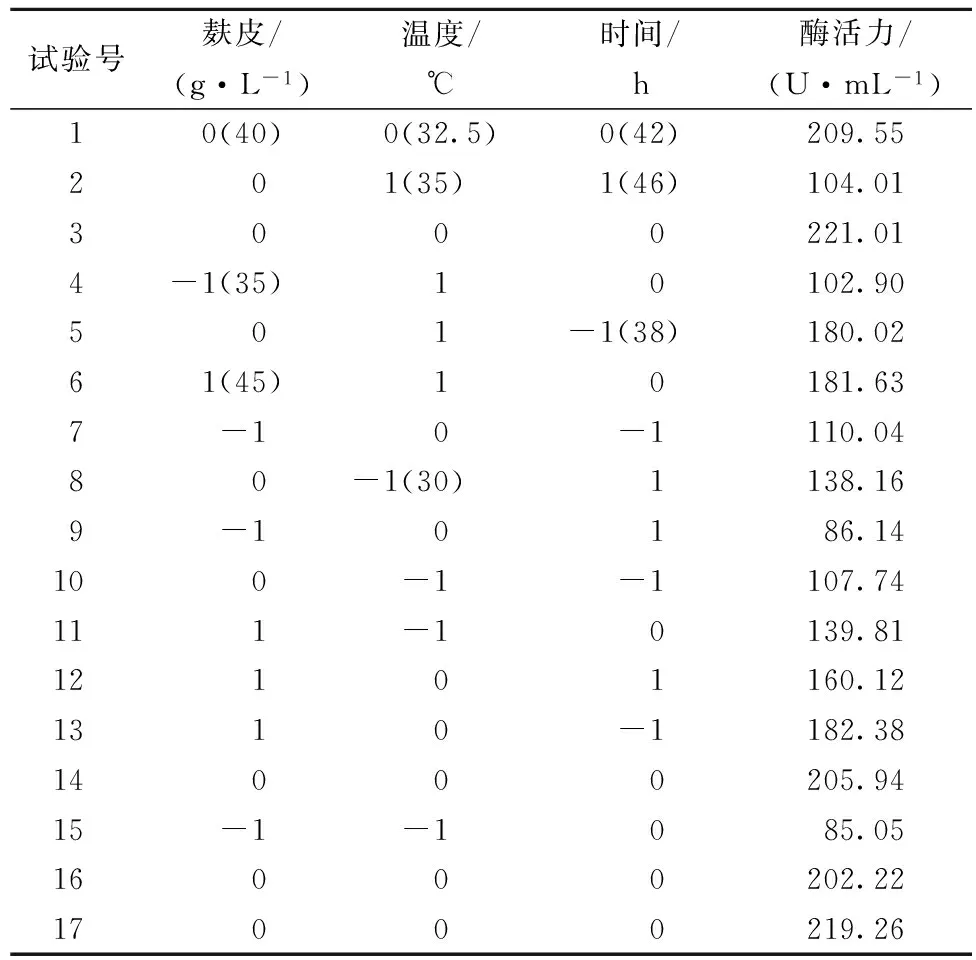
表3 Box-Behnken设计方案及凝乳酶活力值

表4 Box-Behnken显著性检验
注: *该因子效应显著(P<0.05); **该因子效应极显著(P<0.01)。
2.4 乙醇分级沉淀
采用乙醇分级沉淀对酶蛋白进行初步纯化,发酵液离心后取上清液,分为7组,每组进行平行试验,在冰浴条件下缓慢加入预先冷却的乙醇,使其体积分数分别达到20%、30%、40%、50%、60%、70%、80%,静置一段时间,离心弃上清,沉淀溶于磷酸钠缓冲液中,分别测酶活,计算凝乳酶活力,取平均值。
由图7可知,凝乳酶的回收率随着乙醇体积分数的增加呈现先增加后平稳的趋势,乙醇体积分数达到70%时,凝乳酶活力达到最大值,为134.82 U/mL。体积分数50%之前沉淀中基本无凝乳酶活力。因此,采用乙醇分级沉淀对酶蛋白进行初步纯化。先用50%体积分数的乙醇沉淀除去杂蛋白,再加预冷的乙醇使其体积分数达到70%,离心收集沉淀,溶于磷酸钠缓冲液中,即得到粗酶液。
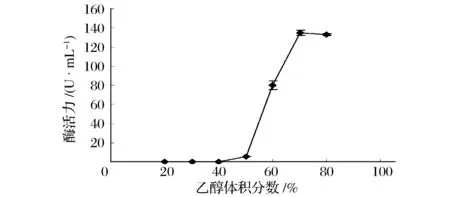
图7 乙醇体积分数对凝乳酶活力的影响Fig.7 Effect of ethanol content on MCE activity
2.5 DEAE-纤维素离子交换柱层析
乙醇分级沉淀后得到的粗酶液经DEAE-纤维素离子交换柱层析后共出现4个洗脱峰,如图8所示,分别收集合并洗脱峰,测酶活,可知峰2为酶活力峰(即用含有0.1 mol/L NaCl的磷酸钠缓冲液洗脱的峰)。

图8 DEAE-纤维素分离凝乳酶Fig.8 Purification of MCE by DEAE-celluose column
2.6 Sephadex G-100分子筛层析
收集DEAE-纤维素离子交换柱的活力峰,超滤浓缩后经Sephadex G-100分子筛层析柱后,洗脱液呈现出2个洗脱峰,如图9所示。其中35~45管表现出凝乳酶活力,收集后超滤浓缩,即得到纯酶。

图9 Sephadex G-100分离凝乳酶Fig.9 Purification of MCE by Sephadex G-100 column
2.7 SDS-PAGE 电泳分析
粗酶液经过2次柱层析纯化,得到较纯的枯草芽孢杆菌凝乳酶,对分离过程中的不同产物进行SDS-PAFE电泳分析,结果见图10。最后一步得到清晰条带,根据电泳的分子质量标准曲线计算,该酶样品的分子质量约42 kDa。与小牛凝乳酶和牛的胃蛋白酶的分子质量(分别是35.65 kDa 和34.00 kDa)不同。
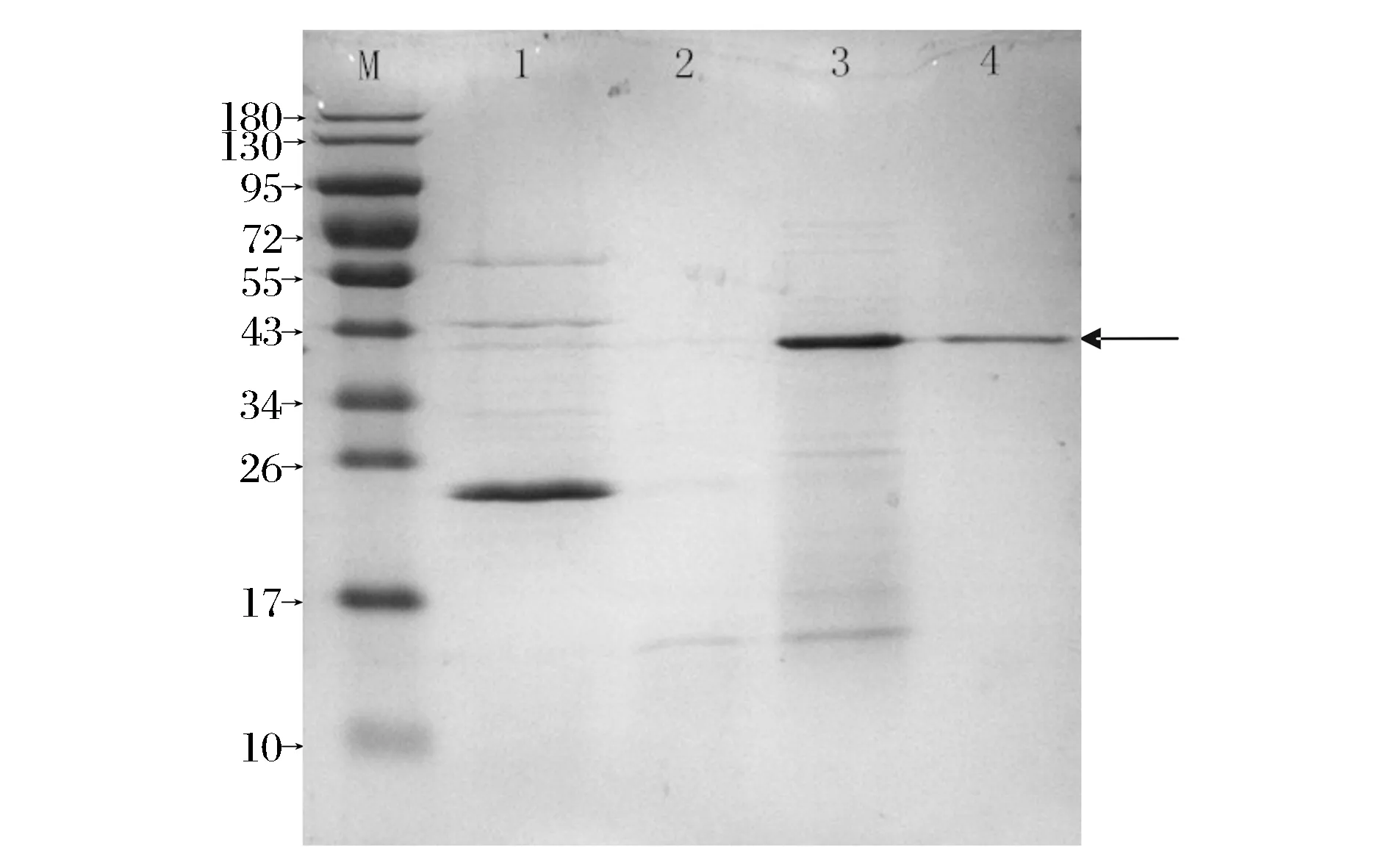
M-蛋白分子质量标准;1-发酵液;2-乙醇分级沉淀后的粗酶液; 3-经DEAE-纤维素层析后的活力峰样品;4-经SephadexG-100层析后的纯酶图10 SDS-PAGE电泳图Fig.10 SDS-PAGE
2.8 凝乳酶纯化结果
分别测定分离过程不同产物的凝乳酶活力、蛋白水解活力与蛋白浓度,计算出总活力、比活力、C/P、回收率、纯化倍数,结果如表5所示。粗酶液经过2次层析后,酶的比活力明显提高。由最初的95.76 U/mg到纯化后的794.30 U/mg,提高了8倍,C/P基本不变,较高于小牛凝乳酶C/P,纯化倍数为8.29。分子筛层析的收回率较低,仅为4.25%。
3 讨论
本试验对培养基的成分及发酵的条件进行了优化,应用PB试验设计对诸多影响凝乳酶活力的因素进行评价,筛选出重要的影响因子,快速有效。在PB试验设计的基础上,通过Box-Behnken设计原理进行响应面优化试验对主要影响因子进行优化与评价,获得影响枯草芽孢杆菌PNG27产凝乳酶的拟合数学模型,其最优的培养基配方和发酵条件为:麸皮42.22 g/L、蔗糖40 g/L、NaCl 10 g/L、初始pH7、接种量4 %、发酵时间41.0 h、发酵温度33.12 ℃、装液量100 mL,在此培养基和发酵条件的基础上,发酵液的酶活力与基础麸皮培养基相比提高了5倍,最终酶活力为222.34±4.99 U/mL。不同菌株对营养物质的利用情况不同,国内外学者对产凝乳酶菌株的培养基成分进行优化的研究中,利用葡萄糖、酪蛋白等简单底物和麸皮、燕麦粉、大豆粉等复杂底物时,产酶量有所不同,复合底物常可诱导酶的大量分泌[18],最适的培养基配方以及发酵条件因菌种不同而异。近几年,芽孢杆菌产凝乳酶的相关研究较多,张卫兵[19]等人以麸皮汁浓度16%,葡糖糖浓度7%等的最优组合获得134.72 U/mL的最高酶活,腾军伟[9]利用麦芽糖即得到较高的酶活力。

表5 凝乳酶纯化结果
通过乙醇分级沉淀、DEAE-纤维素离子交换层析、Sephadex G-100分子筛层析3步分离得到了电泳纯的凝乳酶,比活力由95.76 U/mg提高到794.30 U/mg,提高了8倍,酶的纯化倍数为8.29倍,最终回收率为4.25%。目前,国内外研究中粗分蛋白最常用的是硫酸铵盐析,但由于硫酸铵沉淀需要脱盐,酶液被稀释,增加了后序的浓缩过程的工作量,易造成酶的损失,故选用无水乙醇进行粗分。最终得到分子质量为42 kDa的纯酶,与李洋[12]等人纯化的枯草芽胞杆菌凝乳酶分子量接近,由于降解程度、修饰水平和肽链大小不同,不同微生物来源的凝乳酶分子质量不尽相同。根霉凝乳酶[20]的分子质量为35 kDa,微小毛霉[21]凝乳酶46 kDa。
本试验通过对培养基成分及发酵条件的优化,将酶活力提高了8倍,并通过3步分离得到电泳纯的凝乳酶,为后续研究其酶学性质及在牦牛乳工业中的应用奠定了基础。
[1] 杨贞耐,张健.干酪质量安全问题与控制技术[J]. 食品科学技术学报, 2015, 33(6): 11-17.
[2] 高岩,王景会,李玉秋,等.枯草芽孢杆菌凝乳酶的酶学性质[J]. 吉林农业大学学报, 2012, 34(4): 385-390.
[3] 普燕,张富春.干酪用牛凝乳酶替代品的研究进展[J].食品与发酵工业, 2015, 41(5): 227-234.
[4] 孙宝国,曹雁平,李健,等.食品科学研究前沿动态[J].食品科学技术学报, 2014, 32(2): 1-11.
[5] DING Z Y, WANG W F, WANG B D, et al. Production and characterization of milk-clotting enzyme fromBacillusamyloliquefaciensJNU002 by submerged fermentation[J]. Eur Food Res Technol , 2012, 234: 415-421.
[6] 李学朋,梁琪,师希雄,等.产凝乳酶微生物的研究概况[J]. 中国酿造, 2014, 33(4): 13-18.
[7] WANG Y, CHENG Q, AHMED Z, et al. PuriWcation and partial characterization of milk-clotting enzyme extracted from glutinous rice wine mash liquor[J]. Korean J Chem Eng,2009, 26: 1 313-1 318.
[8] PIERO ARL, PUGLISI I, PETRONR G. Characterization of the puri Wed actinidin as a plant coagulant of bovine milk[J]. Eur Food Res Technol, 2011, 233: 517-524.
[9] 腾军伟, 杨贞耐. 解淀粉芽孢杆菌GSBa-1 产凝乳酶培养基组成的优化[J]. 食品科学技术学报, 2016, 34(4): 13-20.
[10] ARIMA K, SHINITER I, GAKUZO T. Milk-clotting enzymes from microorganism. part I: Screening test and identification of potent fungus [J]. Agricultural and Biological Chemistry, 1967, 31(5): 540-545.
[11] DUTT K, MEGHWANSHI GK, GUPTA P, et al. Role of casein on induction and enhancement of production of a bacterial milk clotting protease from an indigenously isolated Bacillus subtilis[J]. Lett Appl Microbiol, 2008, 46: 513-518.
[12] YANG L, SHU L, DEJUAN Z, et al. Purification and characterization ofBacillussubtilismilk-clotting enzyme from Tibet Plateau and its potential use in yak dairy industry[J]. Eur Food Res Technol , 2012, 234: 733-741.
[13] 周俊清. 凝乳酶优良菌株的选诱及酶活特性的研究[D]. 长沙:湖南农业大学, 2005.
[14] HE X L, REN F Z, GUO H Y, et al. Purification and properties of a milk-clotting enzyme produced byBacillusamyloliquefaciensD4[J]. Korean J Chem Eng, 2011, 28(1): 203-208.
[15] 宋曦,甘伯中,贺晓玲,等.天祝放牧牦牛生活环境土壤中一株产凝乳酶细菌的分离与鉴定[J]. 食品科学, 2009, 30(11): 158-162.
[16] BRADFORD M. A rapid and sensitive method for the quantitation of protein using the principle of ptotein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[17] ELBENDARY M A,MOHARAM M E, ALI T H. Purification and characterization of milk clotting enzyme produced byBacillussphaericus[J]. Appl Sci Res, 2007, 3(8): 695-699.
[18] 孙倩,王喜平, 闫巧娟.微孢根霉产凝乳酶的发酵条件优化[J]. 中国农业大学学报, 2014, 19(4): 137-143.
[19] 张卫兵,宋曦, 贺晓玲.Bacilluslicheniformis产凝乳酶培养基的优化[J]. 中国酿造, 2011, 2: 70-73.
[20] 潘道东,韩玲玲. 根霉凝乳酶的分离纯化及其酶学特性研究[J]. 中国食品学报, 2011, 11(2): 53-59.
[21] 李玉秋,王景会,李铁柱,等.重组微小毛霉凝乳酶的分离与纯化[J]. 中国酿造, 2010(10): 19-22.
Fermentation optimization and purification of a milk-clotting enzyme produced byBacillussubtilisPNG27
CHEN Rui, BIE Xiao-mei, LYU Feng-xia, ZHAO Hai-zhen,ZHANG Chong, LU Zhao-xin*
(Nanjing Agricultural University,Nanjing 210095,China)
The medium components and fermentation condition were optimized with single factor test, Plackett-Burman experimental designs and Box-Behnken response surface methodology. Under optimized conditions, the highest enzyme activity reached (222.34 ± 4.99) U/mL.The purified milk-clotting enzyme (MCE) produced byBacillussubtilisPNG27 was obtained by fractional precipitation with ethanol, followed by the chromatography of the most active fraction on DEAE-celluose column and finally on Sephadex G-100. The results showed that the specific activity of the enzyme was 794.30 U/mg, purification fold was 8.29 times, and the final recovery rate was 4.25%. SDS-PAGE of the purified MCE gave a molecular weight of 42 kDa.
Bacillussubtilis; milk-clotting enzyme; fermentation optimization; purification
10.13995/j.cnki.11-1802/ts.201701019
硕士研究生(陆兆新教授为通讯作者,E-mail:fmb@njau.edu.cn)。
2016-07-18,改回日期:2016-08-29
