家蚕过敏原Profilin的表达、纯化、免疫学鉴定及其生物信息学分析①
2017-02-15梁志林王良录钟慧玲刘志刚
胡 维 梁志林 王良录 钟慧玲 刘志刚
(深圳大学过敏反应与免疫学研究所,深圳518060)
家蚕过敏原Profilin的表达、纯化、免疫学鉴定及其生物信息学分析①
胡 维 梁志林 王良录②钟慧玲 刘志刚
(深圳大学过敏反应与免疫学研究所,深圳518060)
目的:克隆表达家蚕(Bombyx mori) Profilin蛋白,鉴定其免疫原性并进行B细胞抗原表位预测和构建分子进化树。方法:从NCBI上获取家蚕Profilin蛋白的基因序列,合成该基因并构建到pet-28a表达载体上,重组质粒转化至E.coli BL21,IPTG诱导基因表达,通过亲和层析获取高纯度蛋白;用Western blot方法对重组蛋白进行过敏原性鉴定;通过DNAStar软件分析其潜在的B细胞抗原表位;应用MEGA5.05进行序列比对,并构建分子进化树。结果:成功表达出重组蛋白,且重组蛋白与家蚕过敏患者血清有一定的IgE结合。结论:成功克隆表达出具有免疫原性的Profilin蛋白,并成功预测出其B细胞抗原表位和构建出分子进化树。
家蚕;Profilin蛋白;过敏原
变态反应疾病已成为当今全球关注的重要公共卫生问题[1]。各国变态反应性疾病的总发病率为10%~30%[2]。过敏性哮喘是一种很重要的变态反应疾病[3,4]。2010 年9 月,张寅平等[5]在中国10 个重要城市启动了中国室内环境与儿童健康研究(CCHH)。CCHH调查发现中国城市中确诊哮喘患病率为1.7%~9.8%(平均为6.8%),相比于1990 年的0.91%有了大幅度增加。养蚕在中国已有5 000年历史,家蚕的广泛养殖以及随之而来的蚕丝用品的大量使用家蚕过敏的报道时有发生[6,7]。2014年,印度Nagaraj通过比较研究120名缫丝厂与非缫丝厂工人哮喘发生情况,发现缫丝厂工人哮喘发生率为29.16%而非缫丝厂工人哮喘发生率仅6.6%。用蚕丝、蚕茧或蚕蛹提取液进行皮肤点刺实验(SPTs)发现,缫丝厂工人的阳性率为35.83%,远远高于非缫丝厂工人的20.83%。该研究在一定程度上说明缫丝厂工人哮喘的发生与过敏原长期的接触密切相关[8]。2001年,哈佛大学研究人员在中国安庆农村对871名儿童做了调查研究,也发现对蚕丝过敏的儿童更容易引发哮喘[9]。然而国内外关于家蚕过敏原蛋白的具体研究以及报道几乎没有。本课题组通过功能蛋白组学的方法分析鉴定出Profilin蛋白为其潜在过敏原(另文报道)。本文主要克隆表达了家蚕Profilin蛋白,通过免疫学鉴定其过敏原性并通过生物信息学方法分析其潜在抗原表位,这对于家蚕过敏性疾病的研究提供了进一步的科学依据。
1 材料与方法
1.1 材料
1.1.1 质粒载体、表达菌 质粒载体Pet-28a购自生工生物工程(上海)股份有限公司(Sangon),大肠埃希菌BL21(DE3)由深圳大学过敏与免疫研究所提供。
1.1.2 主要实验材料 家蚕过敏患者血清取自中国协和医科大学变态反应科,分装后-80℃保存。限制性内切酶BamHⅠ和XhoⅠ购自生工生物工程(上海)股份有限公司。生物素标记的小鼠抗人IgE抗体及HRP标记的链霉素亲和均购自美国Southern Biotech公司。
1.2 方法
1.2.1 基因合成和克隆载体的构建 从NCBI网站上获得家蚕Profilin蛋白的基因序列,合成该基因并连接至克隆载体pMD18-T。然后将pMD18-T-Profilin阳性质粒与原核表达载体pET-28a分别用限制性内切酶BamHⅠ和XhoⅠ进行双酶切,使Profilin基因片段与pET-28a的酶切产物连接而构建出重组表达质粒pET-28a-Profilin。最后将重组质粒转化入感受态E.coli BL21,碱裂解法提取质粒后用BamHⅠ和XhoⅠ进行双酶切,测序鉴定后用于诱导表达。
1.2.2 家蚕Profilin蛋白的表达纯化 取成功转化了重组表达质粒pET-28-Profilin的感受态大肠埃希菌BL21接种于50 ml含卡那的LB液体培养基中,37 ℃摇菌过夜,待细胞生长至对数期,将50 ml菌液加至1 L新鲜的LB培养液中200 r/min摇菌至OD600为0.6左右,按体积1∶1 000加入终浓度为1 mol/L异丙基-β-D-硫代半乳糖苷(IPTG),150 r/min,低温25 ℃摇菌20 h,再将表达出来的1 L菌液离心,取沉淀。加入纯化用的平衡缓冲液重悬,低温超声破碎10 min, 10 000 r/min离心10 min取上清,用0.45 μm膜过滤。将上清液以2 ml/min的流速上样于以平衡好的镍-氨三乙酸亲和层析柱。然后再用平衡液充分洗柱,再用300 mmol/L含尿素的咪唑平衡缓冲液洗脱目的蛋白并用离心管收集并做好标记。最后SDS-PAGE检测。
1.2.3 家蚕Profilin蛋白免疫原性分析 将上述纯化获得Profilin的进行SDS-PAGE电泳,经半干转转膜后用5%的脱脂奶粉封闭2 h,以家蚕过敏的患者血清为一抗(1∶5稀释)孵育2 h,TBST洗涤3次,用HRP标记鼠抗人IgE二抗(1∶2 000稀释)孵育2 h,TBST洗涤3次,用ECL显示液进行显色,在凝胶成像系统中观察、拍照。
1.2.4 家蚕Profilin蛋白的生物信息学分析 应用Blastp和 MEGA5.05进行序列比对,并构建分子进化树。应用DNAStar软件的Protean模块进行B细胞抗原表位预测。
2 结果
2.1 表达载体pET-28a-Profilin的构建和酶切鉴定 从NCBI上获取Profilin的基因序列(登录号NM_001043643),合成该基因,再将Profilin基因连接到pET-28a表达载体后,用XhoⅠ和BamHⅠ进行双酶切鉴定,核酸电泳结果显示与Profilin的cDNA长度(381 bp)基本一致(图1),证明表达重组质粒pET-28a-Profilin构建成功。
2.2 家蚕Profilin蛋白的表达和纯化 将pET-28a-Profilin重组蛋白表达菌加入1 L新鲜LB液体培养基扩培后,用浓度为1 mol/L的IPTG在25 ℃诱导表达20 h后,采用Ni离子柱亲和层析方法初步纯化Profilin重组蛋白,经SDS-PAGE电泳。结果显示:分子质量约为14 Ku处有外源蛋白条带出现(图2),该条带与Profilin的理论分子质量基本相符。
2.3 家蚕Profilin蛋白免疫原性分析 成功将目的蛋白从SDS-PAGE胶上转印到PVDF膜后,用22个家蚕过敏患者的血清混合成的血清作为一抗和HRP标记的鼠抗人IgE二抗进行孵育,ECL显色曝光,结果显示:Profilin重组蛋白能与患者血清IgE发生特异性结合(图3),表明Profilin,具有良好的抗原性。
2.4 家蚕Profilin蛋白的生物信息学分析
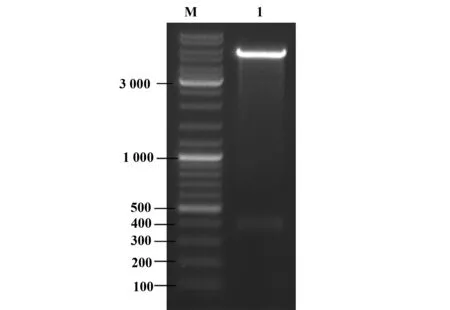
图1 表达载体pET28a-Profilin酶切鉴定Fig.1 Identification of pET28a-Profilin plasmid digested with restriction enzymeNote: M.DNA marker;1.Digestion of pET28a-Profilin plasmid.
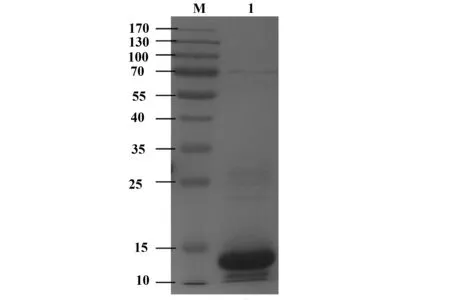
图2 重组蛋白Profilin表达纯化的SDS-PAGE分析Fig.2 Expression and purification of recombinant protein Profilin in silkworm Note: M.Marker;1.Purified protein.
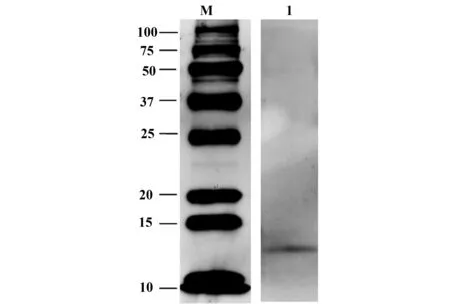
图3 家蚕Profilin蛋白Western blot结果图Fig.3 Western blot analysis of recombinant protein Profilin in silkworm Note: M.Marker;1.Profilin protein.

图4 Profilin蛋白B细胞抗原表位预测Fig.4 B cell epitope analysis of protein Profilin in silkworm
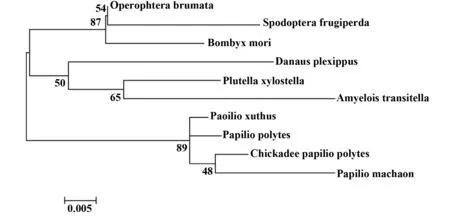
图5 家蚕Profilin蛋白系统进化树Fig.5 Neighbour joining clustering analysis of Profilin of silkworm
2.4.1 B细胞抗原表位预测 在蛋白二级结构中,α螺旋、β折叠结构规则不易形变,较难嵌合抗体,一般不作为抗原表位,而转角结构比较松散,利于抗体结合,符合作为抗原表位。蛋白质的柔韧性大的区域较易发生扭曲,有利于与抗体的嵌合,为抗原表位可能区域。蛋白质的亲水性区域一般暴露于蛋白的表面,有利于抗体的结合,因此,这些区段成为抗原表位的可能性。综合用Chou-Fasman方法预测的二级结构、Karplus-schulz方法预测Profilin蛋白的柔韧性、Kyte-Doolittle方法预测的亲水性和用James-on-Wolf法预测的抗原指数,结果显示氨基酸序列28~43位为潜在的抗原表位(图4)。
2.4.2 序列比对及分子进化树分析 将推导出的家蚕Profilin序列进行Blastp比对分析,筛选出冬尺蠖(Operophtera brumata)、草地夜蛾(Spodoptera frugiperda )、黑脉金斑蝶(Danaus plexippus)、小菜蛾(Plutella xylostella)、Amyelois transitella、柑橘凤蝶(Papilio xuthus)、玉带凤蝶(Papilio polytes)、山雀玉带凤蝶(chickadee Papilio polytes)、金凤蝶(Papilio machaon)等同源序列后以Fsata格式输出,然后用MEGA5.05软件构建分子进化树,结果显示家蚕Profilin基因与冬尺蠖、草地夜蛾的Profilin基因同源性较近(图5)。
3 讨论
家蚕又称“桑蚕”。昆虫纲,鳞翅目,家蚕蛾科。幼虫灰白色,吃桑叶,蜕皮4次,吐丝做茧,变成蛹,蛹变成蚕蛾。幼虫吐的丝是重要的纺织原料[10]。养蚕在中国历史悠久,随着养蚕业的发展及蚕丝制品的广泛使用,由家蚕引发的过敏病例时有发生[11,12]。印度Harindranath[13]曾随机抽样调查两缫丝厂的243 名工人,发现哮喘的发生率为36.2% ,而确诊为职业性哮喘者16.9%,居各种职业性哮喘的发生率之首。这一发生率与中国一调查报告的职业性哮喘率15.6%相符。在日常生活中主要是由于与丝棉制品接触而引起呼吸道变态反应,临床表现以哮喘以主,大多数伴鼻过敏症状,少数病例伴结膜炎[14]。
中国协和医科大学对于家蚕过敏原的研究较早,1994王旭东等人通过对3个蚕种场养蚕工人的调查研究表明,养蚕工人特异性IgE水平与职业性哮喘发生呈正相关。研究人员收集、制备蚕丝、蚕尿、娥尿和娥毛4种变应原,用ELISA法测定养蚕工人血清特异性IgE,发现蚕尿特异性IgE的阳性率明显高于其他的3种变应原[15]。2006年深圳大学的研究人员对家蚕过敏原tropomyosin基因进行克隆表达,并通过Western blot方法成功鉴定了其免疫原性。本实验从NCBI数据库上获取家蚕Profilin基因序列,通过化学合成该基因,将其目的基因连接到pET28载体构建其表达载体,最后成功将其转化到大肠杆菌。通过小量表达摸索出Profilin的表达条件,按小量表达条件大量表达该蛋白,最后通过镍亲和层析成功获得高纯度的Profilin蛋白。用22份家蚕过敏原混合血清与重组蛋白Profilin孵育进行Western blot实验,结果表明:重组的Profilin蛋白能和家蚕过敏患者血清中的IgE结合,说明重组的过敏原具有免疫原性。本实验进一步通过生物信息学的方法预测其B细胞潜在抗原表位,为家蚕过敏反应性疾病的特异性诊断和疫苗免疫治疗奠定了一定的理论基础。
致谢:衷心感谢中国协和医科大学变态反应科提供家蚕患者阳性血清,为本实验的顺利进行提供了条件。
[1] WHO Workshop,1996.Asthma management and prevention:the Global Initiative for Asthma Ascretariate.1-2.
[2] Ruffilli A,Bonini S.Susceptibility genes for allergy and asthma[J].Allergy,1997,52(3):256-273.
[3] Sears MR.Predicting asthma outcomes[J].J Allergy Clim Immunol,2015,136(4):829-836.
[4] Subbarao P,Mandhane PJ,Sears MR.Asthma:epidemiology,etiology and risk factors[J].CMAJ,2009,181:E181-190.
[5] 张寅平,李百战,黄 晨,等.中国10城市儿童哮喘及其他过敏性疾病现状调查[J].科学通报,2013,25:2504-2523.
[6] Borelli S,Stern A,Wuthrich B. A silk cardigan inducing asthma[J].Allergy,1999,54(8):900-901.
[7] Dewair M,Baur X,Ziegler K. Use of immunoblot technique fordetection of human IgE and IgG antibodies to individual silk proteins[J]. J Allergy Clin Immunol,1985,76(4):537-542.
[8] Gowda G.A study on occupational asthma among workers of silk filatures in South India[J].Indian J Occup Environ Med,2014,18(2):64-67.
[9] Celedón JC,Palmer LJ,Xu X,etal.Sensitization to silk and childhood asthma in rural China[J]. Pediatrics,2001,107(5):e80.
[10] Xu H.Advanced technologies for genetically manipulating the silkworm Bombyxmori,a model Lepidopteran insect[J].Proc Biol Sci,2015,282(1810):20150487.
[11] Zaoming W,Codina R,Fernandez-Caldas E,etal.Partial characterization of the silk allergens in mulberry silk extract[J].J Investig Allergol Clin Immunol,1996,6(4):237-241.
[12] Wen ZM,Zhou LX,Sun CC,etal. Diagnosis of child allergic rhinit is caused by silk[J].Chin J Otorhinolaryngol Head Neck Sur,1989,4(3):9-10.
[13] Harindranath N,Prakash O,Subba Rao PV.Prevalence of occupational asthma in silk filatures[J].Ann Allergy,1985 ,55(3):511-515.
[14] Vovolis V,GalatasI.Silk-induced asthma[J].Allergy Asthma Proc,1999,20(2):107-108.
[15] 刘志刚,邬玉兰,杨 睿,等.家蚕变应原tropomyosin基因的克隆表达、纯化及其免疫学活性鉴定[J].免疫学杂志,2009,25(6):655-658.
[收稿2016-02-27 修回2016-04-18]
(编辑 张晓舟)
Expression,purification and bioimformatics analysis of allergen protein Profilin from silkworm (Bombyx mori)
HUWei,LIANGZhi-Lin,WANGLiang-Lu,ZHONGHui-Ling,LIUZhi-Gang.
InstitueofAllgeryandImmunology,SchoolofMedicineofShenzhenUniversity,Shenzhen518060,China
Objective:To obtain recombinant Profilin of silkworm,identify its immunogenicity,predict its B cell epitopes and construct the evolutionary trees.Methods: The nucleotide sequence of Profilin was acquired from NCBI,synthesized it and cloned it into pET-28 vector.Then,the recombinant plasimids were transformed to E.coli BL21.After induced by IPTG,recombinant protein was purified by Affinity chromatography.Furtherly,its allergenicity was identified by Western blot,the potential B cell epitopes was analyzed through DNAStar and build the evolutionary trees by MEGA5.05.Results: The recombinant protein of Profilin was successfully expressed and purified by affinity chromatography.Besides,the protein contains a high IgE-binding activity with IgE existing in serum of patients allergic to silkworm.Conclusion: The recombinant proflilin has IgE-binding activity,and it is meaningful for fundamental research and specific diagnosis studies of allergic diseases caused by silkworm.
Silkworm;Profilin protein;Allergen
10.3969/j.issn.1000-484X.2017.01.016
①本文为国家卫生部公益性行业科研专项(No.2015SQ00136)、广东省工程技术研究开发中心项目(No. 2013158925)、广东省对外科技合作项目(No.2013B051000088)和深圳市科技计划基础研究项目(No.JCYJ20140828163633991、JCYJ20140418095735604)。
胡 维(1991年-),男,硕士,主要从事过敏原分子生物学研究。
及指导教师:刘志刚(1959年-),男,教授,博士生导师,主要从事过敏与免疫学研究,E-mail:lzg@szu.edu.cn。
R392.8
A
1000-484X(2017)01-0081-04
②北京协和医院变态反应科,北京100730。
