CEA迷你基因串联体疫苗的体内抗肿瘤活性观察①
2017-02-15方艳秋魏海峰米旭光李首庆
方艳秋 魏海峰 李 丹 米旭光 刘 磊 李首庆 谭 岩
(吉林省人民医院医学诊治实验中心,长春130021)
·生物治疗·
CEA迷你基因串联体疫苗的体内抗肿瘤活性观察①
方艳秋 魏海峰 李 丹②米旭光 刘 磊 李首庆 谭 岩
(吉林省人民医院医学诊治实验中心,长春130021)
目的:观察已构建的含有CEA625-667基因单倍体疫苗pcDNA-CEA625-667及三串联体的DNA疫苗pcDNA-triCEA625-667对荷瘤小鼠体内肿瘤的抑制情况及小鼠存活时间的改变。方法:建立小鼠肝细胞癌实验动物模型,应用单倍体疫苗pcDNA-CEA625-667及三串联体DNA疫苗pcDNA-triCEA625-667免疫小鼠,以生理盐水为对照组,观察各实验组小鼠皮下肿瘤生长情况,记录皮下肿瘤生长曲线,观察疫苗对荷瘤小鼠肿瘤生长速度的影响以及疫苗对荷瘤小鼠生存时间的影响。结果:与生理盐水对照组相比,两种疫苗均能明显抑制CEA阳性荷瘤小鼠的肿瘤体积以及生长速度(P<0.01),其中,pcDNA-triCEA625-667疫苗组的抑制作用明显优于pcDNA-CEA625-667疫苗组(P<0.01),而二者均不能抑制CEA阴性荷瘤小鼠的肿瘤生长。pcDNA-CEA625-667疫苗组平均生存时间为(48.50±6.73)d,与生理盐水对照组(39.00±6.64)d相比有显著差异(P<0.01);pcDNA-triCEA625-667疫苗组生存时间(48.50±6.73)d明显高于生理盐水对照组和pcDNA-CEA625-667疫苗组(P<0.01)。两组疫苗均不能延长CEA阴性荷瘤小鼠的生存时间。结论:无论是单倍体还是三串联体的DNA疫苗,均能够明显抑制CEA阳性荷瘤小鼠的肿瘤生长速度(P<0.01)及明显延长其生存时间(P<0.01),而对CEA阴性荷瘤小鼠则无治疗作用。
癌胚抗原;迷你基因;基因疫苗;体内实验;抗肿瘤
免疫基因治疗已成为恶性肿瘤治疗的新模式而日益受到人们的重视。癌胚抗原(Carcino-embryonic antigen,CEA)的存在是其阳性肿瘤治疗的靶向物质基础[1]。CEA作为肿瘤相关抗原具有一定的抗原性,可以作为诱导肿瘤免疫的有效靶抗原,被机体内特异性CTL识别,诱发抗肿瘤免疫应答[2],故被应用于其阳性肿瘤的主动免疫治疗。通过前面的工作,我们已构建了含有CEA625-667基因单倍体疫苗pcDNA-CEA625-667及三串联体的DNA疫苗pcDNA-triCEA625-667[3],并证实了该疫苗确能引起小鼠脾脏的T淋巴细胞增殖反应。本部分实验拟进一步观察单倍体疫苗和三串联疫苗对荷瘤小鼠(分别植入小鼠肝癌细胞H22-CEA+及H22-CEA-)体内肿瘤的抑制情况及小鼠存活时间的改变,探讨迷你基因串联体疫苗应用于CEA阳性肿瘤治疗的可能性,为进一步的临床研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂 CEA阳性小鼠肝癌细胞株(H22-CEA+)、CEA阴性小鼠肝癌细胞株(H22-CEA-)(本室制备并保存);重组真核表达质粒pcDNA-CEA625-667及pcDNA-triCEA625-667(本室制备并保存);IMDM培养基(美国Sigma公司);胎牛血清(Gibcobrl公司)。
1.1.2 实验动物 BALB/c小鼠购自吉林大学基础医学院动物室,雄性,6~8周,体重18~22 g,在实验室常规饲养1周后,随机分为实验组和对照组。
1.2 方法
1.2.1 小鼠肝细胞癌实验动物模型的建立 将30只BALB/c小鼠随机分成3组,每组10只。在小鼠的右前肋部分别皮下接种5×105、1×106、2×106个H22-CEA+肝癌细胞,观察不同浓度H22-CEA+肝癌细胞对小鼠生存时间的影响。
1.2.2 疫苗免疫小鼠后皮下移植瘤生长情况 应用单倍体疫苗pcDNA-CEA625-667及三串联体DNA疫苗pcDNA-triCEA625-667免疫小鼠,观察各实验组小鼠皮下肿瘤生长情况,记录皮下肿瘤生长曲线。实验分组方法:将实验小鼠随机分成3组,每组10只。第1组腹腔注射0.5 ml生理盐水;第2组胫前肌内接种50 μl pcDNA-CEA625-667质粒(1 mg/ml);第3组胫前肌内接种50 μl pcDNA-triCEA625-667质粒(1 mg/ml)。3周后,第1、2、3组小鼠每只皮下接种0.2 ml CEA阳性小鼠肝癌细胞H22-CEA+(约含2×105个细胞);第2、3组小鼠每只皮下接种0.2 ml CEA阴性小鼠肝癌细胞H22-CEA-(约含2×105个细胞)。每3 d用游标卡尺测量肿瘤的长径与短径,计算肿瘤体积。
1.2.3 疫苗对荷瘤小鼠肿瘤生长速度的影响 按照前述方案分组及免疫小鼠,接种CEA+及CEA-肝癌细胞,每周测量小鼠肿瘤直径,观察小鼠皮下肿瘤生长速度。
1.2.4 疫苗对荷瘤小鼠生存时间的影响 按照前述方案分组及免疫小鼠,接种CEA+及CEA-肝癌细胞,观察疫苗对荷瘤小鼠生存时间的影响。
1.3 统计学方法 应用SPSS19.0统计学软件进行统计学分析。数据经方差齐性检验,若方差齐则采用样本均数比较的方差检验(LSD-t检验),若方差不齐则采用非参数检验(秩和检验);采用 Kaplan-Meier 法计算生存率,P<0.05或P<0.01认为差异有统计学意义。
2 结果
2.1 小鼠肝细胞癌实验动物模型的建立及其皮下接种H22-CEA+细胞对小鼠生存时间的影响 图1结果表明,皮下接种1×106个肿瘤细胞组小鼠平均生存时间为(39.00±6.64)d,半数致死期为35 d,此接种数量最适合观察微囊化转基因细胞疫苗的治疗效果,又能区别因操作失误而引起的动物死亡。
2.2 疫苗对实验小鼠成瘤情况的影响 单倍体疫苗和三串联体疫苗接种均可以抑制CEA阳性肿瘤的生长,表现为肿瘤的生长速度缓慢、瘤块较小,与生理盐水对照组相比有显著差异(P<0.05),并且可以见到疫苗免疫组接种局部较早出现红肿、破溃等炎性细胞浸润、细胞免疫增强的现象,表明疫苗对CEA阳性肿瘤有明显的杀伤或抑制作用,见图2。
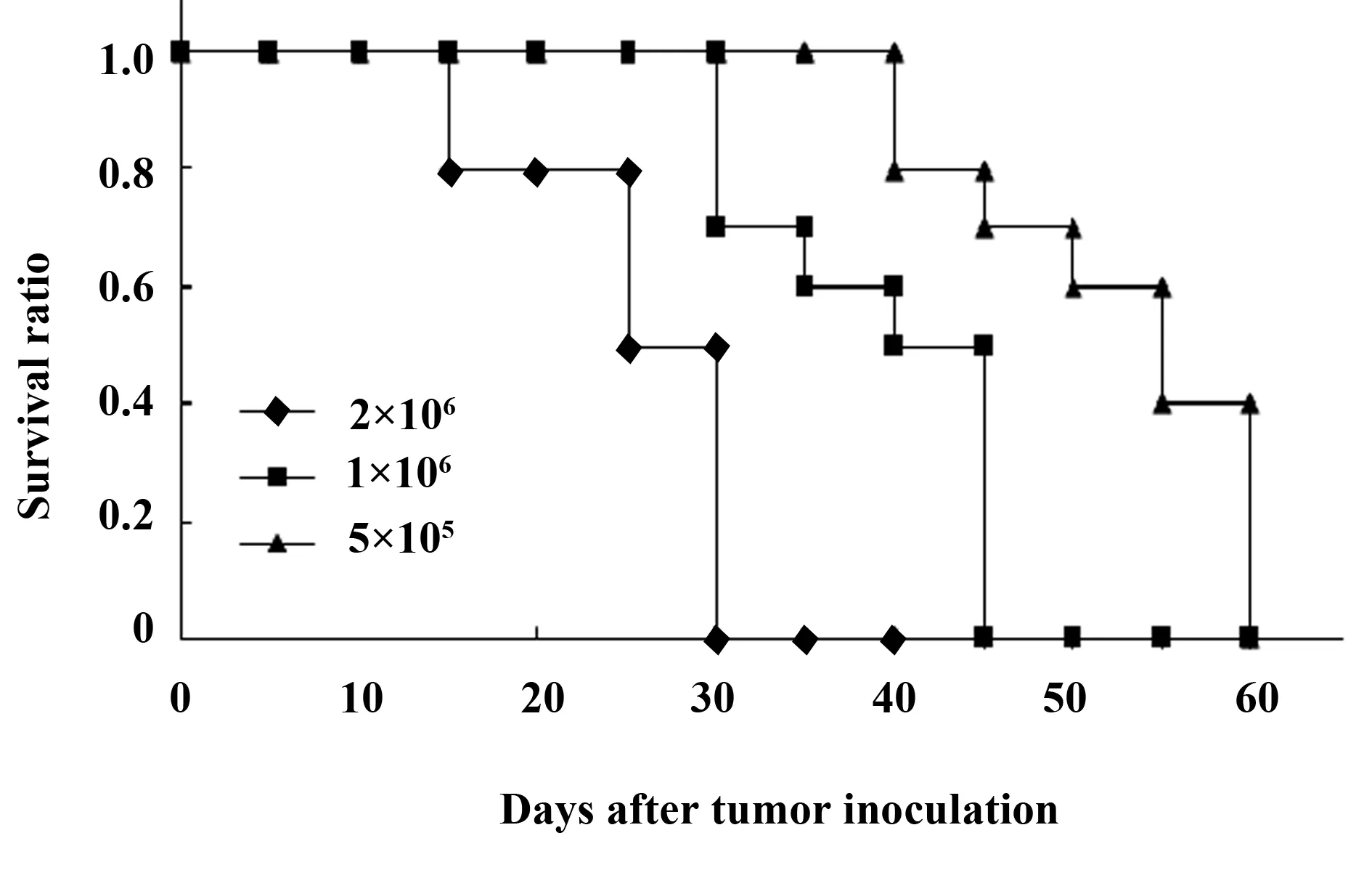
图1 皮下接种不同数量H22肝癌细胞后BALB/c小鼠的生存时间Fig.1 Survival time of BALB/c mice inoculated subcutaneously with H22 hepatocarcinoma cells

图2 疫苗免疫后各组小鼠皮下肿瘤生长曲线Fig.2 Grow curve of subcutaneously tumor of various groups immuned by vaccine
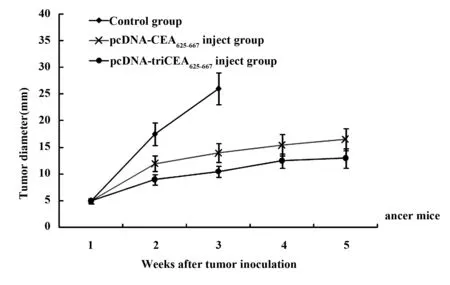
图3 疫苗对CEA+肿瘤荷瘤小鼠肿瘤生长速度的影响Fig.3 Effect of vaccine on growth velocity of CEA+ bearing cancer mice
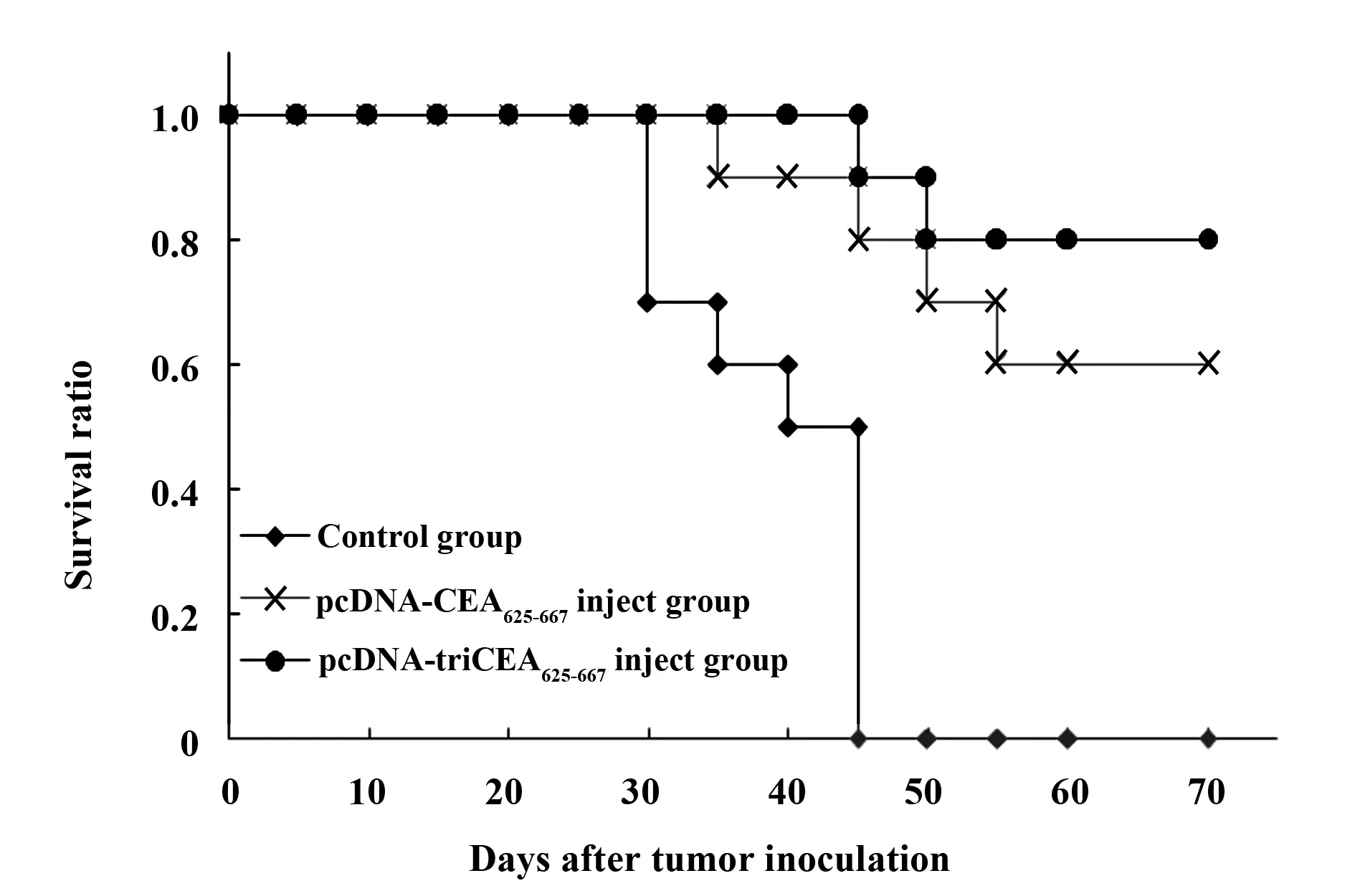
图4 疫苗对CEA+肿瘤荷瘤小鼠生存时间的影响Fig.4 Effect of vaccine on survival time of CEA+ bearing cancer mice
2.3 疫苗对CEA阳性荷瘤小鼠肿瘤生长速度的影响 图3所示均为每组10只小鼠全部存活时的测量值。结果表明,与生理盐水对照组相比,两种疫苗均能明显抑制CEA阳性荷瘤小鼠的肿瘤生长速度(P<0.01),其中,pcDNA-triCEA625-667疫苗组的抑制作用明显优于pcDNA-CEA625-667疫苗组(P<0.01),而二者均不能抑制CEA阴性荷瘤小鼠的肿瘤生长速度。
2.4 疫苗对CEA阳性荷瘤小鼠生存时间的影响 结果表明,两组疫苗均能延长CEA阳性荷瘤小鼠的生存时间。生理盐水对照组平均生存时间为(39.00±6.64)d,pcDNA-CEA625-667疫苗组平均生存时间为(48.50±6.73)d,与生理盐水对照组相比有显著差异(P<0.01);pcDNA-triCEA625-667疫苗组观察至70 d,小鼠均有半数以上存活,其生存率明显高于生理盐水对照组和pcDNA-CEA625-667疫苗组(P<0.01)。见图4。此外,结果还显示两组疫苗均不能延长CEA阴性荷瘤小鼠的生存时间。
3 讨论
CEA作为肿瘤相关抗原,可以被机体内特异性CTL细胞识别,导致肿瘤细胞被杀伤,而且CEA阳性肿瘤的瘤谱较广,制成疫苗后,能克服其他肿瘤疫苗仅对一种肿瘤起作用的局限性,具有良好的开发价值和临床应用前景。本研究应用同尾酶连接方法成功地构建了含有CEA625-667迷你基因三串联体的DNA疫苗pcDNA-triCEA625-667,这种以抗原表位为基础的基因免疫策略由于既纯化了抗原性又减少了无关干扰序列的影响,免疫的效果将更加专一和精确,更符合疫苗的分子设计和开发研究[4]。
Rodriguez等[5]在研究抗病毒的表位疫苗时发现,用独立的迷你基因免疫个体,再用病毒在4 d之后刺激机体,能产生在数量上与已知的有防御作用的疫苗在致敏病毒特异性T淋巴细胞方面相同的反应,但奇怪的是,这些有活力的CTL效应却不能在正常致死量的病毒攻击之下产生防御反应,尽管这些CTL表现出全职的功能,也具有高度的裂解活性,与靶细胞的亲和力和分泌CK方面也与病毒感染诱导的CTL一样,但是这些迷你基因只能导致低频率的CTL前体的出现;只有大约1/40 000个T细胞是表位特异的,这就提示了迷你基因质粒的缺陷主要在于不能在细胞表面提供充足拷贝的肽-MHC复合物。为提高迷你基因的免疫原性,人们做过很多有益的尝试,包括共表达泛素蛋白或一些免疫刺激分子[6-9];直接将DNA接种到DC中等[10]。本研究在综合考虑了疫苗制备的流程和成本等问题的前提下,拟将迷你基因连接成“串珠样”,这样的想法已经有人做过尝试[11,12],并取得了良好的效果。
本研究结果提示:与对照组相比,无论是单倍体还是三串联体的DNA疫苗,均能够明显抑制CEA阳性荷瘤小鼠的肿瘤生长速度(P<0.01)及明显延长其生存时间(P<0.01),而对CEA阴性荷瘤小鼠则无治疗作用。应用相同剂量的疫苗治疗CEA阳性荷瘤小鼠,无论是在抑制荷瘤小鼠肿瘤生长速度方面,还是在延长荷瘤小鼠生存时间方面,三串联体疫苗治疗组明显优于单倍体疫苗组。本实验的成功,为进一步研究在人体应用迷你基因DNA疫苗进行有效治疗CEA阳性肿瘤和预防手术后复发及转移奠定了基础。由于CEA阳性肿瘤的瘤谱广,发病率和恶性程度高,因此,CEA迷你基因串联体疫苗pcDNA-triCEA625-667将具有良好的开发和应用前景。
[1] Shirasu N,Yamada H,Shibaguchi H,etal.Potent and specific antitumor effect of CEA-targeted photoimmunotherapy[J].Int J Cancer,2014,135(11):2697-2710.
[2] 王小利,马 博,贾 军,等.rAAV/CEA转染树突状细胞诱导特异性CTL杀伤MCF-7细胞系CD44(+)CD24(-/low)乳腺癌干细胞[J].北京大学学报(医学版),2011,43(2):173-178.
[3] 李 丹,谭 岩,刘力华,等.CEA迷你基因串联体肿瘤疫苗的构建[J].吉林大学学报(医学版),2007,33(02):377-380.
[4] Khalili S,Rahbar MR,Dezfulian MH,etal.In silico analyses of Wilms tumor protein to designing a novel multi-epitope DNA vaccine against cancer[J].J Theor Biol,2015,379:66-78.
[5] Rodriguez F,An LL,Harkins S,etal.DNA immunization with minigenes:low frequency of memory cytotoxic T lymphocytes and inefficient antiviral protection are rectified by ubiquitination[J].J Virol,1998,72(6):5174-5181.
[6] Ghaffarifar F,Jorjani O,Sharifi Z,etal.Enhancement of immune response induced by DNA vaccine cocktail expressing complete LACK and TSA genes against Leishmania major[J].APMIS,2013,121(4):290-298.
[7] Al-Ojali SM,Moore CB,Al-Ramadi BK,etal.Enhancement of the anti-Salmonella immune response in CD154-deficient mice by an attenuated,IFN-γ-expressing,strain of Salmonella enterica serovar Typhimurium[J].Microb Pathog,2012,52(6):326-335.
[8] Hung CF,Calizo R,Tsai YC,etal.A DNA vaccine encoding a single-chain trimer of HLA-A2 linked to human mesothelin peptide generates anti-tumor effects against human mesothelin-expressing tumors[J].Vaccine,2007,25(1):127-135.
[9] He X,Tsang TC,Zhang T,etal.Antigen epitope-expressing cytokines for DNA immunization[J].Vaccine,2005,23(16):1966-1972.
[10] Nawwab Al-Deen FM,Selomulya C,Kong YY,etal.Design of magnetic polyplexes taken up efficiently by dendritic cell for enhanced DNA vaccine delivery[J].Gene Ther,2014,21(2):212-218.
[11] Jin L,Zhu A,Wang Y,etal.A Th1-recognized peptide P277,when tandemly repeated,enhances a Th2 immune response toward effective vaccines against autoimmune diabetes in nonobese diabetic mice[J].J Immunol,2008,180(1):58-63.
[12] Xu M,Zhou L,Zhang Y,etal.A fixed human umbilical vein endothelial cell vaccine with 2 tandem repeats of microbial HSP70 peptide epitope 407-426 as adjuvant for therapy of hepatoma in mice[J].J Immunother,2015,38(7):276-284.
[收稿2016-10-09]
(编辑 倪 鹏)
Observation of anti tumor activity in vivo of three tandem repeats of minigene DNA vaccine derived from CEA gene
FANGYan-Qiu,WEIHai-Feng,LIDan,MIXu-Guang,LIULei,LIShou-Qing,TANYan.
CenterforMedicalTreatmentandDiagnosis,JilinProvincePeople’sHospital,Changchun130021,China
Objective:To observe the inhibitory effect of haploid vaccine pcDNA-CEA625-667and three tandem repeats of minigene DNA vaccine pcDNA-triCEA625-667derived from CEA gene on tumor in mice bearing tumor and the changes of survival time.Methods: The experimental animal model of mouse liver cell carcinoma was established and the mice were immunized with pcDNA-CEA625-667and three series of DNA vaccine.Some of the mice were treated with normal saline as control group.The growth curve of tumor growth curve was recorded and the effect of vaccine on the survival time of tumor bearing mice was observed.Results: Compared with the normal saline control group,the two vaccines were able to significantly inhibit the tumor size and growth rate (P<0.01) of CEA positive tumor bearing mice,the inhibition of pcDNA-triCEA625-667vaccine group was significantly better than the pcDNA-CEA625-667vaccine group (P<0.01),while the two were not inhibited tumor growth in CEA negative tumor bearing mice.The average survival time of the pcDNA-CEA625-667vaccine group was(48.50±6.73)d,and there was significant difference (P<0.01) compared with the saline control group (39.00±6.64)d.The survival time (48.50± 6.73)d of the pcDNA-triCEA625-667vaccine group was significantly higher than that of the normal saline control group and the pcDNA-CEA625-667vaccine group (P<0.01).The survival time of CEA negative tumor bearing mice could not be prolonged in the two groups.Conclusion: Either the haploid or the three series of the DNA vaccine,were able to significantly inhibit tumor growth rate (P<0.01) and significantly prolong the survival time(P<0.01) of CEA positive tumor bearing mice,but they had no therapeutic effect on CEA negative tumor bearing mice.
Carcino-embryonic antigen;Minigene;DNA vaccine;Vivo experiment;Anti tumor
10.3969/j.issn.1000-484X.2017.01.012
①本文受吉林省科技厅国际合作项目(20140414043GH)、吉林省科技厅中青年科技创新领军人才及团队项目(20140519018JH)、吉林省人社厅省人才开发资金(2016年度)和吉林省科技厅重点实验室项目(20122113)资助。
方艳秋(1968年-),女,博士,教授,主任医师,硕士生导师,主要从事肿瘤生物治疗基础与临床研究,E-mail:yq.fang@163.com。
及指导教师:谭 岩(1956年-),男,博士,教授,博士生导师,主要从事肿瘤生物治疗及疫苗研发方面的研究,E-mail:tanyan49@hotmail.com。
R392 R730.5
A
1000-484X(2017)01-0062-04
②吉林大学第一医院呼吸内科,长春130012。
