氧化槐果碱对小鼠炎症性疼痛的镇痛作用研究
2017-02-15黎伟华赵玉萍李凤梅马鹏生余建强
吴 璟,杨 文,郑 婕,杨 洋,黎伟华,赵玉萍,李凤梅,马鹏生,余建强*
(1. 宁夏医科大学实验动物中心,银川 750004;2.宁夏医科大学药学院,银川 750004)
氧化槐果碱对小鼠炎症性疼痛的镇痛作用研究
吴 璟1,杨 文1,郑 婕2,杨 洋2,黎伟华1,赵玉萍2,李凤梅2,马鹏生2,余建强2*
(1. 宁夏医科大学实验动物中心,银川 750004;2.宁夏医科大学药学院,银川 750004)
目的 研究氧化槐果碱对二甲苯和角叉菜胶诱导的小鼠炎症性疼痛的影响,以探索其可能的机制。方法 ICR小鼠50只,随机分为模型组、ASP治疗组、氧化槐果碱高、中、低剂量组,各组分别给予对应药物1 h后,采用二甲苯致小鼠耳肿胀实验和角叉菜胶诱导的小鼠足趾肿胀实验,研究氧化槐果碱对小鼠各种炎症性刺激的影响。结果 与生理盐水组相比, 氧化槐果碱各剂量组能明显抑制二甲苯致小鼠耳肿胀程度和角叉菜胶致小鼠足趾肿胀程度;小鼠足组织的TNF-α,IL-1β,IL-6和PGE2水平显著降低。结论 OSC对角叉菜胶诱导的炎性疼痛具有明显的镇痛作用,可能与其抑制炎性因子的分泌有关。
氧化槐果碱;炎性疼痛;炎性细胞因子
炎症性疼痛是一种世界范围内日益增长的人类健康保健问题,它降低了患者的生活质量。与炎症性疼痛相关的病症包括外伤、间质性膀胱炎、胰腺炎、类风湿性关节炎和骨关节炎[1]。炎性疼痛一般用阿片类药物和非甾体类抗炎药治疗,但两种药物均受到(如成瘾、镇静和严重的心血管效应)副作用的限制。氧化槐果碱(OSC)是从豆科植物苦豆子中提取的生物碱。有关研究证明:OSC在乙酸诱导的扭体试验和在福尔马林诱导的炎性疼痛试验中具有显著镇痛作用[2]。本研究以OSC为研究对象,探讨其抗炎症性疼痛的作用,为临床提供一定理论依据。
1 材料和方法
1.1 实验动物
6~8周龄雄性SPF级ICR小鼠180只,由宁夏医科大学实验动物中心[SCXK(宁)2015-0001]提供,体重18~24 g,饲养于宁夏医科大学实验动物中心屏障动物实验设施内[SYXK(宁)2015-0001],室温、昼夜明暗交替(12/12 h),自由进水摄食。每一只动物仅用于一个单一的实验并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与设备
爪肿胀体积测量仪(YLS-7A,山东省医学科学院设备站);氧化槐果碱(OSC宁夏药物研究所,批号20130001);阿司匹林(Sigma-Aldrich公司,CAS:50-78-2);二甲苯(北京化工厂,批号20130530);角叉菜胶(Shanghai Kai Yang Biotechnology Co.Ltd 20130104);小鼠IL-1β ELISA检测试剂盒(美国RayBiotech公司, ELM-IL1beta-001C)、小鼠IL-6 ELISA检测试剂盒(美国RayBiotech公司,ELM-IL6-001C);小鼠TNF-α ELISA检测试剂盒(美国RayBiotech公司,ELM-TNFalpha-001);小鼠PGE2 ELISA检测试剂盒(美国R&D公司,KGE004B)。
1.3 实验方法
1.3.1 小鼠的急性毒性实验
取ICR小鼠50只, 随机均分成 5 组, 将OSC按 1∶0.8 等比计算配制成5 个剂量组,腹腔注射给药后, 观察72 h。采用改良寇氏法计算 LD50=240 mg/kg。给药最大剂量后,小鼠出现不安、阵挛、角弓反张、惊厥等症状,最后以呼吸抑制而死亡。
1.3.2 小鼠耳肿胀试验
取ICR小鼠50只,随机分组,每组10只。分别为模型组(NS,腹腔注射 0.1 mL/10g),阿司匹林组(400 mg/kg 灌胃给药 0.1 mL/10g),OSC(80,40,10 mg/kg)药物组(腹腔注射 0.1 mL/10g)。给药1 h 后,将各组小鼠分别于左耳正反两面均匀涂上二甲苯50 μL致炎,40 min 后脱颈椎处死小鼠,迅速剪下动物的双耳,并沿边缘打下9 mm耳片,于扭力天平上称重,同一只动物左右耳的重量差即为肿胀度[3]。
小鼠肿胀度=左耳耳片重量-右耳耳片重量。
小鼠耳肿度抑制率(%)=(模型组肿胀度 -给药组肿胀度)/模型组肿胀度×100%
1.3.3 角叉菜胶致小鼠炎性疼痛实验
取ICR小鼠50只,随机分组,每组10只。分别为模型组(NS, 腹腔注射0.1 mL/10g),阿司匹林组(400 mg/kg 灌胃给药0.1 mL/10g,OSC(80,40,10 mg/kg)药物组(腹腔注射0.1 mL/10g),分别于给药0.5 h后,在小鼠右后足底注射角叉菜胶溶液30 μL(300 μg/paw)[4]。
1.3.3.1 足趾容积的测定
于给药后1、2、3、4、5 h,采用足趾容积测量仪测量右后踝关节以下容积。
1.3.3.2 机械缩足反射阈值(paw withdrawal threshold, PWT)的测定[5]
在保证实验环境安静且光照适宜后,将待测小鼠置于2 mm×2 mm孔隙的金属网格上。用固定大小的有机玻璃盒隔开各只小鼠(一次可放6只),待小鼠适应0.5 h后,测定小鼠的机械缩足反射阈值(PWT)。使用不同刺激强度的Von Frey Filaments (vFFs) 刺激小鼠的第3、4足趾的趾间皮肤,观察小鼠可能发生的缩足反应。刺激强度一般从0.4 g开始,若vFFs纤维丝弯曲超过90°时,若小鼠仍不发生抬足,则视为无反应。此时应给予相邻的刺激强度大一级的纤维丝;如果有反应,则更换相邻的刺激强度小一级的纤维丝。每次刺激时间间隔必须大于10 s,直到找到能引起50%抬足反应的纤维丝。本实验中最大刺激强度值为4.0 g,记录所测小鼠的能引起50%抬足反应的纤维丝刺激强度值,即为机械缩足反射阈值 (g)。分别测定给药前和给药后1、2、 3、 4、5 h的机械缩足反射阈值。
1.3.4 氧化槐果碱对角叉菜胶致小鼠炎性痛损伤组织中TNF-α、IL-1β、IL-6和PGE2表达水平的检测
雄性ICR小鼠30只,随机分为:正常组、模型组、OSC(80 mg/kg)组,每组10只。各组小鼠分别于给药0.5 h后,在除正常组外所有小鼠的右后足底注射角叉菜胶溶液30 μL(300 μg/paw),5 h后,处死小鼠,剪下右后足底损伤组织,制成10%组织匀浆,4℃,1.0×104r/min,离心15 min,取上清,酶标仪测定小鼠炎性痛损伤组织中TNF-α、IL-1β、IL-6和PGE2的蛋白表达水平(按试剂盒说明书操作)
1.4 统计学方法
采用SPSS 13.0统计软件进行数据处理分析,结果以均数±标准差表示(±s)。两样本均数间比较采用t检验,多样本均数间比较采用One-way ANOVA检验,以P< 0.05为差异有统计学意义。
2 结果
2.1 氧化槐果碱对二甲苯致小鼠耳肿胀度的影响[4]
于小鼠左耳正反两面涂上50 μL二甲苯1 h后,模型组的耳肿胀度达到15.78±1.75 mg,说明模型制备成功。与模型组比较,阳性药阿司匹林组(400 mg/kg)的耳肿胀度显著降低(P< 0.01)抑制率达50.57%;氧化槐果碱(80 mg/kg)组的耳肿胀度显著降低(P< 0.01),抑制率达52.79%,略高于阿司匹林组;氧化槐果碱(40 mg/kg)组的耳肿胀度也显著降低(P< 0.01);氧化槐果碱(10 mg/kg)组的耳肿胀度也明显降低,具有统计学差异(P< 0.05)(见表1)。
2.2 氧化槐果碱对角叉菜胶致小鼠足趾炎症反应肿胀度的影响
各组小鼠造模前的基础容积之间相互比较无显著性差(P> 0.05)。与正常组比较,模型组1~5 h的足肿胀度显著增高(P< 0.01),说明角叉菜胶诱发了足肿胀,模型制备成功。与模型组比较,阳性药阿司匹林组(400 mg/kg)给药后1~5 h的足肿胀度显著性降低(P< 0.05);氧化槐果碱(80 mg/kg)组给药后1~5 h的足肿胀度显著性降低(P< 0.01);氧化槐果碱(40 mg/kg)组给药后2~5 h足肿胀度显著性降低(P< 0.05);而氧化槐果碱(10 mg/kg)组给药后各时间点的足肿胀度差异无显著性(P> 0.05)(见表2)。
表1 氧化槐果碱对二甲苯致小鼠耳肿胀度的影响 (±s,n=10)
Tab.1 Effect of oxysophocarpine (OSC) on xylene-induced ear swelling in mice
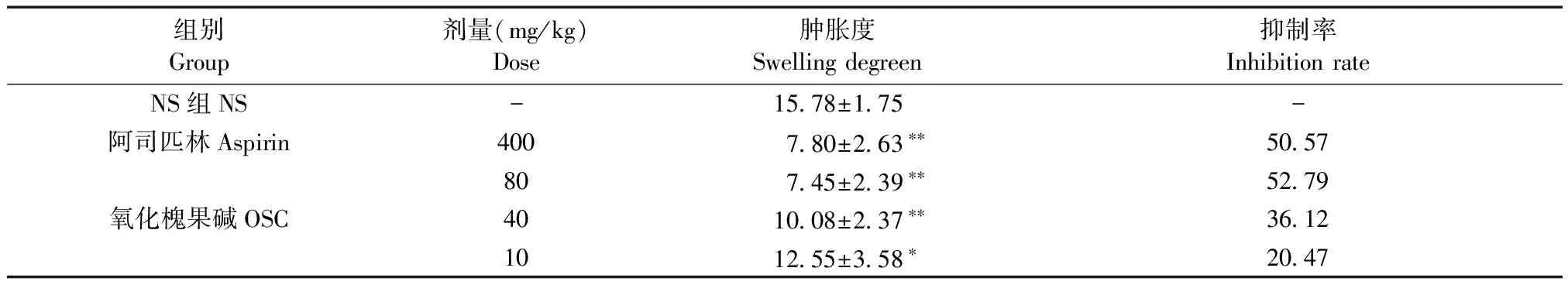
表1 氧化槐果碱对二甲苯致小鼠耳肿胀度的影响 (±s,n=10)
组别Group剂量(mg/kg)Dose肿胀度Swellingdegreen抑制率InhibitionrateNS组NS-1578±175-阿司匹林Aspirin400780±263∗∗505780745±239∗∗5279氧化槐果碱OSC401008±237∗∗3612101255±358∗2047
注:与NS组比较,*P< 0.05,**P< 0.01。
Note. Comparison of the NS group,*P< 0.05,**P< 0.01.
表2 氧化槐果碱对角叉菜胶致小鼠足趾炎症反应肿胀度的影响(±s, n=10)
Tab.2 Effect of oxysophocarpine (OSC) on carrageenan-induced the swelling degree of mice with toes inflammation
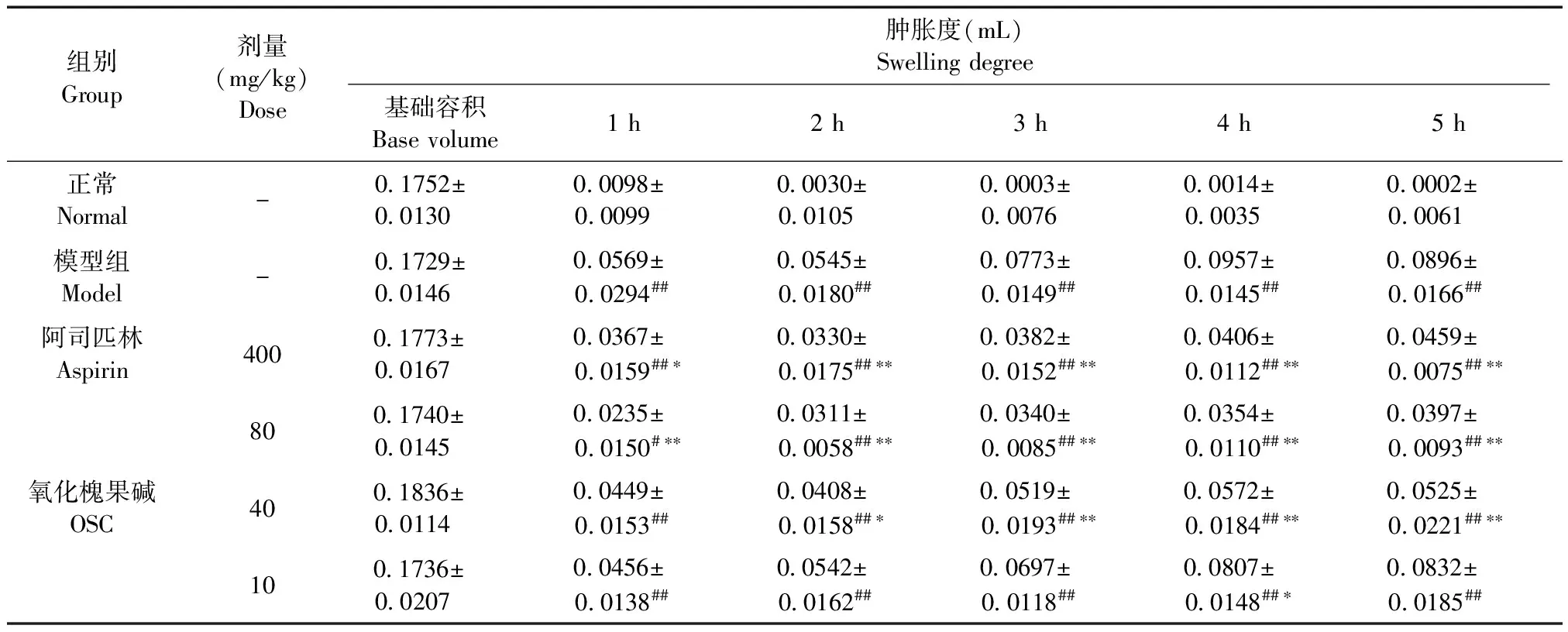
表2 氧化槐果碱对角叉菜胶致小鼠足趾炎症反应肿胀度的影响(±s, n=10)
组别Group剂量(mg/kg)Dose肿胀度(mL)Swellingdegree基础容积Basevolume1h2h3h4h5h正常Normal-01752±0013000098±0009900030±0010500003±0007600014±0003500002±00061模型组Model-01729±0014600569±00294##00545±00180##00773±00149##00957±00145##00896±00166##阿司匹林Aspirin40001773±0016700367±00159##∗00330±00175##∗∗00382±00152##∗∗00406±00112##∗∗00459±00075##∗∗氧化槐果碱OSC8001740±0014500235±00150#∗∗00311±00058##∗∗00340±00085##∗∗00354±00110##∗∗00397±00093##∗∗4001836±0011400449±00153##00408±00158##∗00519±00193##∗∗00572±00184##∗∗00525±00221##∗∗1001736±0020700456±00138##00542±00162##00697±00118##00807±00148##∗00832±00185##
注:与正常组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.Comparison of the normal group,#P< 0.05,##P< 0.01. Comparison of the model group,*P< 0.05,**P< 0.01.
表3 氧化槐果碱对角叉菜胶致小鼠炎性痛痛阈值的影响(±s, n=10)
Tab.3 Effect of oxysophocarpine (OSC) on carrageenan-induced inflammatory pain threshold of mice
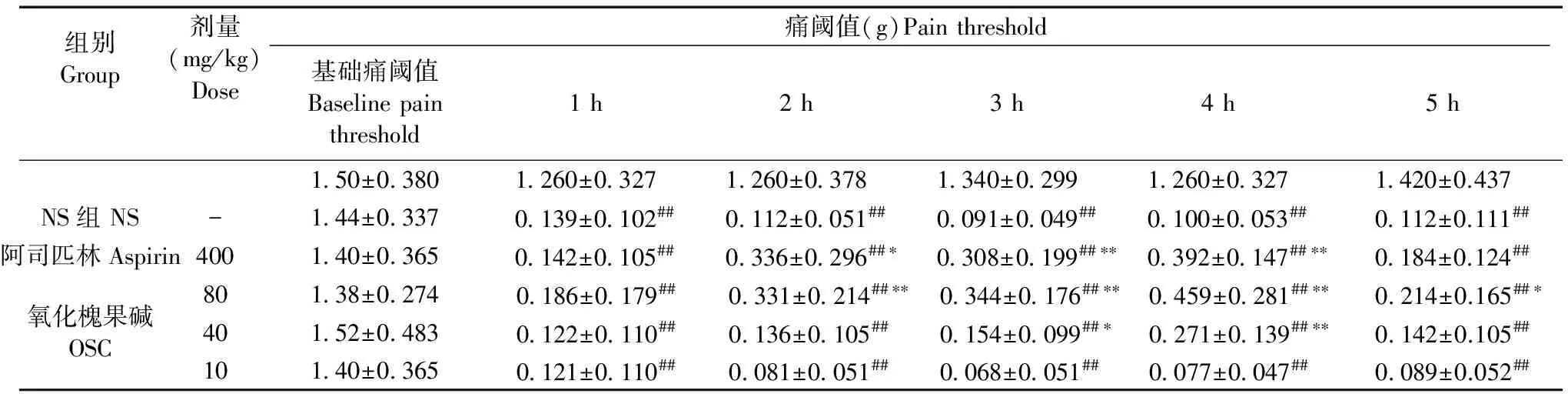
表3 氧化槐果碱对角叉菜胶致小鼠炎性痛痛阈值的影响(±s, n=10)
组别Group剂量(mg/kg)Dose痛阈值(g)Painthreshold 基础痛阈值Baselinepainthreshold1h2h3h4h5h150±03801260±03271260±03781340±02991260±03271420±0.437NS组NS-144±03370139±0102##0112±0051##0091±0049##0100±0053##0112±0.111##阿司匹林Aspirin400140±03650142±0105##0336±0296##∗0308±0199##∗∗0392±0147##∗∗0184±0.124##氧化槐果碱OSC80138±02740186±0179## 0331±0214##∗∗ 0344±0176##∗∗ 0459±0281##∗∗ 0214±0.165##∗40152±04830122±0110##0136±0105##0154±0099##∗0271±0139##∗∗0142±0.105##10140±03650121±0110##0081±0051##0068±0051##0077±0047##0089±0.052##
注:与正常组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.Comparison of the normal group,#P< 0.05,##P< 0.01. Comparison of the model group,*P< 0.05,**P< 0.01.
表4 氧化槐果碱对角叉菜胶致小鼠炎性痛损伤组织中TNF-α、IL-1β、IL-6、PGE2蛋白表达水平的影响 (±s,n=10)
Tab.4 Effects of oxysopressin on carrageenan-induced the expression of TNF-α, IL-1β, IL-6 and PGE2 proteins in inflammatory pain-injuried mice

表4 氧化槐果碱对角叉菜胶致小鼠炎性痛损伤组织中TNF-α、IL-1β、IL-6、PGE2蛋白表达水平的影响 (±s,n=10)
组别Group剂量(mg/kg)DoseTNF⁃α(pg/mg)IL⁃1β(pg/mg)IL⁃6(pg/mg)PGE2(pg/mg)正常组Normal-8290±76615960±179111604±22876308±2521模型组Model-38196±3472##34325±2361##81149±4612##21472±2935##氧化槐果碱OSC8016693±1349∗∗21832±1963∗∗58651±5868∗∗10915±1897∗∗
注:与正常组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.Comparison of the normal group,#P< 0.05,##P< 0.01. Comparison of the model group,*P< 0.05,**P< 0.01.
2.3 氧化槐果碱对角叉菜胶致小鼠炎性痛痛阈值的影响[5]
各组小鼠造模前的基础机械缩足反射阈值之间相互比较无显著性差异(P> 0.05)。与正常组比较,角叉菜胶模型组小鼠1~5 h的机械缩足反射阈值显著降低(P< 0.01),说明角叉菜胶诱发了炎性疼痛,模型制备成功。与模型组比较,阳性药阿司匹林组(400 mg/kg)给药后2~4 h的机械缩足反射阈值显著性回升(P< 0.05);氧化槐果碱(80 mg/kg)组给药后2~5 h的机械缩足反射阈值显著性回升(P< 0.05);氧化槐果碱(40 mg/kg)组给药后3~4 h的机械缩足反射阈值显著性回升(P< 0.05);而氧化槐果碱(10 mg/kg)组给药后各时间点的机械缩足反射阈值无显著性差异(P> 0.05)(见表3)。
2.4 氧化槐果碱对角叉菜胶致小鼠炎性痛损伤组织中TNF-α、IL-1β、IL-6、PGE2蛋白表达水平的影响
Elisa法检测结果显示:与正常组比较,角叉菜胶致小鼠炎性痛模型组小鼠损伤组织中促炎因子TNF-α、IL-1β、IL-6和PGE2的蛋白表达水平显著上升(P< 0.01);与模型组相比,氧化槐果碱组小鼠损伤组织中的促炎因子TNF-α、IL-1β、IL-6和PGE2蛋白表达水平显著下降(P< 0.01)(见表4)。
3 讨论
疼痛通常与炎症有关,这是由组织损伤,化学刺激,或自身免疫过程引起,这些能够引起组织损伤的致炎因子参与伤害感受器的外周敏化,并为抗炎剂提供治疗范围,治疗其与炎症反应相关的疾病[6-9]。二甲苯诱导的小鼠耳肿胀试验是一种成本低,时间短和分级客观的对药物抗炎活性进行评价的方法[10]。角叉菜胶作为致炎剂,可引起皮肤局部毛细血管通透性增高,炎症细胞浸润、组织肿胀,造成耳廓及足趾急性渗出性炎症水肿[11]。局部应用二甲苯和足底注射角叉菜胶都产生炎症反应[12]。角叉菜胶诱导的足趾肿胀试验已常被用于评估天然产物的抗炎作用。角叉菜胶诱导的足趾肿胀试验通常被划分成两个阶段。第一阶段,或是急性期,持续1~2 h,由组胺和5-羟色胺介导形成水肿。第二阶段,或是引发炎症期,持续2~5 h,缓激肽和PEG2保持了较高的血管通透性并诱导促炎细胞因子的释放。这些介质参与炎性反应,刺激感受器,从而诱发和加剧疼痛[13]。本研究通过角叉菜胶诱导小鼠的足趾肿胀模型评估OSC的改善炎症性疼痛的效果[14]。
目前,临床常用的抗炎药虽抗炎作用显著,但长期和大量的应用可产生非常严重的不良反应[15-16]。开发天然药物的抗炎作用成为了研究者关注的焦点。OSC是由天然豆科植物苦豆子中提取一类生物碱,研究表明,对二甲苯致小鼠耳肿胀性炎症有明显的抑制作用,对角叉菜胶致小鼠足肿胀有一定的抑制作用,OSC改善了小鼠爪的机械异常性疼痛阈值。OSC能明显降低炎症模型中TNF-α,1L-1β,IL-6和PEG2的含量。抗炎作用可能与细胞因子的水平有关。这些发现可能对了解OSC治疗炎症疼痛的分子基础有重要意义。
因此,我们的研究表明,OSC将在治疗炎症性疼痛方面可能作为抗炎药物使用,为临床进一步的开发利用提供了理论基础。
[1] Reinold H, Ahmadi S, Depner UB,etal. Spinal inflammatory hyperalgesia is mediated by prostaglandin E receptors of the EP2 subtype[J].Clin Invest,2005, 115:673-679.
[2] Xu T, Li Y, Wang H,etal. Oxysophocarpine induces anti-nociception and increases the expression of GABAAα1 receptors in mice[J].Mol Med Rep,2013, 7:1819-1825.
[3] 徐叔云,卞如濂,陈修.药理实验方法学(第三版)[M].人民卫生出版社, 1991,728:1171-1173.
[4] 骆新,孙艳,永雪薇,等.复方薰衣草油膏治疗实验性豚鼠烫伤、抗炎及镇痛的效果观察[J].中国比较医学杂志,2014,24(9):28-31.
[5] 周顺长,杜佐华,叶明霞,等.复方亚甲蓝注射液浸润麻醉对小鼠痛阈的影响[J].中国比较医学杂志,2006,16(3):151-152
[6] Ristoiu V. Contribution of macrophages to peripheral neuropathic pain pathogenesis[J]. Life Sci,2013, 93: 870-881.
[7] Guillot X, Semerano L, Decker P,etal. Pain and immunity[J].Joint Bone Spine,2012, 79: 228-236.
[8] Yosipovich G, Mills KC, Nattkemper LA,etal. Association of pain and itch with depth of invasion and inflammatory cell constitution in skin cancer: results of a large clinicopathologic Study[J]. JAMA Dermatol,2014, 150: 1160-1166.
[9] Ren K, Dubner R. Interactions beween the immune and nervous systems in pain[J]. Nat Med,2010,16:1160-1166.
[10] Aquino AB, Cavalcante-Silva LH, Matta CB,etal. The antinociceptive and anti-inflammatory activities of Aspidosperma tomentosum (Apocynaceae)[J]. ScientificWorldJournal,2013, 2013:218627.
[11] 陈建双,张玉玲,赵波,等.赤雹根总皂苷抗炎作用研究[J].中国实验方剂学杂志,2012,18(8):163-166.
[12] Choi JI, Koehrn FJ, Sorkin LS. Carrageenan induced phosphorylation of Ark is dependent on neurokinin-1 expressing neurons in the superficial dorsal horn[J]. Mol Pain,2012, 8:4.
[13] Chou TC.Anti-inflammatory and analgesic effects of paeonol in carrageenan-evoked thermal hyperalgesia[J]. Br J Pharmacol,2003, 139: 1146-1152.
[14] Khan S,Shehzad O,Chun J,etal. Mechanism underlying anti-hyperalgesic and anti-allodynic properties of anomalin in both acute and chronic inflammatory pain models in mice through inhibition of NFkB, MAPKs and CREB signaling cascade[J]. Eur J Pharmacol,2013, 718:448-458.
[15] 杨世杰,王怀良.药理学[M].北京:人民卫生出版社,2001:421-428.
[16] 洪靖,许卫娜.非甾体抗炎药长时间应用的危害及预防[J].中国伤残医学,2014,22(18):152-153.
Oxysophocarpine ameliorates carrageenan-induced inflammatory pain via inhibiting expressions of prostaglandin E2and cytokines in mice
WU Jing1,YANG Wen1,ZHENG Jie2,YANG Yang2,LI Wei-hua1,ZHAO Yu-ping2, LI Feng-mei2, MA Peng-sheng2,YU Jian-qiang2*
(1. Laboratory Animal Center, Ningxia Medical University, Yinchuan 750004, China; 2.Department of Pharmacology, School of pharmacy, Ningxia Medical University, Yinchuan 750004, China)
Objective In this study we investigated the analgesic effect of oxysophocarpine (OSC) on carrageenan-induced inflammatory pain in mice and to explore its possible mechanism. Methods Mouse ear swelling test and carrageenan-induced paw edema were used to investigate the effects of OSC (10, 40 and 80 mg/kg) on inflammatory pain in mice. The mechanical hyperalgesia and allodynia were measured by von Frey filaments. Paw edema was assessed by toe volumetric measuring instrument. text the content of TNF-α, IL-1β, IL-6 and PGE2.Results OSC showed a significant anti-inflammatory effect in the mouse ear swelling test. OSC (10, 40 and 80 mg/kg) also significantly reduced the paw edema volume and improved mechanical allodynia threshold value on carrageenan-induced inflammatory pain, as well as relieved paw tissues inflammatory damage and reduced the numbers of neutrophils in mice. OSC significantly suppressed over-expression of TNF-α, IL-1β, IL-6 and PGE2. Conclusions Based on these findings we propose that OSC attenuates inflammatory pain by suppressing the Pro-inflammatory cytokines.
Oxysophocarpine;Inflammatory pain;Pro-inflammatory cytokines
宁夏高等学校科学研究项目(NGY2014097)。
吴璟(1977-),女,硕士,副教授,研究方向:医学实验动物学及药理学研究。E-mail:wj.nxmc@qq.com
余建强(1965-),男,硕士生导师,研究方向:药理学。E-mail:yujq910315@163.com
研究报告
R-332
A
1671-7856(2017) 01-0054-05
10.3969.j.issn.1671-7856.2017.01.011
2016-06-27
