主动脉夹层撕裂内膜走行规律的MSCTA研究
2017-02-15原小军郝粉娥刘挨师
原小军,郝粉娥,赵 磊,刘挨师*
(1.包头市第八医院医学影像科,内蒙古 包头 014040;2.内蒙古医科大学附属医院影像诊断科,内蒙古 呼和浩特 010050)
主动脉夹层撕裂内膜走行规律的MSCTA研究
原小军1,郝粉娥2,赵 磊2,刘挨师2*
(1.包头市第八医院医学影像科,内蒙古 包头 014040;2.内蒙古医科大学附属医院影像诊断科,内蒙古 呼和浩特 010050)
目的 观察Stanford A型和Stanford B型主动脉夹层(AD)主动脉腔内的撕裂内膜走行规律。方法 回顾性分析65例AD患者的CTA资料,在胸腰椎体和椎间隙层面轴位图像上确定夹层动脉撕裂内膜与管壁两个结合点的位置,并计算真腔所处夹角角平分线(TLIAB)的钟点数。同时观察AD对主动脉分支大血管的影响情况。结果 升主动脉段Stanford A型内膜撕裂由主动脉根部向弓部呈顺时针旋转;真腔位于主动脉腔左侧约3~6点位置,TLIAB位置的平均钟点数为4.16±1.51。降主动脉段AD内膜撕裂由近端向远端呈逆时针旋转,Stanford A型和B型撕裂模式大致相同,旋转幅度相似;主动脉弓降部真腔位于主动脉腔右侧,TLIAB位于8~9点,降主动脉远端TLIAB位于7~8点。左冠状动脉均开口于真腔,其钟点数(3.82±0.41)与对应层面TLIAB(3.69±0.82)差异无统计学意义(t=0.86,P=0.40);右冠状动脉开口紧邻血管壁内膜撕裂处。Stanford A型和B型AD的降主动脉段分支血管起源部位分型差异均无统计学意义(P均>0.05)。结论 AD内膜呈螺旋状撕裂,升主动脉段由主动脉根部至弓部呈顺时针旋转,降主动脉段由弓降部至远端呈逆时针旋转且Stanford A、B型的旋转模式大致相同。Stanford A型和B型AD主动脉分支大血管的受累情况相似。
体层摄影术,X线计算机;主动脉夹层;撕裂内膜
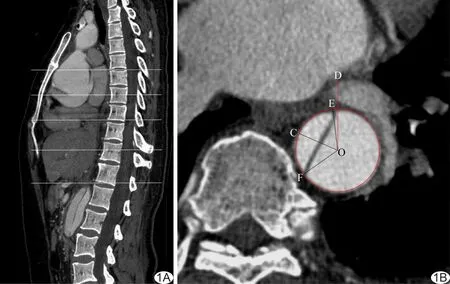
图1 主动脉夹层CTA图像数据采集方法 A.于正中矢状位图像定位选择椎体中间和椎间隙层面(白线)轴位图像; B.所选择的轴位图像,以主动脉断面(圆圈)为表盘,O表示圆心,OD示身体正前方,以D为零点,E、F分别为撕裂内膜与主动脉壁的结合点,计算∠EOF平分线OC所在钟点数
主动脉夹层(aortic dissection, AD)是指在高血压及其他主动脉病变作用下[1-2],血液进入主动脉壁中层导致主动脉壁内膜撕裂、中层分离,并沿主动脉长轴扩展使主动脉腔成为真假两个管腔的一种病理改变[3]。血流动力学研究显示血管壁的压力分布和变化、血流形式和速度变化均与AD发生具有相关性,且变化发生的区域与临床所见内膜初始撕裂口位置相吻合,而临床观察发现AD撕裂内膜走行多呈螺旋状[4]。本研究探讨AD撕裂内膜的走行规律,以期为AD的快速准确诊断、治疗等提供更多的信息。
1 资料与方法
1.1 一般资料 回顾性分析2011年6月—2013年12月于内蒙古医科大学附属医院经MSCTA确诊为AD的65例患者,男51例,女14例,中位年龄51岁;其中45例有高血压病史。Stanford A型34例,B型31例。病程1 h~2个月,主要症状为急性发作的胸背部疼痛,呈持续性撕裂状剧痛。入组标准:①CTA图像上全主动脉显示清楚,主动脉管壁和撕裂内膜可以清晰分辨;②未经手术治疗;③初始破口单一。排除标准:①巨大主动脉瘤及破裂者;②主动脉明显纡曲;③不典型AD;④AD范围局限。
1.2 仪器与方法 采用GE Lightspeed VCT-XT 64排CT机,管电压120 kV,采用自动毫安技术,管电流峰值450~600 mAs,准直器宽度0.625 mm×64,球管旋转1周时间0.6 s,螺距0.984,FOV 500 mm×500 mm,矩阵512×512。扫描时间8~10 s,采用自动触发法,于气管隆突下1~2 cm层面胸主动脉内设置ROI,阈值120 HU。对比剂采用优维显(370 mgI/ml) 80~100 ml,注射流率4 ml/s。
1.3图像分析 采用AW 4.5工作站分析图像,观察AD病变范围并进行分型,观察撕裂内膜破口位置、撕裂内膜与血管壁结合处位置、主动脉大血管分支供血情况等。数据采集方法(图1):以正中矢状位图像定位椎体中间层面和椎间隙层面轴位图像,设定主动脉断面为表盘、身体正前方为零点,测量撕裂内膜与主动脉壁2个结合点的钟点数,以此计算真腔部分所处夹角的角平分线(true lumen included angle bisector, TLIAB)所在钟点数。
根据CTA图像所见血管起源部位进行分型[5]:Ⅰ型,起源于真腔;Ⅱ型,双腔供血;Ⅲ型,起源于假腔。


图2 患者女,67岁,Stanford A型AD 升主动脉段真腔(黑箭)位于左侧,左冠状动脉(A,白箭)、右冠状动脉(B,白箭)均由真腔供血,右冠状动脉开口紧邻内膜撕裂处
采用χ2检验(当理论频数<1时,合并单元格)进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 内膜撕裂情况 Stanford A型升主动脉段内膜撕裂由主动脉根部向弓部呈顺时针旋转;真腔位于主动脉腔左侧约3~6点位置,TLIAB钟点数为4.16±1.51(图2)。
降主动脉段AD的数据分析范围为T4-5椎间盘~L4椎体层面,Stanford A型TLIAB钟点数为6.18~8.59,Stanford B型为5.96~8.66,相同层面Stanford A型与B型AD的TLIAB钟点数差异均无统计学意义(P均>0.05),TLIAB曲线大致重叠(图3)。主动脉弓降部(T4-5椎间盘~T6椎体层面)TLIAB位于血管壁右侧约8~9点位置,从弓降部向远端呈逆时针旋转,旋转幅度有波动但旋转趋势较缓和,至降主动脉远端(L3椎体、L3-4椎间盘平面)TLIAB约位于7~8点位置(图4)。

图3 降主动脉段Stanford A、B型AD 不同解剖层面TLIAB钟点数线图
2.2 分支血管情况 34例Stanford A型患者共68条冠状动脉均为真腔供血,右冠状动脉开口紧邻血管壁内膜撕裂处(图2)。左冠状动脉对应钟点数为3.82±0.41,同层面TLIAB为3.69±0.82,二者差异无统计学意义(t=0.86,P=0.40)。主动脉弓三大分支血管均无起源于假腔者(Ⅲ型),而Ⅰ型与Ⅱ型血管构成比的差异无统计学意义 (χ2=1,P=0.61,表1)。Stanford A型AD远端达到腹腔干动脉者33例,Stanford B型中29例;AD远端达到髂总动脉者Stanford A型25例,Stanford B型23例。Stanford A型和B型病例降主动脉段分支血管中,血管起源部位分型差异均无统计学意义(P均>0.05,表2)。

表1 Stanford A型AD患者主动脉弓三大分支血管受累情况[例(%),n=34]
3 讨论
MSCTA是AD首选影像学检查方法,其诊断敏感度和特异度可达100%[4]。AD形成的必需条件包括管壁因素和血流因素两方面。管壁因素是AD形成和破裂的关键[6];血流因素即血流动力学改变,如高血压。由于心脏和主动脉弓部特殊的解剖结构,主动脉内血液流动具有极强的脉动性和弯曲性,引起血管壁面压力、壁面剪应力、血流流线等发生变化。收缩期,主动脉外侧壁壁面压力因高速血流的离心力迅速升高,在主动脉升部和弓部交接处达到峰值,舒张期则迅速降低。壁面剪应力的脉动性在主动脉根部和弓部动脉分出处最为显著,局部血管壁受到血流冲击最强烈。在左颈总动脉和左锁骨下动脉起源区血流由层流变为湍流,流速达到峰值且变化剧烈[7]。周期性心脏射血的动力学效能使得主动脉升弓部活动明显,但动脉导管韧带远端胸主动脉活动则受限,致使相应区域血管壁各层间拉力增大[8]。血流动力学的脉动性突变加强,促进了动脉粥样硬化斑块形成并导致内膜撕裂。本研究结果显示真腔位于主动脉根部左后侧和弓降部右侧,与血流动力学突变位置相符,也与研究[9]统计的AD初始撕裂口位置相同。

表2 降主动脉主要分支血管受累情况[例(%)]
注:*:按Ⅰ型(完全真腔供血)与Ⅱ+Ⅲ型(不完全真腔供血)方式合并单元格进行四格表χ2检验

图4 患者女,34岁,Stanford B型AD 主动脉弓降部(A)、胸主动脉中段(B)、降主动脉段远端(C)真腔(箭)均位于右侧,但不同层面位置均不相同
AD的最大危害在于内膜撕裂不断扩大、假腔持续扩张延伸,累及主动脉分支血管导致相应脏器缺血和主动脉破裂。研究[10-13]显示假腔内不仅发生血流形式的改变,而且假腔管壁顺应性、尤其是降主动脉破口以远的顺应性也显著降低;同时血管壁面压力分布明显不均匀,主动脉弓降部、降主动脉下段真腔狭窄区和远端夹层破口处的壁面剪应力明显升高,造成血流对局部血管壁的“冲击效应”[14],假腔末端压力也明显高于真腔,使得假腔内血流速度和管壁位移明显大于真腔[15]。上述因素共同作用导致内膜撕裂沿主动脉弓内侧、降主动脉右侧不断向远端扩展。研究[16]显示约2/3的AD患者伴有高血压。本组高血压患者占69.23%(45/65),与文献报道大致相符,提示控制高血压对于AD的防治至关重要。
研究[17]发现97.6%的AD撕裂内膜走行呈螺旋状,本研究显示Stanford A、B型降主动脉段撕裂内膜由近向远均呈逆时针旋转,分析分支血管受累情况,发现二者分支血管起源部位分型差异均无统计学意义(P均>0.05),提示内膜撕裂对主动脉分支大血管的影响不因AD的分型而出现明显差异,即其血流动力学改变无显著差别。螺旋状的内膜撕裂可能是由心脏和主动脉弓的特殊解剖引起血流动力学在主动脉短轴方向的变化而引起的,需进一步的血流动力学研究证实。
综上所述,本研究对AD撕裂内膜空间形态进行分析,发现降主动脉段Stanford A、B型撕裂内膜走行具有相同的规律。掌握此规律可为识别真假腔提供新的思路,以提高其准确性,为临床医师正确、全面地诊疗AD、判断预后提供帮助。但本研究样本数较少,且处于初浅研究阶段,今后需增加样本量,进行更为细致的研究以深入分析其空间规律性。
[1] Khan IA, Nair CK. Clinical, diagnostic, and management perspeerives of aortic dissection. Chest, 2002,122(1):311-328.
[2] Carlson M, Silberbach M. Dissection of the aorta in Turner syndrome: Two cases and review of 85 cases in the literature. J Med Genet, 2007,44(12):745-749.
[3] Sundt TM. Intramural hematoma and penetrating aortic ulcer. Curr Opin Cardiol, 2007,22(6):504-509.
[4] 印隆林,杨志刚,陈加源,等.主动脉夹层的临床病理特点及CT诊断.中国医学影像技术,2010,26(7):1373-1375.
[5] 景在平.主动脉夹层的诊断和腔内隔绝术应用指南(初稿).中国实用外科杂志,2004,24(3):129-133.
[6] 杨金有,俞航,刘静,等.流固耦合分析分层的腹主动脉瘤模型.生物医学工程与临床,2014,18(4):310-314.
[7] 刘莹,章德发,毕勇强,等.主动脉弓及分支血管内非稳态血流分析.应用数学和力学,2015,36(4):432-439.
[8] Schaltmann TM, Becher AE. Pathogenesis of dissection aneurysm of aortic: Comparative histopathologic study of significance of medial changes. Am J Cardiol, 1977,39(1):21-26.
[9] Crawford ES, Coselli JS, Svensson LG, et al. Diffuse aneurysmal disease (chronic aortic dissection, Marfan, and mega aorta syndromes) and multiple aneurysm. Treatment by subtotal and total aortic replacement emphasizing the elephant trunk operation. Ann Surg, 1990,211(5):521-537.
[10] 李宇,范占明,张兆琪,等.MRI对急性Stanford B型主动脉夹层的形态及血液动力学的定量研究.中华放射学杂志,2008,42(4):363-367.
[11] 耿冀,范占明.PC-MRA对Stanford B型主动脉夹层血流动力学与顺应性的研究.首都医科大学学报,2013,34(3):333-338.
[12] 徐磊,王辉,张楠,等.磁共振弹性成像评价主动脉壁硬度.中国医学影像技术,2014,30(3):366-368.
[13] 郭子义,陈晶.动态三维血管建模法分析Stanford B型胸主动脉夹层四维相位对比MRI.第二军医大学学报,2014,35(6):651-656.
[14] 曾宇杰,罗坤,樊建人,等.主动脉夹层血液两相流动数值模拟分析.工程热物理学报,2016,37(4):780-784.
[15] 殷文聪,乔爱科.个性化主动脉夹层及其搭桥术的流固耦合数值模拟.医用生物力学,2014,29(5):411-417.
[16] 刘玉清.主动脉夹层,壁间血肿和穿透性粥样硬化性溃疡:影像学和发病机制探讨.中国介入影像与治疗学,2004,1(1):3-6.
[17] 杨志明,卢春燕,周翔平,等.主动脉夹层54例16层螺旋CT表现特征及其解剖、病理基础.中华心血管病杂志,2007,35(2):168-172.
MSCTA study on morphological characteristics of torn vascular intima of aortic dissection
YUANXiaojun1,HAOFen'e2,ZHAOLei2,LIUAishi2*
(1.DepartmentofMedicalImaging,BaotouEighthHospital,Baotou014040,China; 2.DepartmentofMedicalImaging,theAffiliatedHospitalofInnerMongoliaMedicalUniversity,Hohhot010050,China)
Objective To observe the morphological characteristics of torn vascular intima in aortic dissection (AD) of Stanford type A and type B. Methods The CTA data of 65 patients with AD was enrolled and analyzed retrospectively. On axial image paralleled with thoracolumbar vertebral body or intervertebral space, the joint points of torn vascular intima on arterial wall were found. The true lumen included angle bisector (TLIAB) was shown as hours on clock. The effects of AD on the main branches of aortic was observed. Results The torn vascular intima of Stanford type A on ascending aorta was rotated clockwise from aortic root to aortic arch, and the TLIAB located at 3 to 6 hour (mean value was 4.16±1.51) on the left of aorta. The torn vascular intima on descending aorta was rotated counterclockwise from near-end to far-end. A similar morphological patterns and rotational amplitude was observed on Stanford type A and type B, the TLIAB located at 8 to 9 hour on descending part of aortic arch level, and at 7 to 8 hour on aortic arch level on the right of aorta. There was no statistically significant difference between the mean hour (3.82±0.41) of left coronary artery which originated from the true lumen and that of the TLIAB of corresponding levels (3.69±0.82,t=0.86,P=0.40). The right coronary artery originated from the true lumen that nearby the joint point between the torn vascular intima and arterial wall. About the effects of AD on the branches of the descending aorta, there was no significant difference between Stanford type A and type B (allP>0.05). Conclusion The vascular intima of AD is generally torn spirally. For ascending aorta, the torn vascular intima is rotated clockwise from aortic root to aortic arch, on the contrary, the torn vascular intima is rotated counterclockwise from aortic arch to the far-end on descending aorta, and the spiral pattern of Stanford type A and type B is similar. The effects of AD on the main branches is also similar between Stanford type A and type B.
Tomography, X-ray computed; Aortic dissection; Torn vascular intima
内蒙古自治区卫生和计划生育委员会科研项目(201301050)。
原小军(1975—),男,山西屯留人,硕士,副主任医师。研究方向:CT成像技术及影像诊断。E-mail: 1262961310@qq.com
刘挨师,内蒙古医科大学附属医院影像诊断科,010050。E-mail: liuaishi@sina.com
2016-06-10
2016-09-20
R814.42; R543.1
A
1003-3289(2017)01-0035-05
10.13929/j.1003-3289.201606041
