动态磁敏感对比增强MRI和动态对比增强MRI鉴别诊断胶质瘤复发和放射性脑损伤
2017-02-15胡兰花徐婷婷宋加哲范国光
胡兰花,于 韬, 徐婷婷, 宋加哲,张 亚,范国光*
(1.中国医科大学附属第一医院放射科,3.神经内科,辽宁 沈阳 110001;2.辽宁省肿瘤医院放射科,辽宁 沈阳 110042)
动态磁敏感对比增强MRI和动态对比增强MRI鉴别诊断胶质瘤复发和放射性脑损伤
胡兰花1,于 韬2, 徐婷婷3, 宋加哲1,张 亚1,范国光1*
(1.中国医科大学附属第一医院放射科,3.神经内科,辽宁 沈阳 110001;2.辽宁省肿瘤医院放射科,辽宁 沈阳 110042)
目的 探讨动态磁敏感对比增强MRI(DSC-MRI)及动态对比增强MRI(DCE-MRI)在鉴别脑胶质瘤术后放化疗后复发和放射性脑损伤中的临床应用价值。方法 对19例经临床病理确诊为脑胶质瘤患者在术后、放化疗前、放化疗后定期行DSC及DCE检查,得到相关的血流动力学参数值并将灌注成像影像诊断结果与临床最终诊断结果对照,分析各灌注参数在鉴别诊断中的价值。结果 11例为胶质瘤复发,8例为放射性脑损伤。胶质瘤复发患者的rCBF、rCBV、Ktrans、Ve及riAUC值均明显高于放射性脑损伤患者(P均<0.05);而Kep、Vp值在胶质瘤复发或放射性脑损伤患者差异无统计学意义(P=0.37、0.22)。Ktrans联合rCBV共同诊断,并、串联试验中鉴别诊断的敏感度分别为90.9%、72.7%;特异度分别为62.5%、100%。结论 DCE及DSC均可鉴别肿瘤复发或放射性脑损伤。Ktrans、riAUC及rCBV诊断效能略高于Ve及rCBF,联合应用rCBV及Ktrans可提高诊断正确率。
胶质瘤;复发;脑损伤;磁共振成像
高级别胶质瘤呈浸润性生长,易复发,目前的标准治疗方法是在保证颅脑功能正常情况下最大安全范围内切除肿块,并辅以术后放疗和/或同步化疗[1],但长期放化疗可导致大脑组织受损[2-3],需要扩张血管、应用激素等对症处理,常有较好的结局及生存期,若误诊为复发且采取手术治疗将给患者带来极大的伤害,因此,能否通过无创、简便的方法早期判断肿瘤强化灶的性质具有重要临床意义。本研究探讨动态磁敏感对比增强成像(dynamic susceptibility contrast perfusion MRI, DSC-MRI)联合动态对比增强磁共振成像(dynamic contrast-enhanced permeability MRI, DCE-MRI)鉴别诊断颅脑胶质瘤术后放化疗后强化病灶性质的临床价值。
1 资料与方法
1.1 一般资料 收集2014年9月—2016年3月在我院确诊为脑胶质瘤的患者19例,均于术后3周开始行放射治疗和/或替莫唑胺同步化疗。其中男11例、女8例,年龄34~66岁,平均(51.4±9.6)岁。WHO分级为Ⅲ级5例、Ⅲ~Ⅳ级3例、Ⅳ级11例。患者均于术后(2周内)、放化疗前(3周内)、放化疗后(1、3、6、12个月)定期行MR检查,根据二次手术病理或长期随访结果确定术后出现的异常强化灶的性质,分为术后复发组和放射性脑损伤组。
1.2 仪器与方法 采用Siemens Verio 3.0T超导型MR扫描仪,头颅8通道相控阵列线圈。先行常规MR平扫。DSC-MRI采用GRE-EPI序列,TR 2 800 ms,TE 20 ms,层厚3.6 mm,连续扫描30个期像,第6期相开始经肘静脉由高压注射器以3.5 ml/s的速度注入5 ml钆喷酸葡胺(Gd-DTPA),后立即以同样的速率注入10 ml生理盐水,总扫描时间约90 s。DCE-MRI采用三维容积式内插值法屏气检查(VIBE)序列,TR 3.87 ms,TE 1.36 ms,层厚3.6 mm,注射对比剂前扫描两组翻转角分别为2°、15°的图像,各得到1期图像;动态增强时翻转角为12°。扫描范围包括整个肿瘤及周围水肿区,连续扫描40个时相,第6个时相开始经肘静脉由高压注射器以2 ml/s的速度注入0.1 mmol/kg体质量Gd-DTPA,后立即以同样的速率注入相同剂量的生理盐水,总扫描时间约160 s。再行T1WI常规增强扫描。
1.3 图像分析 由2名高级职称放射科医师共同判定胶质瘤患者术后放化疗后出现异常强化灶的范围,并在与常规轴位增强显示强化范围最大层面相对应的灌注成像图像(DSC、DCE)上分别勾勒相应的ROI,建立所有ROI随时间变化的关系,ROI的平均面积为10 mm2,主要测量肿瘤实质内强化区域,避开血管、出血、囊变及坏死区域,每个ROI分别测量5次,取其平均值。DCE采用Kinetic Modeling-version 3.0渗透分析软件、Extend Tofts Model血流动力学模型,得到DCE参数值及对应的功能性伪彩图,DCE参数包括容积转运常数(volume transfer constant, Ktrans)、血管外细胞外间隙容积分数(volume fraction of extravascular extracellular space,Ve)、时间-信号强度曲线下面积(initial area under the signal intensity-time curve, riAUC)、速率常数(transfer constant from the extracellular extravascular space into the plasma, Kep)、血浆空间容积分数(blood plasma volume, Vp);DSC采用Siemens Perfusion软件在相应ROI得到相关参数值及对应的功能性伪彩图,DSC参数包括相对脑血容量 (relative cerebral blood volume, rCBV)、相对脑血流量(relative cerebral blood flow, rCBF)。
1.4 统计学分析 采用SPSS 17.0统计分析软件。对胶质瘤术后复发组和放射性脑损伤组异常强化区域的血流动力学参数差异的比较采用两独立样本t检验;采用ROC曲线评价各参数鉴别诊断的诊断效能,并应用串、并联试验探讨联合诊断的价值。P<0.05为差异有统计学意义。
2 结果
本研究患者均于临床长期随访(>12个月)或二次手术病理证实。8例经随访证实为放射性脑损伤(放射性脑损伤组),其中5例(图1)异常强化灶范围较前减小或消失,占位效应减轻,周围水肿明显减轻,头痛及神经功能障碍等临床症状逐渐好转,3例较前变化不大;11例为胶质瘤术后复发(术后复发组),其中2例经病理确诊,9例(图2)经临床长期随访证实,异常强化灶强化范围较前扩大,水肿程度较前扩大,占位效应及临床症状加重。
2.1DSC-MRI和DCE-MRI参数比较及ROC曲线分析 脑胶质瘤术后复发组患者DSC参数rCBV、rCBF明显高于放射性脑损伤组患者(P均<0.05)。以rCBV=2.31、rCBF=1.82为界值,诊断胶质瘤复发的敏感度分别为81.8%、72.7%;特异度分别为87.5%、87.5%;ROC曲线下面积分别为0.81(P=0.03),0.65(P=0.28)。胶质瘤复发患者DCE参数Ktrans、Ve明显高于放射性脑损伤患者(P均=0.02)。以Ktrans=1.47 min-1、Ve=0.97%为界值,诊断胶质
瘤复发的敏感度分别为81.8%、90.9%;特异度为75.0%、62.5%;ROC曲线下面积为0.83(P=0.02),0.80(P=0.03)。胶质瘤复发患者riAUC高于放射性脑损伤患者(P=0.01),以riAUC=0.43 mM/s为界值,诊断胶质瘤复发的敏感度为90.9%,特异度为75.0%,ROC曲线下面积为0.89(P=0.01)。而Kep、Vp在术后复发组与放射性脑损伤组的差异无统计学意义(P=0.37、0.22)。见表1、图3。
2.2 Ktrans联合rCBV诊断胶质瘤术后复发或放射性脑损伤效能分析 并联试验中,当Ktrans值>1.47 min-1或rCBV>2.31时,诊断胶质瘤复发的敏感度90.9%,特异度62.5%;串联试验中,当Ktrans值>1.47 min-1或rCBV>2.31时,诊断胶质瘤复发的敏感度72.7%,特异度100%。Ktrans联合rCBV共同诊断可提高鉴别诊断效能。

表1 放射性脑损伤组和术后复发组DSC和DCE相关血流动力学参数的比较±s)

图1 患者女,56岁,胶质母细胞瘤(WHO Ⅳ级),经随访证实为放射性脑损伤 A~B.放化疗后3.5个月T2WI、T1WI增强图像,左侧颞枕叶大片状长T1长T2信号,增强后边缘环状不规则强化,邻近脑膜强化明显; C~E.分别为DCE定量参数Ktrans、Ve、riAUC伪彩图,测值分别为Ktrans=1.19 min-1、Ve=0.33%、riAUC=0.12 mM/s; F~H.放化疗后6个月T2WI、FLAIR、T1WI增强图像,左侧颞叶大片状长T1长T2信号,增强后病变周围强化减弱,强化范围减小
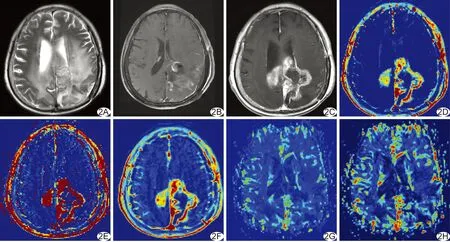
图2 患者女,41岁,胶质母细胞瘤(WHO Ⅳ级),经随访证实为胶质瘤复发 A.T2WI示左侧额顶颞叶、胼胝体压部见团片状混杂长T2信号,周围见大片状水肿; B.T1WI增强示术区残余灶的边缘线状不规则强化; C.T1WI增强示病灶呈不均匀花环状强化; D~F.分别为DCE定量参数Ktrans、Ve、riAUC伪彩图,测值分别为Ktrans=1.99 min-1、Ve=2.23%、riAUC=1.45 mM/s; G、H.分别为DSC半定量参数rCBV、rCBF伪彩图,测值分别为rCBV=3.79,rCBF=2.34

图3 rCBV、 rCBF、Ktrans、Ve、riAUC鉴别胶质瘤复发和放射性脑损伤的ROC曲线
3 讨论
胶质瘤患者术后脑部接受放疗和/或联合化疗后可出现如脑水肿、辐射性脑白质损伤、脱髓鞘改变等现象,包括假性进展和放射性坏死,常常出现在治疗结束后的3个月内,也可在放化疗后数月甚至数年后出现。随着新型化疗药物替莫唑胺在恶性胶质瘤患者中的应用,治疗后2年患者的生存期明显提高[4],但手术切除后标准的放疗联合替莫唑胺同步化疗引起脑损伤的发生率也显著增加。目前认为脑放射性坏死是由于放化疗等治疗因素或肿瘤细胞DNA破坏,血管内皮细胞死亡,局部炎症反应、水肿,血管反应性增生引起血脑屏障的通透性增强,其影像表现为原肿瘤或治疗区域强化范围扩大,但数月后强化区域可明显减小、消失或不变,引起的占位效应及临床症状也不显著。肿瘤复发是肿瘤细胞迅速增生,其分泌的血管内皮细胞生长因子促进血管增生,新生的血管内皮细胞通透性增加[5],影像表现为原肿瘤手术区域强化范围增加20%以上,常伴有结节状强化团块,周围水肿范围扩大,占位效应明显。放射性脑损伤与肿瘤复发的临床表现相似(均表现为神经功能障碍、头痛等症状),而常规的增强MR只能判定术区及肿瘤放射野有无水肿、血脑屏障有无损伤。
DSC是最常见的灌注成像方法,研究[6]认为DSC鉴别诊断胶质瘤复发或放射性脑损伤有重要价值。由于肿瘤复发时细胞代谢极度旺盛,刺激血管内皮生长因子的释放,血管数量快速增加,血管密度增加,而辐射所致脑组织的损伤无新生血管,常常导致血管内皮细胞受损或坏死、渗透性略增加,血流灌注较对侧减少,因此可以通过检测病侧血管内的血流量、血容量与正常脑组织的差异分析病变的性质。本研究中肿瘤复发的病变侧rCBV、rCBF高于放射性脑损伤,rCBF诊断效能低于rCBV,与Barajas等[7]研究结果大致相同,认为rCBV是诊断鉴别放疗后的高级别胶质瘤复发与放射性脑损伤的最重要参数。DSC是基于血脑屏障完整情况下的单室血流动力学模型,未考虑到高级别胶质瘤可能破坏血脑屏障导致部分对比剂渗漏到血管外,造成对rCBV、rCBF的低估,且对比剂和信号之间缺乏线性定量关系,采用的GER-EPI序列易受大血管与骨骼产生的磁敏感伪影影响,致位于颅底的病变显示欠佳。
DCE以双室血流动力学为模型[8],通过线性定量分析血管内皮细胞的渗透量,联合多个参数评估肿瘤微环境的变化,反映肿瘤新生不成熟血管的渗漏情况[9]。Ktrans是DCE中最重要的定量参数指标,与血管内皮细胞的数量、表面积、渗漏情况密切相关。riAUC是描绘对比剂进入血管及滞留在血管中组织信号强度随时间变化的半定量参数,可反映ROI的血容量。Ve是单位体积的血管外细胞外间隙,反映肿瘤细胞所占的比例。Bisdas等[10]以Ktrans值>0.19 min-1诊断肿瘤复发的敏感度为100%,特异度为83%,而riAUC>15.35 mM/s时,判定为复发的敏感度和特异度均为71%。本研究结果与前者大致相同,且Ktrans、riAUC的诊断效能差异不大,较Ve的诊断效能高,而Cha等[11]则认为Ve无法鉴别胶质瘤复发或放射性损伤(P>0.05)。本研究中Kep、Vp值鉴别胶质瘤复发与放射性脑损伤间差异无统计学意义,与Shin等[12]研究结果一致。
本研究患者均于术后2周内复查MR,术后3周接受放化疗,排除、避免术后残腔的炎性反应性强化影响对术区后续随访过程中增加的异常强化灶范围的判定。本研究通过对比两组灌注成像的时间-信号强度曲线及灌注成像相关的血流动力学参数,探讨并比较这两种无创性灌注成像在鉴别胶质瘤复发或放射性脑损伤的临床应用价值。以往有关研究[13-14]主要应用单一的新技术或联合DWI、DTI、核医学(如FDG-PET、MET-PET和99Tcm-Tetrofosmin SPECT)等,较少有联合两组灌注成像的研究。对比两组灌注成像参数与最终病理或随访结果显示,DSC及DCE均可用于鉴别胶质瘤复发或放射性损伤。单独诊断时的rCBV诊断效能略高于Ktrans,Ktrans联合rCBV共同诊断可提高鉴别诊断效能。DSC通过评价血管屏障未受损时肿瘤侧血管的rCBV、rCBF,而DCE则评估新生血管的渗透性,联合两种灌注成像技术可更全面的反映病变的血流性质。
本研究亦存在一定的局限性:①样本量较小,特别是放射性脑损伤患者;②后处理中人工勾画ROI未考虑到肿瘤异质性的差异产生的选择性偏倚;③并不是每一个病例都有病理诊断,部分病例只能通过随访证实;④DCE的血流动力学复杂、后处理模型类型较多且不统一,导致研究结果间可比性较差,诊断阈值无法准确界定。
总之,DCE及DSC均可鉴别肿瘤复发或放射性脑损伤。Ktrans、riAUC及rCBV诊断效能略高于Ve及rCBF,联合应用rCBV和Ktrans可提高诊断正确率。
[1] Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med, 2005,352(10):987-996.
[2] Mullins ME, Barest GD, Schaefer PW, et al. Radiation necrosis versus glioma recurrence: Conventional MR imaging clues to diagnosis. AJNR Am J Neuroradiol, 2005,26(8):1967-1972.
[3] Butowski NA, Sneed PK, Chang SM. Diagnosis and treatment of recurrent high-grade astrocytoma. J Clin Oncol, 2006,24(8):1273-1280.
[4] Matthias H, Grossman SA. Controversies in the adjuvant therapy of high-grade gliomas. Oncologist, 2011,16(3):351-358.
[5] Oh BC, Pagnini PG, Wang MY, et al. Stereotactic radiosurgery: Adjacent tissue injury and response after high-dose single fraction radiation: Part Ⅰ-Histology, imaging, and molecular events. Neurosurgery, 2007,60(1):31-44.
[6] Cha S, Lupo JM, Chen MH, et al. Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. AJNR Am J Neuroradiol, 2007,28(6):1078-1084.
[7] Barajas J, Chang JS, Segal MR, et al. Differentiation of recurrent glioblastoma multiforme from radiation necrosis after external beam radiation therapy with dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. Radiology, 2009,253(2):486-496.
[8] Zwick S, Brix G, Tofts PS, et al. Simulation-based comparison of two approaches frequently used for dynamic contrast-enhanced MRI. Eur Radiol, 2010,20(2):432-442.
[9] Jackson A, Haroon H, Zhu XP, et al. Breath-hold perfusion and permeability mapping of hepatic malignancies using magnetic resonance imaging and a first-pass leakage profile model. NMR Biomed, 2002,15(2):164-173.
[10] Bisdas S, Naegele T, Ritz R, et al. Distinguishing recurrent high-grade gliomas from radiation injury: A pilot study using dynamic contrast-enhanced MR imaging. Acad Radiol, 2011,18(5):575-583.
[11] Cha S, Yang L, Johnson G, et al. Comparison of microvascular permeability measurements, K(trans), determined with conventional steady-state T1-weighted and first-pass T2*-weighted MR imaging methods in gliomas and meningiomas. AJNR Am J Neuroradiol, 2006,27(2):409-417.
[12] Shin KE, Ahn KJ, Choi HS, et al. DCE and DSC MR perfusion imaging in the differentiation of recurrent tumour from treatment-related changes in patients with glioma. Clin Radiol, 2014,69(6):e264-e272.
[13] Caroline I, Rosenthal MA. Imaging modalities in high-grade gliomas: Pseudoprogression, recurrence, or necrosis? J Clin Neurosci, 2012,19(5):633-637.
[14] Kim YH, Oh SW, Lim YJ, et al. Differentiating radiation necrosis from tumor recurrence in high-grade gliomas: Assessing the efficacy of F-18-FDG PET, C-11-methionine PET and perfusion MRI. Clin Neurol Neurosurg, 2010,112(9):758-765.
DSC-MRI and DCE-MRI in differentiating recurrent tumour from radiation-induced brain injuries in patients with glioma
HULanhua1,YUTao2,XUTingting3,SONGJiazhe1,ZHANGYa1,FANGuoguang1*
(1.DepartmentofRadiology, 3.DepartmentofNeurology,theFirstHospitalofChinaMedicalUniversity,Shenyang110001,China; 2.DepartmentofRadiology,LiaoningCancerHospital,Shenyang110042,China)
Objective To explore the clinical significance of dynamic susceptibility contrast (DSC) perfusion MRI and dynamic contrast-enhanced (DCE) permeability MRI in distinguishing radiation-induced brain injuries from recurrence in glioma patients. Methods Nineteen pathologically diagnosed glioma patients were performed MR scanning with DSC and DCE after surgery, before and after synchronous chemoradiotherapy. Hemodynamic parameter value were got, and the perfusion imaging results and the final clinical diagnosis were contrasted. The differential diagnostic values of the perfusion parameters were analyzed statistically. Results Eleven cases were recurrent glioma, while 8 cases were radiation-related injuries. The values of recurrent pateints including relative cerebral blood volume (rCBV), relative cerebral blood flow (rCBF), volume transfer constant (Ktrans),volume fraction of extravascular extracellular space (Ve) and initial area under the signal intensity-time curve (riAUC) were significantly higher than those of radiation-induced brain injuries patients (allP<0.05). While there were no significantly statistical differences of transfer constant from the extracellular extravascular space into the plasma (Kep) and blood plasma volume (Vp) between glioma recurrence and radiation-induced injuries (P=0.37, 0.22). Combining the optimal parameters rCBV with Ktransin the differentiation diagnoses of the series and parallel tests, the sensitivity were 90.9%, 72.7%; while the specificity were 62.5%, 100% respectively. Conclusion Both DSC and DCE can distinguish glioma recurrence from radiation-induced brain injuries. The parameters Ktrans, riAUC and rCBV values seems to be slightly efficient in diagnosis than rCBF and Ve, while combined with Ktransand rCBV, the diagnostic accuracy may be improved.
Glioma; Recurrence; Brain injuries; Magnetic resonance imaging
辽宁省省直医院临床能力建设项目(LNCCC-B06-2014)。
胡兰花(1990—),女,湖南衡阳人,在读硕士。研究方向:中枢神经系统影像诊断。现工作于武汉大学人民医院放射科。
E-mail: hulanhua0520@sina.com
范国光,中国医科大学附属第一医院放射科,110001。E-mail: fanguog@vip.sina.com
2016-06-04
2016-11-04
R739.41; R445.2
A
1003-3289(2017)01-0011-06
10.13929/j.1003-3289.201606085
