缝隙连接蛋白26基因修饰对人高转移性肝癌细胞增殖和侵袭能力的影响
2017-02-14罗超元夏金堂姜海平
罗超元 夏金堂 姜海平
(暨南大学附属第一临床学院 华侨医院胃肠外科,广东 广州 510627)
缝隙连接蛋白26基因修饰对人高转移性肝癌细胞增殖和侵袭能力的影响
罗超元 夏金堂 姜海平
(暨南大学附属第一临床学院 华侨医院胃肠外科,广东 广州 510627)
目的 探讨缝隙连接蛋白(Cx)26基因对人高转移性肝癌细胞株(HCCLM3)细胞增殖和侵袭能力的影响。方法 采用慢病毒载体(LV)转染法将载体LV-Cx26转染高转移性HCCLM3细胞为研究组,仅转染空载体LV-NC-Cx26为对照组,未转染的HCCLM3细胞为空白组。RT-PCR和Western印迹测定转染后Cx26 mRNA和蛋白表达;划痕荷载染料传输实验检测细胞通讯功能;流式细胞术检测细胞周期并通过CCK-8增殖实验、Transwell细胞侵袭实验检测细胞增殖、侵袭能力。结果 研究组Cx26 mRNA和蛋白表达量均明显高于对照组和空白组(P<0.05)。研究组转染慢病毒载体LV-Cx26后的细胞通讯功能明显强于对照组、空白组,即划痕细胞中的荧光染料可传递到相邻的3~4列细胞。研究组G0/G1期细胞数明显多于对照组和空白组,S期细胞数明显少于对照组和空白组(P<0.05)。M期三组细胞数无统计学差异(P>0.05)。CCK-8法检测显示,72 h起研究组细胞增殖速度明显低于同期对照组和空白组(P<0.05);对照组和空白组各时间点细胞增殖情况无统计学差异(P>0.05)。Transwell细胞侵袭实验显示,研究组穿膜细胞数明显少于对照组和空白组(P<0.05)。结论 转染Cx26基因可有效抑制HCCLM3细胞的增殖和侵袭能力,降低恶性生物学特征,可成为晚期肝癌治疗的新思路。
缝隙连接蛋白26;肝癌细胞;增殖;侵袭
肝脏是终末期恶性肿瘤主要的转移器官,转移性肝癌具有恶性程度高、预后差的特点。近年研究发现,缝隙连接蛋白(Cx)可在胰腺癌、胃癌、结肠癌等多种肿瘤中异常表达,对癌症的发生、发展起到重要作用〔1〕。目前研究表明,在Cx家族中的Cx26异常表达可能与恶性肿瘤活性关系最大〔2〕。本次研究采用慢病毒载体(LV)转染法将载体LV-Cx26转染高转移性人肝癌细胞株(HCCLM3)细胞,探讨Cx26基因修饰对HCCLM3细胞增殖、侵袭能力的影响。
1 材料与方法
1.1 主要材料 HCCLM3细胞购于通派(上海)生物科技有限公司;噻唑蓝(DMEM)细胞培养基、胎牛血清、胰酶均购于上海碧云天生物技术有限公司;MTT、链霉素、青霉素均购于上海浩然生物技术有限公司;Cx26病毒载体购于长沙爱科博生物科技有限公司;RNA提取试剂盒Trizol、RT-PCR两步法试剂盒、cDNA合成试剂盒、DNA Marker均购于上海百研生物科技有限公司;PCR引物序列由上海生工生物工程技术服务有限公司化学合成;兔抗人Cx26多克隆抗体、辣根过氧化物酶(HRP)标记的羊抗兔二抗、鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体均购于美国Santa公司;Transwell小室、罗氏黄液、胆囊收缩素-8(CCK-8)均购于博通维德(北京)生物科技有限公司。
1.2 方法
1.2.1 Cx26基因修饰 用含10%胎牛血清的DMEM培养基常规培养HCCLM3细胞,置于CO2细胞培养箱中孵育,取对数生长期细胞用于实验,以2×103个/孔细胞浓度接种到6孔板中,观察细胞融合率>90%时,以慢病毒进行转染。本实验分为三组:转染慢病毒载体LV-Cx26为研究组,空载体LV-NC-Cx26为对照组,未转染的HCCLM3细胞为空白组。在转染后48 h后采用RT-PCR和Western印迹法分别测定Cx26 mRNA和蛋白表达情况。
1.2.2 划痕荷载染料传输实验 分别取三组细胞接种于培养皿中,置于显微镜下观察,当镜下发现细胞汇合度达到100%后弃去培养液,之后再用磷酸盐缓冲液(PBS)洗涤3次,每组标本加入1 ml 0.05%的罗氏黄液,用无菌手术刀片在汇合的细胞上轻划数条划痕,静置5 min,PBS洗去染液,荧光显微镜下观察、拍照,采用Image pro plus图像分析软件测定荧光强度。
1.2.3 流式细胞术检测 分别取三组细胞,消化离心后调整浓度为1×109/L,PBS预冷洗涤3次,70%冰乙醇沉淀细胞,4℃下保存备用,PBS洗涤细胞后调整浓度为1×109/L,与含50 mg/L RNA酶的Tris-HCl缓冲液共孵育40 min。加入10 μl磺化丙啶(PI)染色液,4℃避光反应30 min,1 h内放入流式细胞仪中检测。
1.2.4 CCK-8增殖实验 取指数生长期细胞,以4×103个/孔浓度接种在96孔细胞培养板,放入含10%胎牛血清的DMEM培养液150 μl,每组设置5个复孔,对照采用空白培养液孔。于每孔中加入配好的CCK-8 40 μl,放入CO2细胞培养箱中孵育6 h,放入酶标仪检测450 nm波长处吸光度值。
1.2.5 Transwell细胞侵袭实验 Matrigel胶与无血清DMEM培养基按1∶3比例配制基质胶,取20 μl涂于Transwell小室,孵育2 h,消化细胞,培养基重悬细胞,上室加入100 μl含5×108个细胞的悬液,下室加入500 μl含10%胎牛血清的DMEM培养液,孵育24 h,用无菌棉签擦去上室中的基质胶和残余细胞,光学显微镜下选取5个视野计数并拍照。
1.3 统计学方法 采用SPSS15.0软件进行t检验。
2 结 果
2.1 三组Cx26 mRNA的表达情况 研究组条带明显增宽,Cx26 mRNA表达量(1.063±0.129)明显高于对照组和空白组(0.618±0.065、0.602±0.041)(P<0.05)。见图1。
2.2 三组Cx26 蛋白在细胞中的表达情况 研究组Cx26 蛋白表达条带明显增宽,Cx26蛋白表达量(2.631±0.193)明显高于对照组和空白组(0.691±0.046、0.673±0.069;P<0.05)。见图2。
2.3 三组细胞间连接通讯变化情况 研究组转染LV-Cx26后的细胞通讯功能明显强于对照组、空白组,即划痕细胞中的荧光染料可传递到相邻的3~4列细胞。见图3。
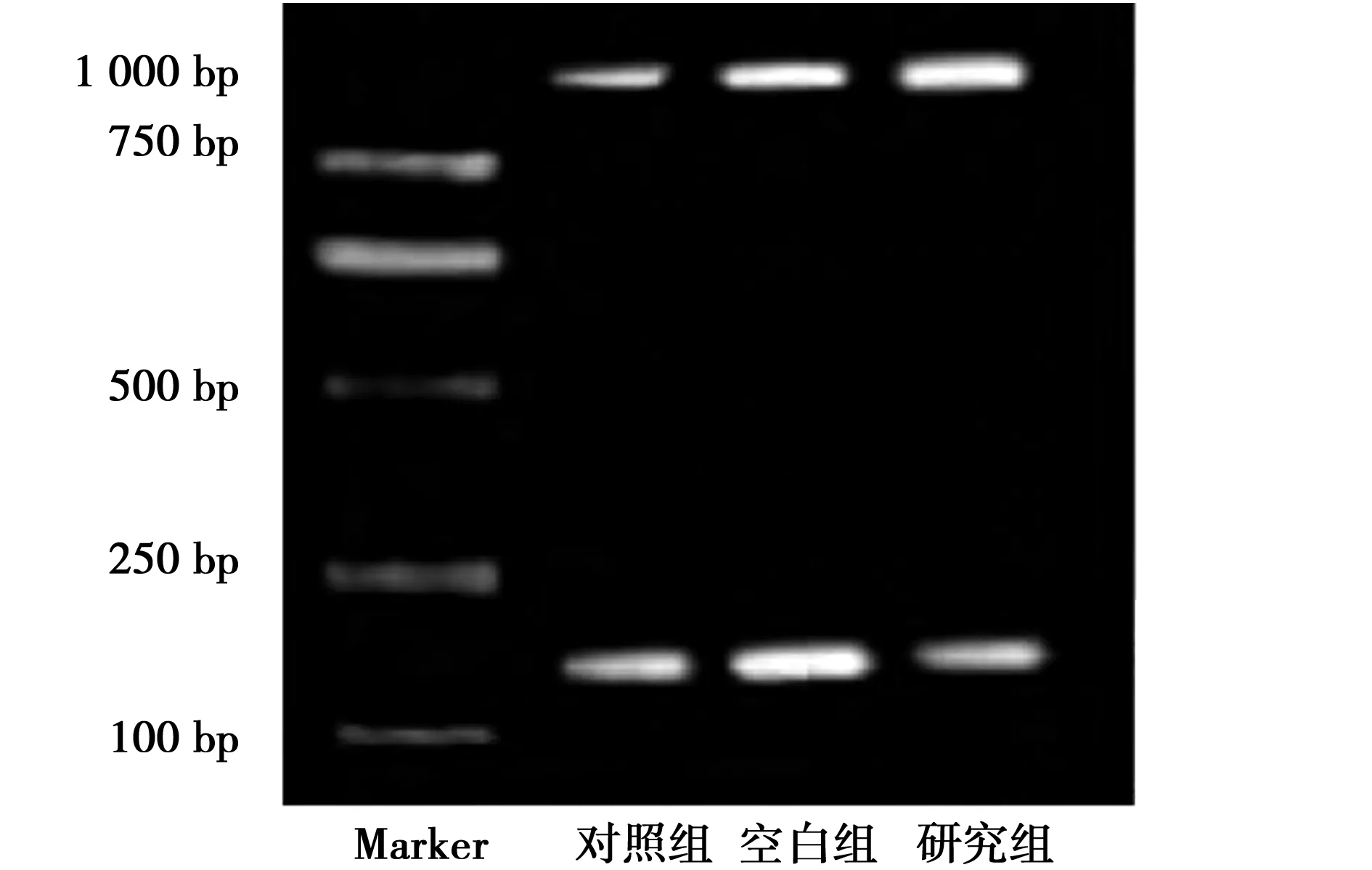
图1 RT-PCR检测三组肝癌HCCLM3细胞中Cx26 mRNA的表达

图2 Western印迹检测三组肝癌HCCLM3细胞中Cx26蛋白的表达

图3 三组肝癌HCCLM3细胞通讯功能情况(×400)
2.4 三组细胞周期检测情况比较 研究组G0/G1期细胞数明显多于对照组和空白组,S期细胞数明显少于对照组和空白组(P<0.05)。M期三组细胞数无统计学差异(P>0.05)。见表1。
2.5 三组细胞增殖情况比较 72 h起研究组细胞增殖速度明显低于同期对照组和空白组(P<0.05);对照组和空白组各时间点细胞增殖情况均无统计学差异(P>0.05)。见表2。
2.6 三组细胞体外侵袭力比较 研究组穿膜细胞数(46.72±5.96)明显少于对照组和空白组(76.36±5.36、77.85±5.69)(P<0.05),Cx26基因修饰可明显降低肝癌HCCLM3细胞的侵袭力。见图4。
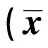
表1 Cx26基因修饰对肝癌HCCLM3细胞周期的影响±s)
与空白组和对照组比较:1)P<0.05;下表同
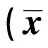
表2 各时间点三组细胞增殖情况比较±s)

图4 三组Transwell实验48 h后结果(×400)
3 讨 论
肝癌多发于50岁之后的中老年人群,临床恶性程度很高且预后极差。研究已发现,Cx在维持细胞内环境和细胞活动调控方面发挥重要作用〔3〕。在多数肿瘤进展中,常伴随Cx表达下降,恢复其表达水平有助于抑制肿瘤细胞生长、促进凋亡〔4〕。近年来研究发现,胰腺癌、胃癌、结肠癌等多种胃肠道肿瘤中恢复Cx32表达可有效降低病灶的转移和侵袭力〔5〕;肝癌细胞中,过表达Cx32可恢复细胞间隙功能并减弱其侵袭力〔6〕。可见Cx作为抑癌因素已得到广泛认可。
本研究提示Cx26基因修饰可有效降低高转移性肝癌组织的恶性生物学行为。但肿瘤的发病机制十分复杂且处于发展变化中,因此Cx在肿瘤不同阶段的作用可能存在差异。在肿瘤发展早期,Cx表达可能起到促进病情发展的作用,但在肿瘤晚期,恢复或出现Cx可能起到重要的肿瘤抑制因子作用。本次研究中选用的HCCLM3细胞属于晚期肝癌细胞,因此可认为Cx基因修饰是抑制晚期肝癌病情进展的一个有效手段。
综上所述,Cx26基因表达减少或缺失导致的间隙连接功能丧失在促进肿瘤细胞增殖方面发挥明显作用,同时可影响HCCLM3细胞的迁移和侵袭能力。通过LV-Cx26转染HCCLM3细胞可有效降低其恶性生物学行为,为晚期肝癌的治疗提供了新的思路。
1 夏照明.间隙连接蛋白26、32、43在原发性肾上腺肿瘤的表达及其临床意义〔D〕.广州:南方医科大学,2012.
2 张吉林,常哲兴,宋 宇,等.肿瘤患者外周血CD4+和CD8+T淋巴细胞TCR Vβ基因克隆化分析〔J〕.北华大学学报(自然科学版),2015;16(5):593-6.
3 Drygin D,Lin A,Bliesath J,etal.Targeting RNA polymerase I with an oral small molecule CX-5461 inhibits ribosomal RNA synthesis and solid tumor growth.〔J〕.Cancer Res,2011;71(4):1418-30.
4 韩 涛.Shp2调控肝癌进展的信号网络及临床意义研究〔D〕.上海:第二军医大学,2013.
5 Watanabe E,Buchman TG,Hirasawa H.Association between lymphotoxin-α(tumor necrosis factor-β) intron polymorphism and predisposition to severe sepsis is modified by gender and age〔J〕.Crit Care Med,2010;38(1):181-93.
6 Zhang J,Grindstaff RD,Thai SFetal.Chloral hydrate decreases gap junction communication in rat liver epithelial cells〔J〕.Cell Biol Toxic,2011;27(3):207-16.
〔2016-10-22修回〕
(编辑 袁左鸣/滕欣航)
广东省科学技术厅计划项目(No.2016ZC0142)
姜海平(1960-),男,博士,教授,主任医师,主要从事普通外科研究。
罗超元(1973-),男,硕士,副主任医师,主要从事普通外科研究。
R73
A
1005-9202(2017)02-0284-03;
10.3969/j.issn.1005-9202.2017.02.011
