宫颈癌术后限定骨盆骨髓剂量调强放疗的剂量学
2017-02-13毛铁铸孙小梅付学奇王国庆刘晓岚
厉 超 毛铁铸 孙小梅 付学奇 王国庆 胡 娜 刘晓岚
(吉林大学第二医院肿瘤中心放疗科,吉林 长春 130041)
宫颈癌术后限定骨盆骨髓剂量调强放疗的剂量学
厉 超 毛铁铸 孙小梅 付学奇1王国庆2胡 娜 刘晓岚
(吉林大学第二医院肿瘤中心放疗科,吉林 长春 130041)
目的 探讨宫颈癌术后调强放疗中,限定与非限定骨盆骨髓剂量在靶区剂量学及危及器官保护的差异。方法 8例宫颈癌术后放疗患者分别根据靶区勾画要求勾画临床靶区(CTV)及危及器官,观察组在放疗计划设计时按要求限制骨盆骨髓受照剂量和体积;对照组不予以限制骨盆骨髓受照剂量和体积,并对此8例患者进行自身剂量学比较。结果 BMS-IMRT分别减少了对骨盆10 Gy、20 Gy、30 Gy、40 Gy剂量的照射体积,具有统计学意义(P<0.05)。BMS-IMRT和IMRT两种治疗计划中肿瘤靶区覆盖率、膀胱V40、V50及直肠V40、V50、Dmean的值均相近(P>0.05)。结论 与IMRT相比,BMS-IMRT减少了对骨盆的照射剂量,且不增加肿瘤靶区覆盖率及直肠、膀胱等危及器官的照射剂量。
宫颈癌;调强放疗;骨髓保护
宫颈癌是女性生殖系统常见的恶性肿瘤之一,宫颈癌术后具有高危因素的患者行术后辅助放疗可延长无进展生存期和总生存期〔1〕。同步放化疗可以增加血液毒性,尤其是白细胞和中性粒细胞减少〔2,3〕。本课题通过骨盆骨髓剂量-体积限定,以减少放疗过程中对骨髓的照射剂量,以期达到降低血液学毒性发生的概率。
1 资料与方法
1.1 入组条件 ①经病理学确诊的宫颈癌术后患者,有放射治疗适应证。②体力状况ECOG评分0~2分。③血常规、肝肾功能正常。④放疗取得病人及家属知情同意。
1.2 临床资料 8例符合上述条件的宫颈癌患者,年龄51~53岁,中位年龄52岁。均经病理学检查确诊为鳞癌或腺癌,ECOG评分0~2分,无放疗禁忌证。对这8例患者分别设定两种放疗计划,A组不限制盆骨骨髓的剂量-体积,制定最优计划。B组限制盆骨骨髓的剂量-体积,制定最优计划。两组患者一般资料比较无统计学意义(P>0.05),具有可比性。
1.3 治疗方法 所有患者采用仰卧位体膜固定体位,行增强CT模拟定位,层厚0.3 cm。在每层面上勾画靶区和危险器官。根据ICRU 62号报告勾画靶区,临床靶体积(CTV)包括阴道残端、部分阴道及盆腔淋巴结引流区(部分髂总、髂外、髂内、宫旁、闭孔、骶前)。CTV各方向外放7 mm为计划靶体积(PTV)。同时,勾画小肠、直肠、膀胱、股骨头、盆骨等危及器官。勾画所有的骨盆骨包括髋骨、第5腰椎和骶椎。膀胱充盈度未作特殊要求,包括全部的膀胱壁及其内容物。小肠仅勾画环行小肠,不包括腹膜腔。直肠定义为从肛门口至直肠乙状结肠交界处的直肠壁及其内容物。设计治疗计划:在VARIAN治疗计划系统上进行计划设计与优化。两种计划均采用6 MVX射线,处方剂量为PTV 50.4 Gy/28 F,将剂量归一在95%PTV接受处方剂量,避免热点出现在危险器官内。盆腔内危及器官的剂量、体积限制:直肠V40<40%,膀胱V40<30%,小肠V30<40%,脊髓Dmax<40 Gy。
1.4 统计方法 采用SPSS19.0软件行t检验。
2 结 果
分别对8位患者制定BMS-IMRT和IMRT两种最优治疗计划,通过对DVH图统计分析可以看出,(1)肿瘤靶区覆盖率在BMS-IMRT和IMRT两种治疗计划中V95、V100、V110照射体积均无明显差别,见表1。BMS-IMRT分别减少了对骨盆10 Gy、20 Gy、30 Gy和40 Gy剂量的照射体积,见表2,更好地保护了骨髓(P<0.05)。(2)BMS-IMRT和IMRT两种治疗计划中膀胱V40、V50及直肠V40、V50、Dmean值均相近,均无统计学意义,见表3。

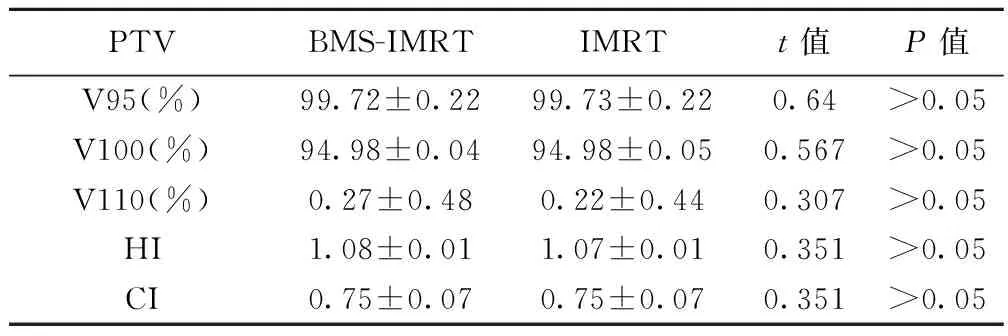
PTVBMS-IMRTIMRTt值P值V95(%)99.72±0.2299.73±0.220.64>0.05V100(%)94.98±0.0494.98±0.050.567>0.05V110(%)0.27±0.480.22±0.440.307>0.05HI1.08±0.011.07±0.010.351>0.05CI0.75±0.070.75±0.070.351>0.05
V95为95%处方剂量覆盖体积占总体积的百分比,V100等类推

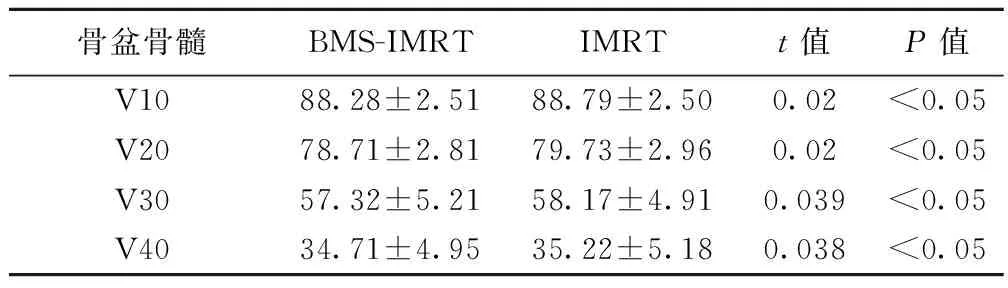
骨盆骨髓BMS-IMRTIMRTt值P值V1088.28±2.5188.79±2.500.02<0.05V2078.71±2.8179.73±2.960.02<0.05V3057.32±5.2158.17±4.910.039<0.05V4034.71±4.9535.22±5.180.038<0.05
V10为接受剂量了10 Gy时覆盖体积占总体积的百分比,V20等类推

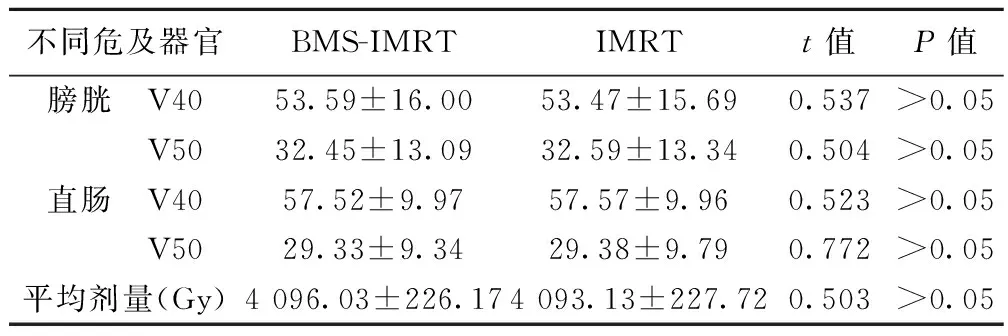
不同危及器官BMS-IMRTIMRTt值P值膀胱 V4053.59±16.0053.47±15.690.537>0.05 V5032.45±13.0932.59±13.340.504>0.05直肠 V4057.52±9.9757.57±9.960.523>0.05 V5029.33±9.3429.38±9.790.772>0.05平均剂量(Gy)4096.03±226.174093.13±227.720.503>0.05
3 讨 论
射线损伤造血细胞的一个重要途径是诱导细胞凋亡,射线对处于细胞周期内的造血细胞杀伤较为严重,而对于成熟血细胞的直接杀伤效应并不十分明显。但是机体受到照射以后,造血干细胞、祖细胞以及幼稚造血细胞数量急剧减少,增值功能降低或丧失,从而导致外周血中成熟血细胞数量下降。盆腔骨髓是人体主要造血点之一,正常人体内超过1/2骨髓位于髂骨、骶骨、股骨近端及低位腰椎〔4〕,因此,在宫颈癌的放射治疗中如何保护好盆腔骨髓对减轻血液学毒性至关重要。Albuquerque 等〔5〕对40例行同步放化疗的宫颈癌患者血液学毒性的潜在预测因素进行多元 Logistic 回归分析发现,骨髓的 V20 为2级以上骨髓抑制的独立预测因子(r=0.8,P<0.000 1),如果盆腔骨髓 V20>80%者2级以上骨髓抑制发生的风险增加4.5倍。Mell等〔6〕对37例行BMS-IMRT同期顺铂单药周疗方案(每周40 mg/m2)的宫颈癌患者的骨盆骨髓进行了研究发现V10>90%时,2级血液毒性发生率较V10<90%时增加了6倍;Rose等〔7〕也对44名行同步放化疗的宫颈癌患者进行了回顾性分析发现V20>75%时,Ⅲ级以上血液毒性发生率增加近2.5倍。
虽然对盆腔骨髓进行剂量体积限定可以减轻血液毒性,但如何在不影响靶区及其他危及器官的基础上,更好的保护盆腔骨髓呢?Hui 等〔8〕收集了20例行同步放化疗的宫颈癌患者,化疗方案相同,放疗分别采用IMRT或3D-CRT两种治疗方案治疗,结果分析发现IMRT较3D-CRT明显减少了V30、V40和V50等骨盆高剂量照射的体积,并且可以明显减少2度以上血液学毒性发生的概率。Mell等〔9〕收集了7例宫颈癌患者,分别设计了BMS-IMRT、box 四野、前后两野对穿3种治疗计划,并进行自身剂量学比较,发现调强放疗计划较 box 四野及前后两野对穿明显减少骨髓照射剂量及体积。由此可见,随着放疗技术的不断进步,对于骨盆骨髓的保护得到了进一步提高,如果在调强放疗的基础上进行盆腔骨髓剂量体积限定,是否可以在不牺牲肿瘤靶区覆盖率和直肠、膀胱等传统危及器官保护的前提下,明显的降低骨盆的照射剂量?基于以上问题,我们进行了本次研究。
本研究结果发现,在调强放疗中对骨盆骨髓进行剂量限定可以更好地保护骨髓。但此剂量学的优势会产生怎样的临床优势,有待进一步研究。Murakami等〔10〕对已既受过IMRT的10名术后宫颈癌患者制订了BMS-IMRT治疗计划,并分别进行了自身剂量学比较,发现BMS-IMRT降低了PTV的D95%及D97%照射剂量,但小于3%,差别无统计学意义。在直肠Dmean、V30、V50,膀胱V45、V50,及骨盆V10、V30、V40中的统计结果与本文结果相似。若在制定治疗计划时,继续增加骨盆骨髓的权重,虽然可以减少骨盆骨髓的照射剂量,但必将增加对其他危及器官的照射体积,所以临床医师在制定放疗计划上,要综合考虑患者病情,老年患者或对放化疗的血液毒性敏感的患者,建议对骨盆骨髓的剂量进行限定。
但目前依然面临许多问题,首先,每位患者的肿瘤部位、身体解剖结构等不同,而骨盆的体积相对较大,放疗时对骨盆骨髓的照射体积差别很大,所以对于骨髓体积的限定,很难达到一个统一标准。其次,目前大多数学者勾画骨盆骨髓时均是以全部盆骨代替骨髓,但盆骨包含大量高密度骨皮质,不能完全代替真正具有造血功能的骨髓。Krishnatry等〔11〕认为仅勾画骨盆骨髓腔比全部盆骨更能代表造血骨髓。 Liang等〔12〕在盆腔肿瘤中证实18F-FLT-PET 能很好地识别出功能骨髓进行保护,以此为基础进行调强骨髓保护安全可行。但18F-FDG-PET-CT 定义功能骨髓其最佳 SUV 阈值目前仍然未知。
1 温宏武,黄卫平,刘桐宇,等.不同辅助治疗方法对Ⅰb~Ⅱa期子宫颈癌术后有危险因素患者预后的影响〔J〕.中华妇产科杂志,2013;48(12):920-4.
2 Erpolat OP,Alco G,Caglar HB,etal.Comparison of hematologic toxicity between 3DCRT and IMRT planning in cervical cancer patients after concurrent chemoradiotherapy:a national multi-center study〔J〕.Eur J Gynaecol Oncol,2014;35(1):62-6.
3 Torres MA,Anuja J,Thames HD,etal.Comparison of treatment tolerance and outcomes in patients with cervical cancer treated with concurrent chemoradiotherapy in a prospective randomized trial or with standard treatment〔J〕.Int J Radiat Oncol,2008;70(1):118-25.
4 Hayman JA,Callahan JW,Herschtal A,etal.Distribution of proliferating bone marrow in adult cancer patients determined using FLT-PET imaging〔J〕.Int J Radiat Oncol Biol Phys,2011;79(3):847-52.
5 Albuquerque K,Giangreco D,Morrison C,etal.Radiation-related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow-sparing pelvic IMRT〔J〕.Int J Radiat Oncol Biol Phy,2011;79(4):1043-7.
6 Mell LK,Kochanski JD,Roeske JC,etal.Dosimetric predictors of acute hematologic toxicity in cervical cancer patients treated with concurrent cisplatin and intensity-modulated pelvic radiotherapy〔J〕.Int J Radiat Oncol Biol Phy,2006;66(5):1356-65.
7 Rose BS,Bulent A,Yun L,etal.Normal tissue complication probability modeling of acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy〔J〕.Int J Radiat Oncol,Biol,Phy,2011;79(3):800-7.
8 Hui B,Zhang Y,Shi F,etal.Association between bone marrow dosimetric parameters and acute hematologic toxicity in cervical cancer patients undergoing concurrent chemoradiotherapy〔J〕.Int J Gynecol Cancer,2014;24(9):1648-52.
9 Mell LK,Tiryaki H,Ahn KH,etal.Dosimetric comparison of bone marrow-sparing intensity-modulated radiotherapy versus conventional techniques for treatment of cervical cancer〔J〕.Int J Radiat Oncol Phys,2008;71(5):1504-10.
10 Murakami N,Okamoto H,Kasamatsu T,etal.A dosimetric analysis of intensity-modulated radiation therapy with bone marrow sparing for cervical cancer〔J〕.Anticancer Res,2014;34(9):5091-8.
11 Krishnatry R,Mahantshetty UM,Chaudhri S,etal.Comparison of 2 Contouring methods of bone marrow on CT and correlation with hematological toxicities(HT)in non-bone marrow sparing pelvic IMRT(NBM-IMRT)with concurrent cisplatin for cervical cancer〔J〕.Int J Gynecol Cancer,2012;22(8):1427-34.
12 Liang Y,Bydder M,Yashar CM,etal.Prospective study of functional bone marrow-sparing intensity modulated radiation therapy with concurrent chemotherapy for pelvic malignancies〔J〕.Int J Radiat Oncol Biol Phy,2013;85(2):406-14.
〔2015-11-19修回〕
(编辑 李相军)
国家自然科学基金资助(81320108)
刘晓岚(1962-),女,主任医师,教授,硕士生导师,主要从事肿瘤的精确放疗研究。
厉 超(1988-),男,在读硕士,主要从事恶性肿瘤的放射治疗研究。
R737.33
A
1005-9202(2017)01-0117-03;
10.3969/j.issn.1005-9202.2017.01.051
1 吉林大学生命科学学院 2 吉林大学基础医学院
