顺铂腹腔热灌注化疗对胃癌患者术后免疫功能和预后的影响
2017-02-13王启船屈中玉陶海云万里新
王启船 屈中玉 张 辉 陶海云 刘 越 李 果 万里新
(南阳市中心医院肿瘤内科一病区,河南 南阳 473009)
顺铂腹腔热灌注化疗对胃癌患者术后免疫功能和预后的影响
王启船 屈中玉 张 辉 陶海云 刘 越 李 果 万里新
(南阳市中心医院肿瘤内科一病区,河南 南阳 473009)
目的 探讨顺铂腹腔热灌注化疗(HIPC)对胃癌患者术后免疫功能和预后的影响。方法 胃癌手术患者90例按随机数字表法分为对照组和观察组,每组45例,两组均接受胃癌根治术和静脉化疗方案,观察组在此基础上给予HIPC。治疗完成后,随访调查患者生存质量、化疗疗效、化疗毒副作用发生情况和T细胞亚群改变情况。结果 观察组治疗后CD3+、CD4+和CD4+/CD8+比值均显著升高(P<0.05),而CD8+显著低于治疗前(P<0.05),对照组治疗前后差异无统计学意义(P>0.05);观察组治疗后生存质量和疗效显著优于对照组(P<0.05);两组化疗毒副作用发生率差异无统计学意义(P>0.05)。结论 HIPC较传统化疗疗效更佳,可以提高患者生存质量,改善患者免疫功能,但其毒副作用暂时未发现,有待延长随访时间和扩大样本量做进一步研究。
胃癌;顺铂;腹腔热灌注;免疫功能
全球范围内胃癌是高发的恶性肿瘤,根据2012年世界卫生组织(WHO)/国际癌症研究中心(IARC)公布的数据显示全球胃癌新发病例95.2万,其中中国40.5万,占42.6%,同年全球因胃癌死亡72.3万(10.2/10万),其中我国32.5万(21.9/20万),是世界平均水平的2倍多〔1〕。胃癌治疗以手术、放疗和化疗为主,随着治疗技术的不断提高,已发展为辅以免疫疗法和中药疗法的综合疗法,短期内确实有显著疗效,但是患者的5年生存率始终未有较大提高〔2〕。腹腔热灌注化疗(HIPC)方法最早见于1980年Spratt等〔3〕的报道,经过30多年的发展,HIPC发生了4次技术变革〔4〕,HIPC的疗效得到众多研究机构和临床医院的证实,目前在欧美发达国家已将其作为预防和治疗胃癌腹腔种植转移的标准方法〔5〕。我国仅少数大型医疗机构开展HIPC。本研究旨在探讨顺铂HIPC治疗对胃癌患者术后免疫功能和疾病预后的影响。
1 资料与方法
1.1 临床资料 2013年12月至2014年12月我院胃癌手术患者90例,其中男51例,女39例,平均年龄(64.61±8.62)岁,术后经病理切片再次证实为胃癌,并对癌组织进行分期和分型。纳入标准:①术前经胃镜和病理检查确诊为胃癌,依据TNM肿瘤分期法〔6〕分期在Ⅱ期及以上;②术前检查确证无手术禁忌,且本人自愿选择手术治疗,手术术式均为胃癌根治术;③患者为首次诊断为胃癌,术前未进行过化疗和放疗;④患者无化疗禁忌证,并且自愿选择接受化疗;⑤患者及家属知情同意。排除标准:①免疫系统功能缺陷或功能障碍;②手术近期患有严重感染性疾病;③严重的肝肾并发症,合并其他肿瘤;④治疗过程中患者不能耐受而更换疗法。按随机数字表法分为对照组和观察组各45例。对照组男26例,女19例,平均年龄(63.56±8.27)岁,腺癌35例、低分化或未分化癌10例;Ⅱ、Ⅲ、Ⅳ期分别为10、24、11例。观察组男25例,女20例,平均年龄(65.28±8.37)岁,腺癌33例、低分化或未分化癌12例;Ⅱ、Ⅲ、Ⅳ期分别为12、22、11例。两组年龄、性别、病理类型和分期差异无统计学意义,具有可比性。
1.2 药物与仪器选择 注射用顺铂(规格:10 mg/支,批准文号:国药准字H20073652)和注射用奥沙利铂(规格:0.1 g/支,批准文号:国药准字H20093168)均购自齐鲁制药(海南)有限公司,注射用5氟尿嘧啶(规格0.125 g/支,批准文号:国药准字H20050465)购自福森尤斯卡比(武汉)医药有限公司,注射用亚叶酸钙(规格:0.1 g/支,批准文号:国药准字H20044412)购自重庆药友制药有限公司,CD3-PE-CY5标记抗体、CD4-FITC标记抗体、CD8-PE标记抗体均及红细胞裂解液购自北京碧云天生物技术有限公司,磷酸盐缓冲液(PBS)购自美国HYCLONE公司。热化疗灌注机及配套一次性医用循环通道均购自哈尔滨宇航科技开发有限公司,超低温冰箱购自青岛海尔集团,流式细胞仪购自美国BD公司。
1.3 治疗方案 ①静脉化疗:两组采用同样的静脉化疗方案,术后2 w开始接受静脉化疗,方案为:第1天奥沙利铂200 mg,第1~5天5氟尿嘧啶0.5 g/d加亚叶酸钙0.3 g/d,5 d一个疗程,2个疗程中间隔4 w,共治疗6个疗程。②HIPC:观察组胃癌根治术结束后,关闭腹腔前,留置灌注管于腹腔左右两侧,视患者恢复情况,在术后第1~2天实施HIPC。灌注开始前清理留置灌注管内的组织和血块,用生理盐水清洗管道,连接仪器,开启热灌注化疗机,将化疗液(含50 mg顺铂的生理盐水)3 000 ml加热至38℃后,以100 ml/min的流速开始灌注,依据患者耐受情况和生命指标继续加热至43℃,并逐渐提高灌注流速(<300 ml/min),维持灌注60~90 min,调节仪器使腹腔内的化疗液维持在2 000 ml以上,在治疗过程中可以给予患者镇痛和解痉处理。治疗结束后,留置1 000 ml左右的化疗液在腹腔内,外接引流袋于灌注管上,使化疗液缓慢流出,7 d后取出灌注管。两组手术结束后,观察组灌注开始前,抽取外周血5 ml;两组静脉化疗完成后,再次抽取外周血5 ml,血液标本注入乙二胺四乙酸(EDTA)抗凝管中,加入相应标记抗体和红细胞裂解液后,使用流式细胞仪分析T细胞亚群。
1.4 观察指标 治疗开始前对所有患者的生存质量进行评估。生存质量依据卡氏评分〔7〕(KPS)标准,在治疗结束2个月后进行回访,统计不良反应和并发症发生情况;依据WHO制定的化疗毒性反应标准〔7〕,同时再次评估KPS。生存情况评价:KPS提高10分为提高,减少10分为降低,变化在10分内为稳定。总有效率=(KPS提高的患者数+KPS稳定的患者数)/总患者数×100%。回访时依据实体瘤评价体系〔8〕评价疗效:①完全缓解(CR):病灶完全消失,肿瘤标志物正常,维持4 w以上;②部分缓解(PR):病灶直径减少≥30%,维持4 w以上;③稳定(SD):病灶直径有缩小但未达PR,或有增加但未达PD;④疾病进展(PD):病灶直径增加≥20%,绝对值增加≥5 cm或出现新病灶。治疗总有效率=(CR+PR)/总例数×100%。
1.5 统计学方法 采用SPSS16.0统计软件进行t、χ2检验。
2 结 果
2.1 两组疗效比较 对照组总有效率(22.22%,PR 10例,SD 11例,PD 24例)明显低于观察组(51.11%,PR 23例,SD 15例,PD 7例)(P<0.05)。
2.2 两组治疗前后免疫功能变化 治疗前,两组CD3+、CD4+、CD8+及CD4+/CD8+比值差异均无显著差异(P>0.05);治疗后,对照组各指标差异无显著变化(均P>0.05),观察组CD3+、CD4+及CD4+/CD8+比值均显著高于治疗前及对照组(P<0.05),而CD8+显著低于治疗前及对照组(P<0.05),见表1。
2.3 两组KPS评分结果比较 治疗后,对照组KPS评分升高29例,稳定11例,下降5例,总有效率88.89%,观察组升高12例,稳定18例,下降15例,总有效率66.67%,观察组总有效率显著高于对照组(P<0.05)。

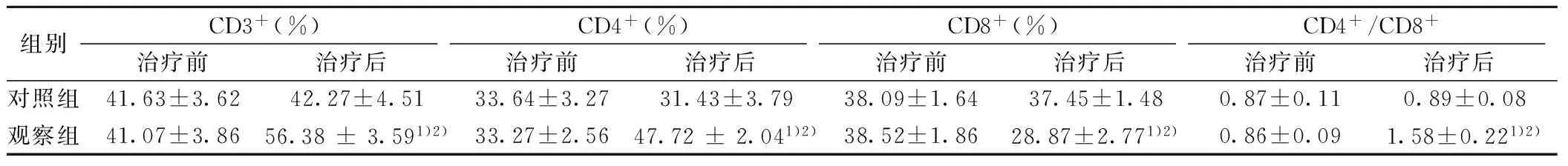
组别CD3+(%)治疗前治疗后CD4+(%)治疗前治疗后CD8+(%)治疗前治疗后CD4+/CD8+治疗前治疗后对照组41.63±3.6242.27±4.5133.64±3.2731.43±3.7938.09±1.6437.45±1.480.87±0.110.89±0.08观察组41.07±3.8656.38±3.591)2)33.27±2.5647.72±2.041)2)38.52±1.8628.87±2.771)2)0.86±0.091.58±0.221)2)
与治疗前比较:1)P<0.05;与对照组比较:2)P<0.05
2.4 两组治疗后毒副作用比较 治疗后,两组均有骨髓抑制和呕吐,并且观察组多于对照组,但两组差异不明显(P>0.05),见表2。
表2 两组治疗后毒副作用比较(n,n=45)
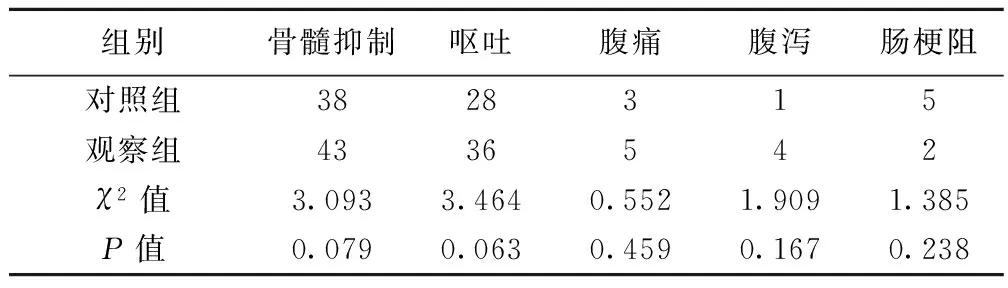
组别骨髓抑制呕吐腹痛腹泻肠梗阻对照组3828315观察组4336542χ2值3.0933.4640.5521.9091.385P值0.0790.0630.4590.1670.238
3 讨 论
我国2000年以前的全国死因回顾性调查显示胃癌均为肿瘤死因首位,2004年后胃癌死亡率下降,居于第3位,仅次于肺癌和肝癌〔8〕。近年来的调查显示,胃癌发病率和死亡率都在下降,但是不可否认的是每年仍有近1/4的恶性肿瘤死亡病例是由胃癌导致〔9〕。目前胃癌的主要治疗方法仍是手术,国外外科手术广泛认可的是胃癌组织周围≥4 cm完全切除,但我国推荐胃癌组织周围≥5 cm完全切除,此外,医学界对于术式的选择和淋巴清扫范围的选择也仍有争议〔10〕。胃癌患者接受手术后还必须接受化疗,主要化疗药物包括奥沙利铂、5氟尿嘧啶及其衍生物等〔11〕。胃肠道恶性肿瘤在浸润至浆膜层后,极容易发生腹腔种植转移,转移途径包括突破浆膜的癌细胞自行脱落后形成的转移灶和手术切除过程中掉落的癌细胞和微小癌灶,腹腔内的种植转移由于癌灶微小、数量多,难以逐一彻底清除,导致胃癌患者远期预后不良,生存质量下降〔12〕。热疗是针对癌组织的古老治疗方案,许多组织对热敏感,热疗能使局部发生酸中毒、营养不良、缺氧等,抑制癌细胞的生长〔13〕。研究证实,正常组织对温度的耐受极限在45.7℃~47℃,可存活1 h,癌组织的耐受极限在40℃~43℃。此外,也有研究发现顺铂在42℃~43℃时对癌细胞的敏感性相比37℃提高5~6倍〔14〕,因此,热疗搭配化疗药物的HIPC,既能通过温度本身的杀伤作用杀灭癌细胞,也能够通过化疗药物的化学杀伤作用直接杀灭癌细胞,产生协同作用。与传统血液吸收药物相比,腹腔灌注化疗药物能够使药物直达腹腔内的病灶,腹腔内的药物浓度能够达到血液中药物浓度的上百倍,最大程度杀灭腹腔内的肿瘤细胞和微小肿瘤灶〔15〕。另外,腹腔内的化疗药物经门静脉吸收后,大量进入肝脏,形成高血药浓度,抑制肝转移的癌细胞〔16〕。①温度增加能够提高肿瘤细胞的抗原性,激活免疫功能,促进细胞免疫应答〔17〕;②热疗能够增加癌组织血管内自然杀伤细胞等免疫细胞的浸润,提示热疗或能够提高免疫功能〔18〕;③细胞受热时会启动热休克蛋白基因,合成热休克蛋白,表明热休克蛋白能够特异性地参与肿瘤免疫过程,提升肿瘤抗原活性〔17〕。
1 Izuishi K,Mori H.Recent strategies for treating stage Ⅳ gastric cancer:roles of palliative gastrectomy,chemotherapy,and radiotherapy〔J〕.J Gastrointest Liver Dis,2016;25(1):87-94.
2 陈明明,植华德,潘俊文,等.紫杉醇联合顺铂和氟尿嘧啶治疗进展期胃癌的疗效观察〔J〕.现代生物医学进展,2014;14(19):3744-6,3750.
3 Spratt JS,Adcock RA,Muskovin M,etal.Clinical delivery system for intraperitoneal hyperthermic chemotherapy〔J〕.Cancer Res,1980;40(2):256-60.
4 Lu C,Li L,Luo Z,etal.Clinical efficacy of type-B ultrasound-guided intraperitoneal hyperthermic chemoperfusion combined with systemic chemotherapy in advanced gastric cancer patients with malignant ascites〔J〕.Neoplasma,2016;63(2):299-303.
5 韩东月,张丽红,战丽丽,等.紫杉醇联合顺铂腹腔热灌注化疗治疗胃癌的护理研究〔J〕.临床合理用药杂志,2014;7(9):160-1.
6 毛春玲.顺铂腹腔热灌注联合紫杉醇静脉输注并配合腹部热疗治疗进展期卵巢癌的临床护理观察〔J〕.中国医药指南,2015;13(31):211-2.
7 Feingold PL,Kwong ML,Sabesan A,etal.Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for gastric cancer and other less common disease histologies:is it time〔J〕?J Gastrointest Oncol,2016;7(1):87-98.
8 廖国清,曲怡梅,王红梅,等.循环热灌注化疗治疗晚期胃癌合并腹腔积液的临床研究〔J〕.中国肿瘤临床,2012;39(8):452-4.
9 姚路斌,洪 波.进展期胃癌术后早期循环式腹腔热灌注化疗联合全身化疗的疗效〔J〕.中国现代医学杂志,2015;25(31):58-61.
10 薛清萍.腹腔灌注化疗联合热疗对晚期胃肠道肿瘤的临床观察〔J〕.中国继续医学教育,2015;7(33):155-6.
11 Lotti M,Capponi MG,Piazzalunga D,etal.Laparoscopic HIPEC:a bridge between open and closed-techniques〔J〕.J Minim Access Surg,2016;12(1):86-9.
12 Ba MC,Long H,Zhang XL,etal.Laparoscopic hyperthermic intraperitoneal perfusion chemotherapy for patients with malignant ascites secondary to unresectable gastric cancer〔J〕.J Laparoendosc Adv Surg Tech A,2016;26(1):32-9.
13 邓文静,余更生,吕华珠,等.多西他赛联合顺铂治疗晚期胃癌的临床观察〔J〕.辽宁医学院学报,2014;35(1):24-6.
14 Wu Z,Ma S,Jing S,etal.Effect of hyperthermic intraperitoneal perfusion chemotherapy in combination with intravenous chemotherapy as postoperative adjuvant therapy for advanced gastric cancer〔J〕.Hepatogastroenterology,2014;61(132):972-7.
15 Braam HJ,Schellens JH,Boot H,etal.Selection of chemotherapy for hyperthermic intraperitoneal use in gastric cancer〔J〕.Crit Rev Oncol Hematol,2015;95(3):282-96.
16 Wu X,Li Z,Li Z,etal.Hyperthermic intraperitoneal chemotherapy plus simultaneous versus staged cytoreductive surgery for gastric cancer with occult peritoneal metastasis〔J〕.J Surg Oncol,2015;111(7):840-7.
17 Sheshadri DB,Chakravarthy MR.Anaesthetic considerations in the perioperative management of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy〔J〕.Indian J Surg Oncol,2016;7(2):236-43.
18 Kitayama J.Intraperitoneal chemotherapy against peritoneal carcinomatosis:current status and future perspective〔J〕.Surg Oncol,2014;23(2):99-106.
〔2015-04-07修回〕
(编辑 苑云杰)
王启船(1975-),男,硕士,副主任医师,主要从事肿瘤微创治疗研究。
R735.2
A
1005-9202(2017)01-0113-03;
10.3969/j.issn.1005-9202.2017.01.049
