行为学干预对血管性痴呆大鼠神经再生及脑组织N-myc下游调节基因1蛋白表达的影响
2017-02-13邢雪松吕威力吴溪婷
邢雪松 吕威力 吴溪婷
(沈阳医学院解剖学教研室,辽宁 沈阳 110034)
行为学干预对血管性痴呆大鼠神经再生及脑组织N-myc下游调节基因1蛋白表达的影响
邢雪松 吕威力1吴溪婷2
(沈阳医学院解剖学教研室,辽宁 沈阳 110034)
目的 探讨不同干预方法对血管性痴呆(VD)大鼠神经再生及脑组织N-myc下游调节基因1(NDRG1)蛋白表达的影响。方法 雄性Wistar大鼠随机分为假手术组,模型组,训练组,bFGF组。采用两血管阻断加硝普钠降压法制作大鼠VD动物模型,用HE、TTC染色法和免疫组织化学方法检测海马组织NDRG1蛋白的表达及穿梭箱训练和bFGF的干预作用。结果 脑缺血再灌注第7天缺血海马神经元NDRG1阳性细胞明显增多,且随缺血再灌注时间的延长逐渐增多,第21天达高峰。应用穿梭箱训练和bFGF的干预后NDRG1阳性细胞明显增加。结论 穿梭箱训练和bFGF促进神经再生作用可能由NDRG1信号介导。
行为学训练;N-myc下游调节基因1;神经再生;增殖
血管性痴呆(VD)临床表现除神经系统定位损害的症状和体征外尚有一系列异常的神经心理症状和精神行为,已成为继阿尔茨海默病(AD)后的第二大痴呆疾病,老年人多见。探索VD 发病的相关因素及发病机制,以便寻求早期诊断、早期治疗的有效措施已刻不容缓。N-myc 下游调节基因(NDRG)1〔1~3〕产物在多数组织中均有表达,主要参与细胞的生长发育及分化成熟,并与肿瘤的转移密切相关〔4~6〕。NDRG1主要分布在肾、脑、心和胎盘等,可能在组织发育过程中发挥不同的作用〔7~9〕。本研究利用两血管阻断加硝普钠降压法制作大鼠VD动物模型,检测NDRG1在VD海马组织中的表达及穿梭箱训练和bFGF的干预作用,探讨不同干预方法对VD大鼠神经再生及脑组织NDRG1蛋白表达的影响。
1 材料与方法
1.1 VD模型的制备 健康雄性Wistar大鼠,体质量250~300 g,由沈阳医学院实验动物中心提供。随机分为假手术组、模型组、训练组及bFGF组。模型组、训练组和bFGF组按再灌注时间点分为以下各亚组:再灌注后3、7、14、21 d组,每组均6只。利用两血管阻断加硝普钠降压法制作大鼠VD模型,1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,行颈正中切口,分离双侧颈总动脉,腹腔注射硝普钠(2.5 mg/kg),无创动脉夹夹闭双侧颈总动脉10 min后,再通10 min,再夹闭10 min,再通后缝合伤口。假手术组仅分离动脉,不阻断血管,余同手术组。训练组给予穿梭箱训练,bFGF组腹腔注射bFGF,此后分别于3、7、14、21 d后处死取材,常规HE染色。
1.2 穿梭箱训练 以声音为条件刺激,电击为非条件刺激。先将大鼠放入穿梭箱内暗适应5 min,然后持续声音刺激5 s,如大鼠不逃到另一端(穿梭),则给予电击,电流强度10~20 mA,使动物逃至箱底不通电一侧,此时电击停止,否则持续受电击5 s。间隔30 s,开始下一轮训练。于造模后行穿梭箱训练,每次实验进行20次声、电刺激。
1.3 给药方法 bFGF为北京双鹭药业股份有限公司研制,用注射用水稀释,bFGF组腹腔注射10 μg/kg,其余组腹腔注射等量生理盐水,缺血后即刻给药。
1.4 行为学评分 各组大鼠麻醉清醒后进行模型筛选,造模成功大鼠分别进行神经行为学评分,评分参照Zea Longa 5分制标准:0分:没有神经功能缺损;1分:左前爪不能完全伸展;2分:行走时,大鼠向左侧转圈;3分:行走时,大鼠身体向左侧(瘫痪侧)倾倒;4分:不能自发行走,有意识丧失。评分为0分和4分者均被剔除,随机补充,保证每亚组6只不变。
1.5 脑梗死体积测定 各组大鼠于再灌注后3 d迅速断头取脑,置-70℃冰箱速冻10 min,取其前脑从额极到枕极切成2 mm厚的冠状面脑片,将切片立即置于2%TTC磷酸缓冲液中避光、37℃恒温孵育30 min,取出置于4%多聚甲醛中固定2 h。正常脑组织被染成鲜红色,而梗死区呈苍白色。将固定的脑片按切片顺序排列。数码相机拍照后,应用metamorph-evolution MP5.0显微图像分析系统测量前脑总面积和脑梗死面积,根据公式V=t(A1+A2+A3+……+An)-t(A1+An)算出前脑总体积和梗死体积。其中t为切片厚度,A为梗死面积。
1.6 NDRG1的免疫组织化学检测 取各组缺血脑片厚约3 mm,浸入4%多聚甲醛固定液中,24 h后应用免疫组织化学显色检测缺血海马NDRG1的表达情况。滴加正常山羊血清37℃,30 min,分别滴加一抗兔抗鼠NDRG1 4℃过夜,滴加二抗37℃,60 min,滴加ABC复合液37℃,60 min,DAB显色15 min,蒸馏水冲洗,常规脱水、透明,中性树胶封片。随机选取每组4张切片,光学显微镜下观察NDRG1免疫反应阳性细胞切片,每张切片再随机选取3个视野,metamorph-evolution MP5.0显微图像分析系统检测光密度值。
1.7 统计学方法 采用SPSS11.5软件进行方差分析及t检验。
2 结 果
2.1 脑梗死体积比较 假手术组未见梗死灶。和模型组相比,训练组、bFGF组梗死体积明显减小,差异有统计学意义(P<0.05)。训练组和bFGF组比较差异无统计学意义(P>0.05)。见表1。

组别前脑总体积梗死灶体积梗死灶与前脑体积比模型组662.26±34.29148.16±22.3522.37%训练组652.21±36.421)116.34±13.431)17.83%1)bFGF组666.24±31.311)89.25±23.721)13.39%1)
与模型组比较:1)P<0.05
2.2 HE染色评估组织学改变 假手术组神经元数量多,排列整齐,形态完整;模型组细胞肿胀,分布不均,细胞周围间隙增宽,有的细胞体积缩小,核固缩深染,其中3 d组织变化最为明显;训练组和bFGF组海马存活神经元数比模型组增多,神经元胞体肿胀明显减轻,细胞形态明显改善,见图1。
2.3 穿梭箱训练对NDRG1的影响 假手术组海马NDRG1有轻度表达,随缺血再灌注时间的延长,表达逐渐增加,高峰出现在21 d,之后其水平随恢复时间有下降(P<0.05) 。训练组和bFGF组,NDRG1阳性产物表达较3、7、14和21 d 模型组海马明显增加,表达趋势与模型组相同(P<0.05),见表2,图1。
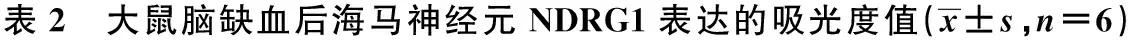
组别3d7d14d21d假手术组0.204±0.0240.205±0.0140.203±0.0180.204±0.022模型组0.223±0.0111)0.236±0.0121)0.247±0.0261)0.261±0.0141)训练组0.293±0.0322)0.305±0.0412)0.316±0.0272)0.334±0.0222)bFGF组0.296±0.0212)0.309±0.0322)0.319±0.0182)0.338±0.0192)
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05
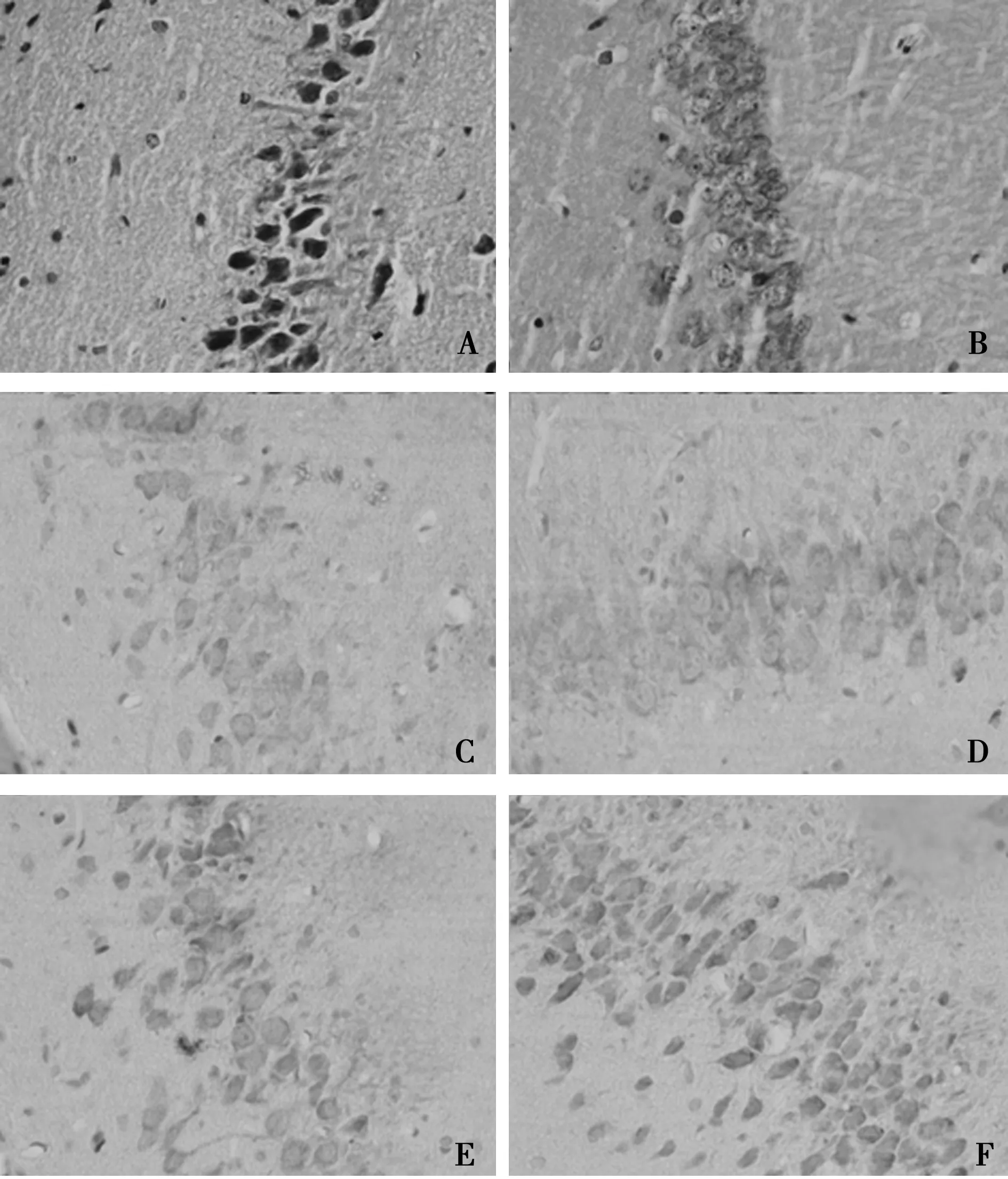
A:模型3 d组 HE染色;B:训练3 d组 HE染色;C:模型14 d组NDRG1阳性细胞;D:训练14 d组NDRG1阳性细胞;E:模型21 d组NDRG1阳性细胞;F:训练21 d组NDRG1阳性细胞图1 VD大鼠海马HE染色及NDRG1阳性细胞(×400)
3 讨 论
成年大鼠海马是重要的神经生发区,为脑缺血后内源神经干细胞(NSCs)参与修复奠定了研究基础。内源性 NSCs 通过增殖、迁移、分化过程参与脑缺血大鼠的神经功能修复。本研究观察了缺血后海马 NSCs 的发生以及行为训练对其生发规律的影响,为脑缺血疾病的神经康复提供一定的理论基础和依据〔10〕。行为学训练是康复训练的一种,它主要训练动物的本能行为能力,如学习、记忆、空间辨别及觅食等,促进受损的行为学功能的恢复。在本研究中,我们选用穿梭箱进行训练,因为VD大鼠的损伤区位于海马区,而穿梭箱被证实是学习记忆能力最好的训练工具。既往在此模型基础上的一系列研究表明,缺血性脑损伤大鼠经过穿梭箱训练后,其受损的学习记忆明显得到恢复,但训练作用的具体机制尚不十分清楚〔11,12〕。
有研究显示,NDRG1与热休克蛋白(Hsp)70及Hsp90相互作用,发挥重要的生物学功能。研究人员发现NDRG1在新生小鼠的肾及脑中的表达情况发现,NDRG1蛋白表达浓度在小鼠出生后15 d由肾近曲小管逐渐移向集合管,而在脑组织中于同期从海马锥体神经元转移到大脑灰质的星形胶质细胞,提示NDRG1参与了肾和脑的发育〔13〕。此外,有学者观察缺乏NDRG1小鼠的机体变化,发现约5 w时,小鼠的坐骨神经由于脱髓鞘萎缩,表现出肌无力,尤其后肢无力,进一步发现是由于NDRG1缺乏导致施万细胞功能障碍所致〔8〕。NDRG1在人体许多组织中均有表达,这提示可能参与了机体多种组织的生长发育〔14,15〕。本研究说明训练组和bFGF组对VD大鼠脑损伤具有修复作用,从一个侧面揭示穿梭箱训练对NSCs增殖分化的作用机制。
1 Qu X,Zhai Y,Wei H,etal.Characterization and expression of three novel differentiation-related genes belong to the human NDRG gene family〔J〕.Mol Cell Biochem,2002;229(1-2):35-44.
2 Stein S,Thomas EK,Herzog B,etal.NDRG1 is necessary for p53-dependent apoptosis〔J〕.J Biol Chem,2004;279(47):48930-40.
3 Chen J,Li S,Yang Z,etal.Correlation between NDRG1 and PTEN expression in endometrial carcinoma〔J〕.Cancer Sci,2008;99(4):706-10.
4 Cangul H.Hypoxia upregulates the expression of the NDRG1 gene leading to its overexpression in various human cancers〔J〕.BMC Genet,2004;5:27.
5 Ellen TP,Ke O,Zhang P,etal.NDRG1,a growth and cancer related gene:regulation of gene expression and function in normal and disease states〔J〕.Carcinogenesis,2008;29(1):2-8.
6 Said HM,Stein S,Hagemann C,etal.Oxygen-dependent regulation of NDRG1 in human glioblastoma cells in vitro and in vivo〔J〕.Oncol Rep,2009;21(1):237-46.
7 Tu LC,Yan X,Hood L,etal.Proteomics analysis of the interaction of N-myc downstream regulated gene 1 and its interactions with the androgen response program in prostate cancer cells〔J〕.Mol Cell Proteomics,2007;6(4):575-88.
8 Zhang J,Chen S,Zhang W,etal.Human differentiation-related gene NDRG1 is a Myc downstream-regulated gene that is repressed by Myc on the core promoter region〔J〕.Gene,2008;417(1-2):5-12.
9 Song Y,Oda Y,Hori M,etal.N-myc downstream regulated gene 1/Cap43 may play an important role in malignant progression of prostate cancer,in its close association with E-cadherin〔J〕.Hum Pathol,2010;41(2):214-22.
10 Strzelczyk B,Szulc A,Rzepko R,etal.Identification of high risk stageⅡcolorectal tumors by combined analysis of the NDRG1 gene expression and the depth of tumor invasion〔J〕.Ann Surg Oncol,2009;16(5):1287-94.
11 Ando T,Ishiguro H,Kimura M,etal.Decreased expression of NDRG1 is correlated with tumor progression and poor prognosis in patients with esophageal squamous cell carcinoma〔J〕.Dis Esophagus,2006;19(6):454-8.
12 Koshiji M,Kumamoto K,Morimura K,etal.Correlation of N-myc downstream-regulated gene 1 expression with clinical outcomes of colorectal cancer patients of different race/ethnicity〔J〕.World J Gastroenterol,2007;13(20):2803-10.
13 Li J,Kretzner L.The growth-inhibitory Ndrg1 gene is a Myc negative target in human neuroblastomas and other cell types with overexpressed N-or-C-myc〔J〕.Mol Cell Biochem,2003;250(2):91-105.
14 Nishio S,Ushijima K,Tsuda N,etal.Cap43/NDRG1/Drg-1 is a molecular target for angiogenesis and a prognostic indicator in cervical adenocarcinoma〔J〕.Cancer Lett,2008;264(1):36-43.
15 Tschan MP,Shan D,Laedrach J,etal.NDRG1 /2 expression is inhibited in primary acute myeloid leukemia〔J〕.Leuk Res,2010;34(3):393-8.
〔2015-09-14修回〕
(编辑 苑云杰/曹梦园)
辽宁省科技厅科学技术计划资助项目(201602729)
吕威力(1974-),女,副教授,博士,主要从事神经生物学研究。
邢雪松(1973-),男,副教授,博士,主要从事神经生物学研究。
R285.5
A
1005-9202(2017)01-0020-03;
10.3969/j.issn.1005-9202.2017.01.008
1 病理学教研室 2 信息技术中心计算机教研室
