蝙蝠葛苏林碱对阿尔茨海默病小鼠海马的影响和机制
2017-02-13费洪新张英博张晓杰
费洪新 高 音 张英博 张晓杰
(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
蝙蝠葛苏林碱对阿尔茨海默病小鼠海马的影响和机制
费洪新 高 音 张英博 张晓杰
(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
目的 探讨蝙蝠葛苏林碱(DS)对阿尔茨海默病(AD)小鼠影响及机制。方法 C57BL/6小鼠随机分对照组、模型组、多奈哌齐组(0.001 g·kg-1)及DS高、中和低剂量组(1.08、0.54、0.27 g/kg)。采用β-淀粉样蛋白(Aβ)1~42(80 pmol/μl)脑室注射诱导AD模型。治疗30 d后测小鼠学习记忆能力,透射电镜观察海马CA3区,测脏器指数和脑伊文氏蓝(EB),酶联免疫吸附法测海马β-淀粉样蛋白前体蛋白(APP)、Aβ1~42、白介素(IL)-1β、肿瘤坏死因子(TNF)-α、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)及丙二醛(MDA)。结果 与模型组比较,DS改善AD小鼠学习记忆能力(P<0.05)和海马结构,明显升高脾和胸腺指数(P<0.05),其他脏器指数改变不明显(P>0.05),EB、APP、Aβ1-42、IL-1β、TNF-α和MDA明显降低(P<0.05),T-AOC、SOD和GSH-Px明显升高(P<0.05)。结论 DS改善AD小鼠学习记忆及海马结构,增强免疫和抗氧化,抑制APP、Aβ1-42、IL-1β和TNF-α可能是抗AD机制。
蝙蝠葛苏林碱;阿尔茨海默病
阿尔茨海默病(AD)是一种老年性、神经性和退行性疾病〔1〕。目前有许多治疗AD的药物,如乙酰胆碱酯酶(AChE)抑制剂〔2〕、抗氧化剂〔3〕和雌激素〔4〕等,但并没有特效药。AD学习记忆能力下降〔5〕且脑出现老年斑(SP),SP来源β-淀粉样蛋白前体蛋白(APP),SP核心是β-淀粉样蛋白(Aβ)〔6〕,Aβ促进小胶质细胞(MG)及星形胶质细胞(As)活化〔7〕,神经元减少〔8〕,海马神经元侵犯较为严重,血脑屏障(BBB)通透性改变等。AD表现活性氧(ROS)增加,引起总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)及丙二醛(MDA)异常。AD引起大量炎症介质释放〔9〕,Aβ促进MG产生白细胞介素(IL)-1β等,促进As分泌肿瘤坏死因子(TNF)-α等〔10,11〕。慢性炎症与AD密切相关〔12〕,非甾体类药物减少Aβ沉积,降低AD发病风险〔13〕,延迟AD发作〔14〕。课题组前期研究显示中药北豆根成分蝙蝠葛酚性碱(PAMD)可治疗AD〔15〕,PAMD包括蝙蝠葛碱(DAU)和蝙蝠葛苏林碱(DS)等,DS对AD研究国内外尚处于空白,本实验旨在探寻DS对AD小鼠影响及机制。
1 材料与方法
1.1 动物 36只清洁级C57BL/6小鼠,雄性,8周龄,体重(23±2)g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。
1.2 主要药物和仪器 药物:DS,成都曼斯特公司,批号:150306;APP、Aβ1~42、IL-1β、TNF-α等试剂盒,南京建成生物工程研究所;多奈哌齐,中国重庆植恩药业有限公司,批号:20141201;Aβ1~42,Sigma公司;其他试剂为国产分析纯。仪器:TCNAI-G2型透射电子显微镜(TEM),荷兰公司;6100型RT-雷杜酶标仪,美国RT公司;Morris水迷宫(MWM),安徽淮北正华生物仪器有限公司等。
1.3 方法
1.3.1 复制AD模型 小鼠麻醉后,剪去头顶毛发,固定小鼠,微量加样器双侧脑室海马区一次性注入10 μg凝聚态Aβ1~42(80 pmol/μl),针头留10 min,退针,封闭,包扎。对照组小鼠双侧脑室注射等量生理盐水。
1.3.2 分组及给药 C57BL/6小鼠36只随机分对照组,模型组,多奈哌齐组,DS高、中、低剂量组,每组6只。对照组、模型组给予生理盐水灌胃,多奈哌齐组给予多奈哌齐0.001 g/kg灌胃,DS高、中、低剂量组分别予DS 1.08、0.54、0.27 g/kg灌胃,给药30 d。
1.3.3 MWM测定位航行能力 实验结束后测定,MWM水深20 cm,水温(23±2)℃,平台放于第Ⅳ象限,第1、2、3、4天为训练时间,每次训练60 s,若60 s未找到移动平台,将小鼠放平台15 s,潜伏期记为60 s。第5天测潜伏期评价定位航行能力。
1.3.4 MWM测空间探索能力 实验结束后过程同1.3.3,第5天撤去MWM平台,检测在60 s小鼠找到平台的游泳距离,评价空间探索能力。
1.3.5 TEM观察海马CA3超微结构 实验结束后小鼠心灌注2.5%戊二醛后,取材脑海马、2.5%戊二醛固定、四氧化锇固定、乙醇脱水、包埋、切片等,TEM观察海马CA3结构。
1.3.6 测脏器指数 实验结束后称取小鼠体重,冰上断头处死,解剖,取材心、肺、肾、肝、脑、脾和胸腺,洗净,称取脏器质量并计算。脏器指数(mg/g)=脏器质量(mg)/体重(g)。
1.3.7 测脑BBB通透性 使用脑伊文氏蓝(EB)表示BBB通透性。实验结束后小鼠尾静脉注射2%EB,全身变蓝后麻醉,心灌注70 ml生理盐水,冰上迅速取脑,放入甲酰胺内,45℃避光孵育72 h,匀浆,离心机5 000 r/min离心10 min。6100型酶标仪于630 nm处测吸光度值(A),根据EB标准曲线方程求出EB含量。EB含量用EB浓度/脑湿重(μg/g)表示。
1.3.8 检测海马抗氧化指标 实验结束后小鼠麻醉,冰上解剖,取材海马,按照试剂盒(南京建成生物工程研究所,中国)说明书测T-AOC、SOD、GSH-Px和MDA。
1.3.9 ELISA检测海马蛋白表达 实验结束后小鼠断头,迅速取海马,匀浆,静置,TGL-16G离心机5 000 r/min离心8 min,分装,-20℃保存。6100型RT-雷杜酶标仪于450 nm波长测各孔吸光度(A),绘制标准曲线,从方程求得APP、Aβ1~42、IL-1β和TNF-α。
1.4 统计学分析 采用SPSS19.0软件行单因素方差分析。
2 结 果
2.1 定位航行能力 定位航行能力用潜伏期表示。随着训练时间延长,小鼠潜伏期呈下降趋势。与对照组比较,模型组潜伏期明显增加(P<0.05);与模型组比较,DS高、中剂量组潜伏期明显缩短(P<0.05),见表1。
2.2 空间探索能力 空间探索能力用游泳距离表示,随着训练时间延长,小鼠游泳距离呈现下降趋势。与对照组比较,模型组游泳距离明显增加(P<0.05);与模型组比较,DS高、中剂量组游泳距离明显缩短(P<0.05),见表2。

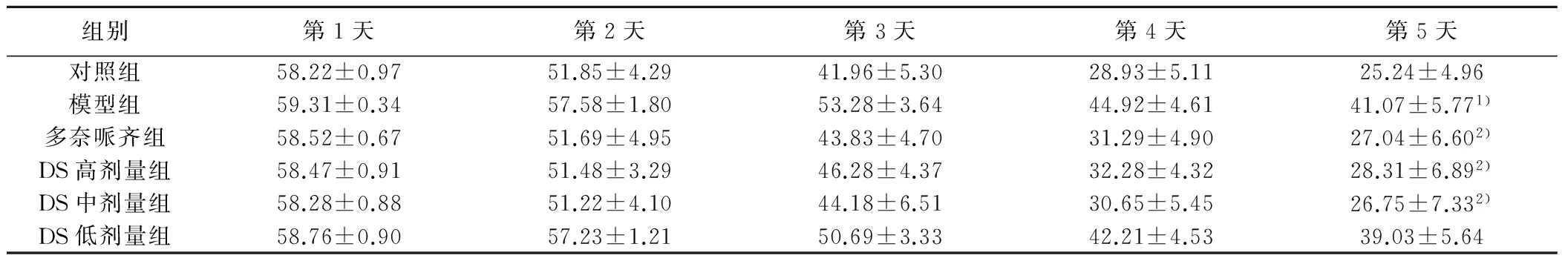
组别第1天第2天第3天第4天第5天对照组58.22±0.9751.85±4.2941.96±5.3028.93±5.1125.24±4.96模型组59.31±0.3457.58±1.8053.28±3.6444.92±4.6141.07±5.771)多奈哌齐组58.52±0.6751.69±4.9543.83±4.7031.29±4.9027.04±6.602)DS高剂量组58.47±0.9151.48±3.2946.28±4.3732.28±4.3228.31±6.892)DS中剂量组58.28±0.8851.22±4.1044.18±6.5130.65±5.4526.75±7.332)DS低剂量组58.76±0.9057.23±1.2150.69±3.3342.21±4.5339.03±5.64
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05;下表同
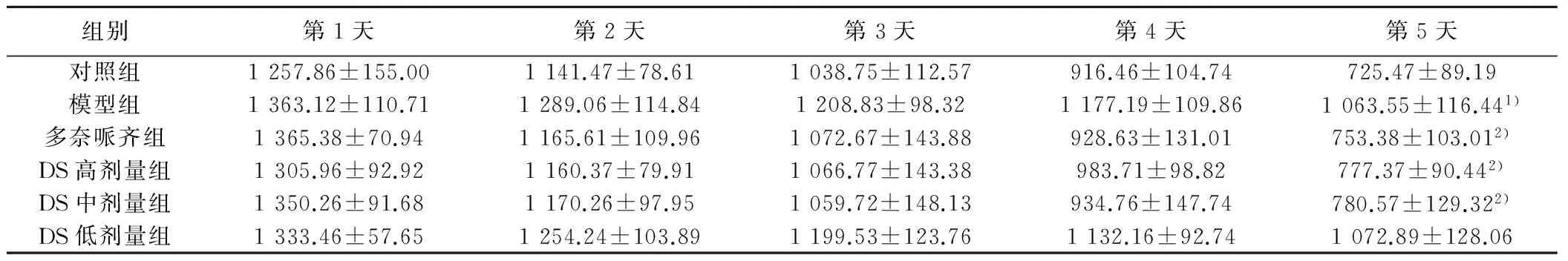
组别第1天第2天第3天第4天第5天对照组1257.86±155.001141.47±78.611038.75±112.57916.46±104.74725.47±89.19模型组1363.12±110.711289.06±114.841208.83±98.321177.19±109.861063.55±116.441)多奈哌齐组1365.38±70.941165.61±109.961072.67±143.88928.63±131.01753.38±103.012)DS高剂量组1305.96±92.921160.37±79.911066.77±143.38983.71±98.82777.37±90.442)DS中剂量组1350.26±91.681170.26±97.951059.72±148.13934.76±147.74780.57±129.322)DS低剂量组1333.46±57.651254.24±103.891199.53±123.761132.16±92.741072.89±128.06
2.3 TEM结果 对照组小鼠海马CA3区神经元形态规则,胞体较大,核大而圆,细胞质丰富,线粒体丰富,高尔基体清晰。模型组神经元不规则,细胞质不丰富,核椭圆形,核膜不清楚,细胞器较少,线粒体轻度肿胀。DS高、中、低剂量组神经元较规则,细胞器不同程度增多,细胞结构较清晰,见图1,图2。

A:对照组;B:模型组;C:多奈哌齐组:D:DS高剂量组;E:DS中剂量组;F:DS低剂量组;下图同图1 海马神经元结构(TEM,×2 550)

图2 海马神经元细胞质结构(TEM,×16 500)
2.4 脏器指数 与对照组比较,模型组小鼠心、肺、肾、肝、脑指数改变不明显(P>0.05);与模型组比较,DS高、中、低剂量组心、肺、肾、肝、脑指数改变不明显(P>0.05)。另与对照组比较,模型组脾、胸腺指数明显降低差异有统计学意义(P<0.05);与模型组比较,DS高、中剂量组脾、胸腺指数明显增加差异有统计学意义(P<0.05),见表3。

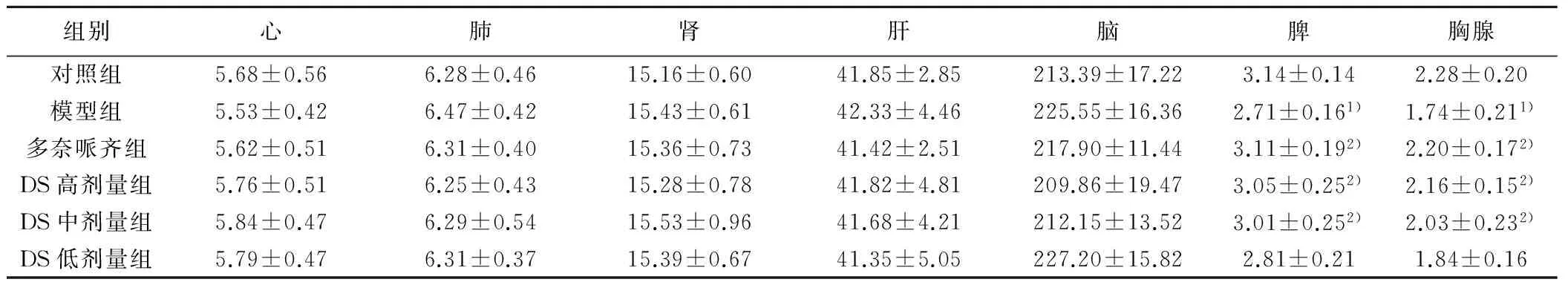
组别心肺肾肝脑脾胸腺对照组5.68±0.566.28±0.4615.16±0.6041.85±2.85213.39±17.223.14±0.142.28±0.20模型组5.53±0.426.47±0.4215.43±0.6142.33±4.46225.55±16.362.71±0.161)1.74±0.211)多奈哌齐组5.62±0.516.31±0.4015.36±0.7341.42±2.51217.90±11.443.11±0.192)2.20±0.172)DS高剂量组5.76±0.516.25±0.4315.28±0.7841.82±4.81209.86±19.473.05±0.252)2.16±0.152)DS中剂量组5.84±0.476.29±0.5415.53±0.9641.68±4.21212.15±13.523.01±0.252)2.03±0.232)DS低剂量组5.79±0.476.31±0.3715.39±0.6741.35±5.05227.20±15.822.81±0.211.84±0.16
2.5 EB含量 以EB浓度为X,吸光度值(A)为Y,绘制EB标准曲线并求得回归方程:Y=0.095 9X+0.077 2,R2=0.998 7。表明与对照组(1.06±0.34)比较,模型组小鼠脑EB含量(1.96±0.45)明显升高(P<0.05);与模型组(1.96±0.45)比较,多奈哌齐组(1.04±0.62)、DS高剂量组(1.18±0.82)、DS中剂量组(1.31±0.47)小鼠脑EB含量明显降低(P<0.05),而DS低剂量组(1.66±0.72)改变不明显(P>0.05)。
2.6 海马抗氧化指标 与对照组比较,模型组小鼠海马T-AOC、SOD、GSH-Px明显降低且MDA明显升高,差异有统计学意义(P<0.05);与模型组比较,DS高、中剂量组海马T-AOC、SOD、GSH-Px明显增加且MDA明显降低,差异有统计学意义(P<0.05),见表4。

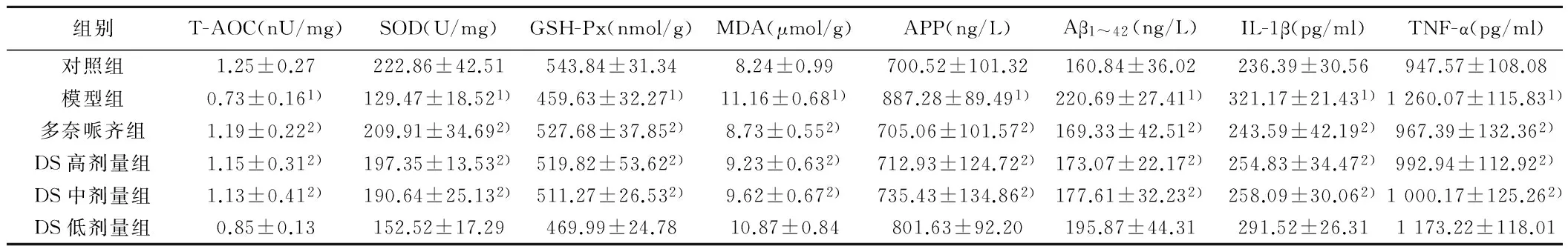
组别T-AOC(nU/mg)SOD(U/mg)GSH-Px(nmol/g)MDA(μmol/g)APP(ng/L)Aβ1~42(ng/L)IL-1β(pg/ml)TNF-α(pg/ml)对照组1.25±0.27222.86±42.51543.84±31.348.24±0.99700.52±101.32160.84±36.02236.39±30.56947.57±108.08模型组0.73±0.161)129.47±18.521)459.63±32.271)11.16±0.681)887.28±89.491)220.69±27.411)321.17±21.431)1260.07±115.831)多奈哌齐组1.19±0.222)209.91±34.692)527.68±37.852)8.73±0.552)705.06±101.572)169.33±42.512)243.59±42.192)967.39±132.362)DS高剂量组1.15±0.312)197.35±13.532)519.82±53.622)9.23±0.632)712.93±124.722)173.07±22.172)254.83±34.472)992.94±112.922)DS中剂量组1.13±0.412)190.64±25.132)511.27±26.532)9.62±0.672)735.43±134.862)177.61±32.232)258.09±30.062)1000.17±125.262)DS低剂量组0.85±0.13152.52±17.29469.99±24.7810.87±0.84801.63±92.20195.87±44.31291.52±26.311173.22±118.01
2.7 海马蛋白表达 与对照组比较,模型组小鼠海马APP、Aβ1~42、IL-1β和TNF-α明显增加(P<0.05);与模型组比较,DS高、中剂量组海马APP、Aβ1-42、IL-1β和TNF-α明显降低(P<0.05),见表4。
3 讨 论
AD中脑APP产生Aβ而形成SP,Aβ促进MG及As产生炎症介质并侵犯海马神经元,引起AD学习记忆下降,BBB通透性变化,脑ROS增加,基于这些实验探寻DS对AD小鼠影响及机制。目前AD研究模型有Aβ注射〔16,17〕和转基因动物〔18,19〕等。近年来多采用脑室注射Aβ建立AD模型,因此本实验采用注射Aβ建立AD模型。
MWM表明模型组小鼠潜伏期及游泳距离增加,小鼠寻找到水下平台比较困难,说明AD小鼠学习记忆能力减退,模型建立成功;DS高、中剂量对AD小鼠治疗有效,使AD小鼠较快寻找到水下平台,预示DS高、中剂量改善AD小鼠学习记忆。TEM观察海马CA3区神经元超微结构,显示对照组海马CA3区结构正常,无损伤;模型组CA3区结构损伤严重;DS各组CA3区神经元形态较规则,说明DS改善AD小鼠海马结构,减轻海马损伤。EB含量结果显示,模型组脑EB增加,BBB受到损伤,BBB通透性增加,异常物质较容易进入脑;而DS高、中剂量降低脑EB,提示DS改善AD小鼠脑BBB通透性。
模型组小鼠脾、胸腺指数降低,提示AD小鼠免疫细胞数量降低,脾B细胞数量降低且胸腺T细胞较少,提示体液免疫及细胞免疫水平降低,综合显示小鼠免疫力降低;经过DS治疗后脾、胸腺指数增加,预示DS高、中剂量促进体液免疫浆细胞及细胞免疫T细胞数量增加,提示小鼠免疫功能增加。模型组小鼠海马抗氧化指标降低且氧化产物升高,预示模型组小鼠脑抗氧化能力减弱,ROS升高;而DS高、中剂量增加抗氧化指标且氧化产物减少,说明DS高、中剂量改善AD小鼠抗氧化能力。
在AD初期MG吞噬Aβ,伴随Aβ产生增加,MG吞噬作用减弱,逐渐激活MG分泌功能,继而激活As分泌功能,产生大量炎症介质反过来激活MG和As,产生放大效应,促进Aβ进一步增加,加速AD进程。因此需检测AD相关蛋白和炎症介质。结果表明,模型组小鼠海马APP、Aβ1-42、IL-1β和TNF-α增加,预示AD脑Aβ大量积聚,引起了机体多种反应,激活MG和As,产生较多炎症介质,显示炎症反应明显;经过DS治疗后AD相关蛋白和炎症介质降低,说明DS高、中剂量减少Aβ积聚,减轻AD脑炎症反应。以上提示脑APP、Aβ1-42与IL-1β、TNF-α存在一定相关性,预示其是AD重要评价指标。
1 Lin TW,Shih YH,Chen SJ,etal.Running exercise delays neurodegeneration in amygdala and hippocampus of Alzheimer′s disease(APP/PS1)transgenic mice〔J〕.Neurobiol Learn Mem,2015;118(1):189-97.
2 Konrath EL,Passos Cdos S,Klein LC Jr,etal.Alkaloids as a source of potential anticholinesterase inhibitors for the treatment of Alzheimer′s disease〔J〕.J Pharm Pharmacol,2013;65(12):1701-25.
3 Kawada H,Blessing K,Kiyota T,etal.Effects of multifunctional antioxidants on mitochondrial dysfunction and amyloid-β metal dyshomeostasis〔J〕.J Alzheimers Dis,2015;44(1):297-307.
4 Lan YL,Zhao J,Li S.Update on the neuroprotective effect of estrogen receptor alpha against Alzheimer′s disease〔J〕.J Alzheimers Dis,2015;43(4):1137-48.
5 Yu L,Wang S,Chen X,etal.Orientin alleviates cognitive deficits and oxidative stress in Aβ1-42 induced mice model of Alzheimer′s disease〔J〕.Life Sci,2015;15(121):104-9.
6 Takahashi E,Kuribayashi H,Chambers JK,etal.Senile plaques and cerebral amyloid angiopathy in an aged California sea lion〔J〕.Amyloid,2014;21(3):211-5.
7 Latta CH,Sudduth TL,Weekman EM,etal.Determining the role of IL-4 induced neuroinflammation in microglial activity and amyloid-β using BV2 microglial cells and APP/PS1 transgenic mice〔J〕.J Neuroinfla mmation,2015;12(1):41.
8 Agosta F,Dalla Libera D,Spinelli EG,etal.Myeloid microvesicles in cerebrospinal fluid are associated with myelin damage and neuronal loss in mild cognitive impairment and Alzheimer disease〔J〕.Ann Neurol,2014;76(6):813-25.
9 Richartz E,Stransky E,Batra A,etal.Decline of immune responsiveness:a pathogenetic factor in Alzheimer′s disease〔J〕.J Psychiatr Res,2005;39(5):535-43.
10 Swardfager W,Lanctot K,Rothenburg L,etal.A meta-analysis of cytokines in Alzheimer′s disease〔J〕.Biol Psychiatry,2010;68(10):930-41.
11 Lin X,Bai G,Lin L,etal.Vaccination induced changes in pro-inflammatory cytokine levels as an early putative biomarker for cognitive improvement in a transgenic mice model for Alzheimer disease〔J〕.Hum Vaccin Immunother,2014;10(7):2024-31.
12 Azizi G,Mirshafie A.The potential role of proinflammatory and antiinflammatory cytokines in Alzheimer disease pathogenesis〔J〕.Immunopharmacol Immunotoxicol,2012;34(6):881-95.
13 Meraz-Ríos MA,Toral-Rios D,Franco-Bocanegra D,etal.Inflammatory process in Alzheimer′s Disease〔J〕.Front Integr Neurosci,2013;13(7):59.
14 Breitner JC,Baker LD,Montine TJ,etal.Extended results of the Alzheimer′s disease anti-inflammatory prevention trial〔J〕.Alzheimers Dement,2011;7(4):402-11.
15 费洪新,高 音,孙丽慧,等.蝙蝠葛酚性碱对阿尔茨海默病模型小鼠学习记忆和海马的影响〔J〕.中国实验方剂学杂志,2015;21(7):91-4.
16 费洪新,高 音,孙丽慧,等.黄芪多糖对阿尔茨海默病小鼠海马组织的影响〔J〕.中国老年学杂志,2015;35(16):4426-9.
17 Wei L,Lv S,Huang Q,etal.Pratensein attenuates Aβ-induced cognitive deficits in rats:enhancement of synaptic plasticity and cholinergic function〔J〕.Fitoterapia,2015;101(1):208-17.
18 费洪新,周忠光,韩玉生,等.补阳还五汤对阿尔茨海默病小鼠血脑屏障通透性的影响〔J〕.时珍国医国药,2015;26(5):1028-31.
19 费洪新,周忠光,姜 波,等.补阳还五汤对阿尔茨海默病小鼠学习记忆及海马APP蛋白的影响〔J〕.中国实验方剂学杂志,2014;20(20):101-4.
〔2015-02-23修回〕
(编辑 李相军)
Effect of Daurisoline on hippocampus in Alzheimer′s disease mice and its mechanisms
FEI Hong-Xin,GAO Yin,ZHANG Ying-Bo,et al.
Qiqihar Medical University,Qiqihaer 161006,Heilongjiang,China
Objective To explore the effect of Daurisoline(DS) on hippocampus in Alzheimer′s disease(AD) mice and its mechanisms.Methods C57BL/6 mice were randomly divided into control,model,Donepezil (0.001 g/kg),DS high-dose (1.08 g/kg),DS medial-dose (0.54 g/kg),DS low-dose (0.27 g/kg) groups. The Aβ1~42(80 pmol/μl) was injected into the bilateral hippocampus of mice to induce AD model. The mice were killed after 30 days continuous treating. The Morris water maze was used to observe the learning and memory ability. Pathological changes of the hippocampus CA3 area were detected by transmission electron microscope. The viscera indices in mice were measured by electronic balance. The levels of APP, Aβ1~42,IL-1β, TNF-α, T-AOC, SOD, GSH-Px and MDA in the hippocampus were measured by ELISA.Results Compared with that of model group,DS significantly improved the learning and memory ability of AD mice(P<0.05).The brain maintain normal morphological structure of nerve cells and the organ index of spleen and thymus organ in DS dose groups were significantly increased(P<0.05).The EB content of AD mice was significantly decreased (P<0.05),the levels of APP, Aβ1~42, IL-1β, TNF-α and MDA were significantly decreased(P<0.05),the contents of T-AOC, SOD and GSH-Px were significantly increased(P<0.05).Conclusions DS could improve the ability of learning and memory of AD mice and normal morphological structure of nerve cells and organ coefficients of spleen and thymus organ. DS plays a certain role in the treatment of AD through inhibiting APP, Aβ1~42, IL-1β and TNF-α.
Daurisoline;Alzheimer′s disease
国家自然科学基金 (81173576,81373777,81373599);教育部重点项目(210068)
高 音(1969-),女,博士,教授,硕士生导师,主要从事痴呆、脑损伤机制研究。
费洪新(1978-),男,博士,讲师,黑龙江中医药大学中医学博士后科研流动站,在站人员,主要从事痴呆、肿瘤、抑郁和痛风研究。
R285
A
1005-9202(2017)01-0009-04;
10.3969/j.issn.1005-9202.2017.01.004
