慢性阻塞性肺疾病患者外周血调节性T细胞和Foxp3的表达
2017-02-11郝璐张园
郝璐 张园
郝璐 张园
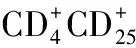

慢性阻塞性肺疾病(chronic obstructive pulmonary disease,慢阻肺) 是一种主要由免疫反应所引起的以肺实质、气道和肺血管为特征的疾病[1],发展趋势为进行性,和肺部对有害气体或者有害颗粒等的异常炎症反应存在密切联系[2],并与多种炎症介质和细胞因子有关[1]。其临床表现主要为肺气肿、黏液分泌增加以及阻塞性细支气管炎[3]。有研究表明,慢阻肺发病的关键机制可能同它自身的免疫系统调节紊乱有很大关联[4]。并且,大量研究证实,慢阻肺患者的气道、肺血管以及肺实质中均存有慢性炎症[5]。慢阻肺的发展是包括巨噬细胞、中性粒细胞及T淋巴细胞等在内的多种炎性细胞参与的结果[6]。因此,对这些炎症细胞在慢阻肺中具体作用机制的了解还是十分有必要的。
资料与方法
一、研究对象
采用前瞻性研究方法,选择 2013 年6月至 2015 年 3月我院收住的 慢阻肺 患者 105例,其中男性 64 例,女性 41 例,年龄 31-74 岁,平均年龄(47.2±8.6)岁;另选取本院科研志愿者108例作对照组,其中男性64例,女性44例,年龄 32-68岁,平均年龄(48.9±6.7)岁。
诊断标准:参考 2010 慢阻肺 全球倡议及 2007年中华医学会呼吸病学分会 慢阻肺 组制定的《慢性阻塞性肺疾病诊治指南》中的诊断标准[12]:①慢阻肺 危险因素接触史(可有);②咳嗽、咳痰、呼吸困难等症状(可有);③存在不完全可逆的气流受限:使用支气管扩张剂后第1 秒用力呼气容积占用力肺活量的百分比(FEV1/FVC)<70%,FEV1<0.8预计值(必须具备)。
病例纳入标准:①符合 慢阻肺 诊断标准;②年龄 30- 80岁女或男患者;③患者表明接受临床研究是自愿,并取得患者知情同意。病例排除标准:①肺大疱者、合并气胸和有出血倾向患者;②结核、支气管扩张、囊性肺纤维化、肿瘤、真菌感染、由过敏因素或刺激性气体导致的慢性咳嗽、喘息病患;③其他疾病如泌尿、代谢、心血管、消化系统等严重并发病,肝肾功能不全,痴呆、意识不清与其他精神病病患;④影响运动呼吸功能的神经肌肉病患;⑤哺乳或妊娠期妇女。本研究经我院学术伦理委员会审批同意并获得所有研究对象的知情同意,且每位受试者入选前已签知情同意书。
二、肺功能的测定
早晨开始测定。使用200μg沙丁胺醇 (上海威智医药科技有限公司) 15min后,采用德国生产的Carefusion型肺功能仪(型号:234Gmbh)测定肺功能参数:用力肺活量 (forced vital capacity , FVC)、第1秒用力呼气容积 (forced expiratory volume in one second , FEV1)、FEV1/FVC、最大呼气流量 (peak expiratory flow, PEF)。各指标均以实测值占预计值百分比表示。

全部患者及对照组都在清晨空腹状态下抽10mL外周静脉血,其中的5mL用离心来分离出血清,在-70℃环境下保存用来进行细胞因子的检测。另外5mL加入肝素抗凝,用淋巴细胞分离液 (AXIS-SHIELD公司)常规分离外周血单个核细胞(peripheral blood monouclear cells, PBMC),使用含 有10%小牛血清的RPMI-1640溶液调整细胞浓度至1×106/mL,取200μL的细胞液,在其中分别加入20μL抗CD25-PE和抗CD4-FITC的单克隆抗体,同型对照为IgG1-FE和IgG1-FITC,混匀后,避光孵育25至30min,然后用PBS溶液洗涤2次。接着将细胞悬浮于0.5mL PBS缓冲液中,震荡均匀后,应用EPICS-XL流式细胞仪(Becton Dickinson公司)进行检测,检测指标为各阳性细胞数量和所占比例。胎牛血清(FBS)和RPMI-1640培养基为美国GIBCO公司产品,抗CD4-FITC、抗CD25-PE、IgG1-FITC和IgG1-FE均为美国Becton Dickinson公司产品。
四、qPCR检测
利用TRIZOL法常规提取PBMC总RNA[13],各取2μg总RNA,按MBI逆转录试剂盒(Fermentas MBI, Sacramento,CA,USA))说明书操作,使用Platinum SYBR Green qPCR SuperMix-UGD (Invitrogen,Carlsbad,CA,USA)进行PCR反应,总反应体积20μL。Foxp3正义链5′-TTTCATGCACCAGCTCTCAATCAA-3′,反义链5′-ATGGCACTCAGCTTCTCCTTCCTTC-3′,产物长度580bp;GADPH正义链5′-AATCCCATCACCATCTTCCATCCA-3′,反义链5′-CCTGCTTCACCACCTTCTTGCTTG-3′,产物长度475bp。PCR反应条件:95℃预变性3min,Foxp3 为45个PCR循环(95℃变性30s,55℃ 退火30s,72℃延伸90s)72℃10min再延伸,GADPH为45个PCR循环72℃(95℃变性30s,55℃ 退火30s,72℃延伸90s)72℃10min再延伸。定量PCR反应产物1.5%琼脂糖凝胶上电泳30min(100V),用GDS8000型全自动凝胶成像分析系统(英国UVP公司)进行扫描分析Foxp3基因相对表达水平采用2-ΔΔCt方法计算。
五、Western blot检测
PBMC经PBS清洗,细胞溶解缓冲液溶解后,一抗是小鼠抗人β-actin抗体,二抗是HRP标记的羊抗鼠IgG,显色后采用X光片曝光,然后通过扫描及ScnImage分析系统处理,目的蛋白的相对含量即是目的蛋白条带的光密度值与β-actin条带光密度值的比值。小鼠抗人β-actin抗体和羊抗鼠IgG抗体购自上海瑞齐生物科技有限公司。
六、细胞因子检测
采用定量ELISA法测定上述预留血液的IL-4(interleukin 4)、IL-10(interleukin 10)、IFN-α(interferon-α)、IFN-γ(interferon-γ)、TGF-β(transforming growth factor-β)水平,操作严格按ELISA试剂盒(上海酶联生物公司)的使用说明进行检测。设空白对照,用酶标仪(Bio-tek instuments inc公司)在450 nm测定吸光值(A),双管检测,去掉对照A值后取其平均值。
七、统计分析
结 果
一、一般资料
慢阻肺组FEV1与对照组比较显著下降 (72.4±7.9vs98.1±8.3,P<0.01),FEV1/ FVC与对照组比较显著下降 (70.2±10.9vs97.5±15.2,P<0.01)。慢阻肺组与对照组在年龄、性别、吸烟史、FVC和PEF均无统计学差异,均P>0.0,(见表1)。
二、慢阻肺与对照组调节性T细胞亚群比较


表1 一般资料
FVC, forced vital capacity; FEV1, forced expiratory volume in one second; PEF, peak expiratory flow
表2 慢阻肺与对照组调节性T细胞亚群比较(±s, %)
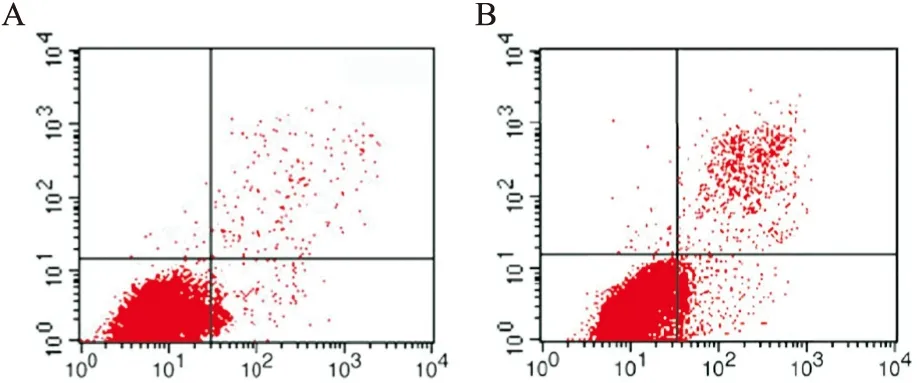
图1 流式细胞仪检测结果
A:慢阻肺组流式细胞仪检测结果;B:对照组流式细胞仪检测结果. 注: IL-4, interleukin 4; IL-10, interleukin 10; IFN-α, interferon-α; IFN-γ, interferon-γ; TGF-β, transforming growth factor-β
三、慢阻肺组与对照组Foxp3 mRNA及蛋白表达差异
研究对象均采用全自动凝胶成像分析系统进行扫描分析,两组组内的Foxp3表达条带相似,因此最终我们分别选取了1例慢阻肺患者和1例对照的条带作为示例进行比较,慢阻肺患者与对照人群PBMC中Foxp3 mRNA的表达结果(图2A),可见慢阻肺组条带显示较对照组浅。慢阻肺患者PBMC中Foxp3 mRNA表达水平与对照组比较显著低于对照组 (0.42±0.15vs0.69±0.18,P<0.01) (图2)。
所有研究对象western blot分析,两组组内的Foxp3表达条带很相似,因此最终我们分别选取了1例慢阻肺患者和1例对照的条带作为示例进行比较,慢阻肺患者与对照人群PBMC中Foxp3 蛋白表达结果(见图3A)。可见两组PBMC中Foxp3蛋白的表达趋势和Foxp3 mRNA是一致的,慢阻肺组条带显示较对照组浅。慢阻肺患者PBMC中Foxp3 蛋白表达水平与对照组比较显著低于对照组 (0.29±0.09vs0.58±0.12,P<0.01) (图3B)。
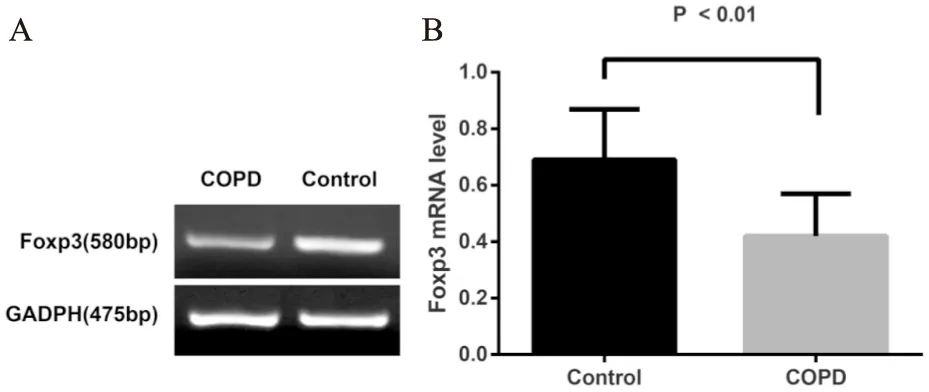
图2 RT-PCR检测两组Foxp3 mRNA表达水平
注:图A表示RT-PCR检测两组Foxp3 mRNA水平,其中1表示对照组;2表示慢阻肺组;图B表示两组Foxp3 mRNA表达水平比较
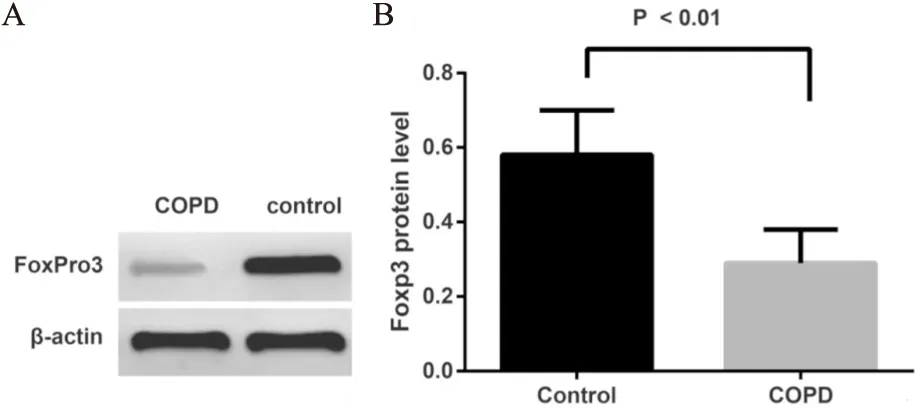
图3 Western blot 检测 两组Foxp3 蛋白水平
注:图A表示Western blot检测两组Foxp3 蛋白水平,其中1表示对照组;2表示慢阻肺组;图B表示两组Foxp3 蛋白表达水平比较
四、慢阻肺组与对照组血清细胞因子水平比较
慢阻肺患者血清IL-10浓度与对照组相比显著降低 (31.53±9.05vs34.27±11.01,P<0.05),血清TGF-β浓度与对照组相比显著降低 (161.26±32.53vs175.38±41.19,P<0.05)。慢阻肺患者血清IL-4、IFN-γ浓度低于对照组,IFN-α浓度高于对照组,但差异无统计学意义 (表3)。

表3 两组患者血清细胞因子水平比较
五、慢阻肺组Foxp3 mRNA和蛋白与肺功能指标和血清细胞因子水平的相关性
Foxp3 mRNA和蛋白与肺功能指标FEV1(%)和FEV1/FVC(%)呈一定的正相关 (P<0.05),而与FVC(%)和PEF(%)无显著相关性 (P>0.05)。Foxp3 mRNA和蛋白与血清细胞因子IL-4、IL-10、IFN-α、IFN-γ和TGF-β均呈一定的正相关 (P<0.05)。
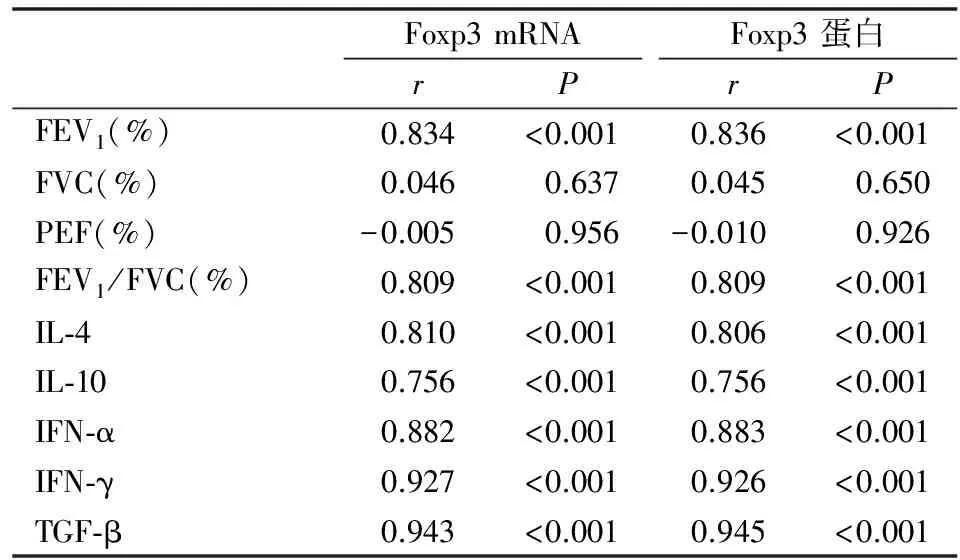
表4 慢阻肺组Foxp3 mRNA和蛋白与肺功能指标和血清细胞因子水平的相关性
讨 论


[2] 宋俊玲, 崔京巧, 刘学军. 噻托溴铵对慢性阻塞性肺疾病稳定期患者MMP-9的影响[J]. 武警后勤学院学报(医学版), 2012, 21(5):366-367.
[3] 刘先胜. 慢性支气管炎、阻塞性肺气肿、哮喘和慢阻肺概念的演变[J]. 实用医学进修杂志, 2008,1:1-5.

[5] 刘清敏, 刘景艳. 炎症细胞与慢阻肺发病机制的关系[J]. 中国实用医刊, 2004, 31(19):39-41.
[6] 王成阳, 刘向国, 彭青和, 等. 慢性阻塞性肺疾病大鼠体内调节性T细胞,Th17细胞的变化[J].安徽医科大学学报, 2014,49(1):36-39.

[9] 章颖妹, 严青, 刘辉,等. Treg 在慢性阻塞性肺疾病患者外周血及肺组织中的表达[J]. 安徽医科大学学报, 2015, 50(5):679-682
[10] 许艳静. FOXP3在正常人皮肤和表皮肿瘤中的表达及意义[D]. 山东大学, 2010,48(3): 149-151.
[11] 黄可, 沈瑛, 刘翱. 调节性T细胞在慢性阻塞性肺疾病与支气管哮喘中的作用机制研究[J]. 中华肺部疾病杂志(电子版), 2013,6(4):67-70.
[12] Sanguinetti C M, Nicolino A, Filippo A, et al. Standards of suitability for the management of chronic obstructive respiratory diseases[J]. Multidis Respir Med, 2014, 9(1):65-65.
[13] Ali M, Seyed Habibollah M, Jalal P, et al. Association between Tissue miR-141, miR-200c and miR-30b and Bladder Cancer: A Matched Case-Control Study[J]. Urology J, 2015, 12(1):2010-2013.
[14] 潘君素, 许亚亚, 梁军兵, 等. CD4~+ CD25~+ CD127~(low/-)Treg在慢性阻塞性肺疾病中的表达及意义[J]. 中华全科医学, 2014,12(6):927-929.
[15] 王文娟, 刘淑红, 姜玉荣, 等. 慢阻肺病患者免疫功能的变化[J]. 临床肺科杂志, 2012,17(8):1511-1512.
[16] Tzanakis N, Chrysofakis G, Tsoumakidou M, et al. Induced sputum CD8 + T-lymphocyte subpopulations in chronic obstructive pulmonary disease[J]. Respir Med, 2004, 98(1):57-65.
[17] 段云, 徐蓉生, 武鸿文, 等. 骨转移瘤患者~(89) SrCl_2治疗前后外周血CD4~+ CD25~+调节性T细胞及Foxp3 mRNA的表达变化[J]. 四川大学学报医学版, 2011,42(5)649-652.
[18] Lee SH, Goswami S,Grudo A,et al. Antielastin autoimmunity in tobacco smoking-induced emphysema[J]. Nat Med, 2007,13(9): 567-569.
[19] 乐新, 曾春华, 包忠宪, 等. 炎性细胞因子在过敏性紫癜血管内皮损伤中的作用机制初探[J]. 广东医学, 2005, 26(4):520-521.
[21] Wang H, Bai J, Zhang J, et al. IL-6 promotes the expression of vascular endothelial growth factor through the p38 signalling pathway in hypertrophied adenoids in children[J]. Int J Pediatr Otorhinolaryngol,2013,77(2): 205-209.
[22] Shao D, Perros F, Caramori G, et al. Nuclear IL-33 regulates soluble ST2 receptor and IL-6 expression in primary human arterial endothelial cells and is decreased in idiopathic pulmonary arterial hypertension[J]. Biochem Biophys Res Commun,2014, 451(1): 8-14.
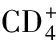
[24] 赵雪峰, 王红阳, 杨万杰. 慢阻肺患者血细胞因子水平与肺功能的相关性分析[J]. 哈尔滨医药, 2010(6):1-2.
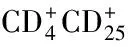
[26] Limón-Camacho L,Solleiro-Villavicencio H,Pupko-Sissa I,et al. Regulatory T cells in chronic obstructive pulmonary disease[J]. Arch Cardiol Mex, 2013,83(1):45-54.
HAOLu,ZHANGYuan
Departmentof
RespiratoryMedicine,theAffiliatedHospitalofInnerMongoliaMedicalUniversity,Huhhot,InnerMongolia010050,China
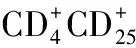
chronic obstructive pulmonary disease; pulmonary function; CD4+Treg; CD25+Treg; serum concentration; Foxp3
10.3969/j.issn.1009-6663.2017.03.002
内蒙古自治区高等学校科学研究项目(No NJZC14135)
010050 内蒙古 呼和浩特,内蒙古医科大学附属医院呼吸内科
张园,E-mail:zhangyuan160114@163.com
2016-06-14]
