放射治疗与分子靶向药物在脑转移瘤治疗中的联合应用效果分析
2017-02-10李俊陈飞
李 俊 陈 飞
放射治疗与分子靶向药物在脑转移瘤治疗中的联合应用效果分析
李 俊 陈 飞
目的 分析放射治疗与分子靶向药物在脑转移瘤治疗中的联合应用效果,为提高脑转移瘤的临床疗效提供科学依据。方法 选取60例脑转移瘤患者,所有患者均有病理明确的原发病灶且经头颅CT或头颅MRI检查确诊为脑转移瘤,按照数字表法随机分为观察组与对照组,每组30例。对照组采用全脑放射治疗方案,观察组采用立体定向放疗(IMRT)联合分子靶向药物治疗方案。结果 观察组治疗有效率为83.3%;对照组治疗有效率为26.7%,两组治疗有效率比较差异有统计学意义(P<0.05)。结论 立体定向放疗IMRT联合分子靶向药物在脑转移瘤治疗中具有较好的应用效果,能够提高临床疗效以及生活质量,改善患者的预后,具有重要的现实意义。
立体定向放疗;分子靶向药物;脑转移瘤;临床疗效
(ThePracticalJournalofCancer,2017,32:150~152)
由于放射治疗单用的疗效有限[1],因此,临床中常使用其他治疗方式进行联合治疗,以此提高临床治疗的疗效。我们主要选取60例脑转移癌患者进行研究观察,分析放射治疗与分子靶向药物的联合治疗的临床疗效,报告如下。
1 资料与方法
1.1 临床资料
选取2012年1月至2015年12月医院收诊的60例脑转移瘤患者,所有患者均有病理明确的原发病灶(经手术行样本病理学检验或内镜检测或穿刺活检[2]),且转移灶经头颅CT或头颅MRI检查确诊为脑转移瘤[3],按照数字表法随机分为观察组与对照组,每组30例。观察组30例患者中有男性16例、女性14例;年龄为(31~68)岁,平均(43.2±5.1)岁;病程0.8~3年,平均为(12.3±2.3)个月;其中肺癌18例、乳腺癌4例、食管癌2例、胃癌3例、直肠癌3例。对照组30例患者中有男性18例、女性12例;年龄为(33~70)岁,平均(45.3±4.6)岁;病程1~4年,平均为(11.6±3.1)个月;其中肺癌17例、乳腺癌5例、食管癌3例、胃癌2例、直肠癌3例。本次入选患者需满足以下条件:血常规、肝肾功能检测、电解质、心电图正常,肿瘤标志物水平显著升高[4];并排除严重肝肾功能衰竭、心肺功能不全、脑血管疾病、精神障碍、意识不清、不能配合临床治疗患者[5]。本次研究观察经医院伦理委员会审批,且所有患者及家属均对本次研究观察知情并签署同意书。两组患者临床资料差异无统计学意义,具有可比性。
1.2 治疗方法
医院所使用的是立体定向放疗系统(IMRT)。两组采用相同的放疗方式,每次2 Gy,1天1次,每周放疗5天,缓解时间为2天,根据患者脑转移瘤的大小以及部位采用不同的放射剂量(40~80 Gy)。对照组采用全脑放射治疗方案;观察组采用立体定向放疗联合分子靶向药物治疗方案,同时;联合200 mL康莱特注射液(生产企业:浙江康莱特药业有限公司;批准文号:国药准字Z10970091)静脉注射,连续注射10天;1.6 mg胸腺法新(生产企业:成都地奥九泓制药厂;批准文号:国药准字H20020545)皮下注射,连续注射10天;口服吉非替尼(生产企业:阿斯利康制药有限公司;批准文号:国药准字J20100014),1天1次,1次1片,连续服用1年。放疗同时给予患者托烷司琼预防呕吐现象,左卡尼丁治疗心肌疾病,天晴甘美改善肝肾功能[6]。
1.3 观察指标
治疗期间定期行血常规、肝肾功能、电解质、头颅CT或头颅MRI检查[7]。观察两组患者的治疗有效率、治疗前后生活质量评分以及神经系统症状积分。临床疗效参照1999年发布的实体瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST)[8]。生活质量应用生活质量自评量表[9]。神经系统症状评分参照相关文献[10]所选标准。
1.4 统计学分析

2 结果
2.1 两组患者治疗有效率
观察组完全缓解16例(53.3%)、部分缓解9例(30.0%)、稳定4例(13.3%)、恶化1例(3.4%),治疗有效率为83.3%;对照组完全缓解2例(6.7%)、部分缓解6例(20.0%)、稳定14例(46.7%)、恶化6例(20.0%),死亡2例(6.6%),治疗有效率为26.7%,两组治疗有效率比较差异有统计学意义(P<0.05),见表1。

表1 两组患者治疗有效率(例,%)
2.2 两组患者治疗前后生活质量评分
观察组与对照组治疗前生活质量评分比较差异无统计学意义,治疗后差异有统计学意义(P<0.05),见表2。
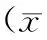
表2 两组患者治疗前后生活质量评分±s)
2.3 两组患者治疗前后的神经系统症状积分
观察组与对照组治疗前神经系统症状积分比较差异无统计学意义,治疗后神经系统症状积分差异有统计学意义(P<0.05),见表3。
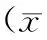
表3 两组患者治疗前后神经系统症状积分±s,分)
3 讨论
放射治疗是临床用于治疗恶性肿瘤的有效途径。据相关文献指出,在恶性肿瘤治愈患者中,有40%患者是采用放射或以放射为主的综合治疗。在肿瘤的缓解过程(palliative treatment)中,应用的治疗方案以放疗和化疗为主,能够起到较好的应用效果。根据相关统计学调查结果,超过一半肿瘤患者在临床治疗过程中,至少接受过以此放疗[11]。近些年来,随着医学技术以及医学设备的不断更新,放射治疗技术以及设备得到了有效发展,例如光子刀、质子刀、赛博刀、断层治疗以及三维适形等技术的出现,提高了放射治疗的针对性和疗效。为了能够有效控制患者的肿瘤发展,并且降低放射治疗所带来的副作用,除了应用放疗外,联合其他治疗方案成为临床治疗的目前临床医学的趋势。在临床医学中,放疗和化疗通过不同形式的联合治疗,能够有效提高恶性肿瘤患者的生存率以及局部控制率,但是由于化学药物所带来的毒副反应以及非特异性影响,导致治疗不良反应的增长,也导致了两种治疗方式在实际应用中受到了限制。
分子靶向药物是目前医学界研究重点领域。分子靶向药物的研究主要是通过选取部分与肿瘤细胞分裂、增殖有关的细胞信号介导路径中的关键酶作为药物的针对靶点,制作错具有选择针对单个或多个靶点的治疗药物,并且具有效果好、毒副作用少、特异性高的特征,成为恶性肿瘤临床治疗的重要选择。分子靶向药物在脑转移瘤中的应用主要是借助于各种对肿瘤细胞有特异性亲和力的物质,将药效限定在脑转移瘤范围内,并且对正常脑组织细胞不会起到较大的影响,从而能够有效抑制脑转移瘤的增殖、转移。分子靶向药物在临床治疗中的应用主要是通过利用肿瘤细胞与正常细胞之间的分子生物学差异,包括基因、酶、信号介导、细胞周期以及代谢方面的差异性,将药物疗效定位到靶细胞的生物分子上,能够有效抑制肿瘤细胞的增殖,从而有效降低肿瘤发展速度。其应用不仅能够有效提高药物治疗的特异性以及选择性,能够提高治疗效果,并且安全性能较高,耐药性低。
恶性肿瘤难以治疗的主要原因之一就是由于癌症细胞容易通过血液系统、淋巴系统、种植等路径发生远端转移,从而出现新的癌变病灶。相关文献指出,癌症患者出现脑转移率的发生率约为20%~40%,临床医学发现约80%脑转移瘤患者的原发病灶为肺癌[12]。放射治疗是脑转移癌的主要治疗方案之一,其能够有效提高患者的生活质量,降低头痛、恶心等神经症状,有效减轻脑水肿、颅内压增高等并发症状。文章通过研究发现,放射治疗联合分子靶向药物在脑转移瘤的临床治疗中具有较好的应用效果,值得在临床中推广使用。
[1] 杨 妤,杨新辉,苏加利,等.替莫唑胺联合全脑放疗治疗非小细胞肺癌脑转移瘤的疗效〔J〕.广东医学,2013,34(7):1115-1117.
[2] 范 兵,杜华睿,王霄英,等.转运常数(K trans)对高级别胶质瘤与脑转移瘤的鉴别诊断价值〔J〕.实用放射学杂志,2014,25(4):557-560.
[3] 程 楠,王振光,李大成,等.脑转移瘤18FFDG PET/CT和MRI的表现特点及诊断价值比较〔J〕.实用放射学杂志,2014,30(3):382-386.
[4] 徐敬慈,汪登斌,杨利霞,等.相对表观扩散系数在脑转移瘤疗效评估中的价值〔J〕.放射学实践,2014,21(5):513-516.
[5] 谭齐家,何理盛,林志雄,等.血管内皮生长因子与水孔蛋白4在胶质瘤及脑转移瘤中的表达及意义〔J〕.中华神经医学杂志,2013,8(8):813-816.
[6] 刘正豪,邓跃飞,郑眉光,等.早期诊断及手术在脑转移瘤治疗中的作用(附80例临床分析)〔J〕.中华神经医学杂志,2015,14(3):278-281.
[7] 唐 雯,凌雪英,黄 力,等.应用多体素磁共振波谱成像鉴别脑胶质瘤与单发脑转移瘤〔J〕.暨南大学学报(自然科学与医学版),2012,33(6):615-619.
[8] 李建峰,扈玉华,赵振翔,等.骨桥蛋白和CD44v6在脑转移瘤中的表达及其相关性〔J〕.中华实验外科杂志,2014,31(3):621-623.
[9] 张 旭,张亚锐,胡莹莹,等.18F-FDG PET/CT对脑转移瘤所致交叉性小脑神经机能联系不能的研究〔J〕.中山大学学报(医学科学版),2013,34(6):938-942.
[10] 丁 颖,黄晓波,王希成,等.立体定向放疗与全脑放疗局限性脑转移瘤的疗效预后分析〔J〕.中山大学学报(医学科学版),2013,29(4):453-458.
[11] Sperduto PW,Wang M,Robins HI,et al.A phase 3 trial of whole brain radiation therapy and stereotactic radiosurgery alone versus WBRT and SRS with temozolomide or erlotinib for non-small cell lung cancer and 1 to 3 brain metastases:Radiation therapy oncology group 0320〔J〕.Int J Radiat Oncol Biol Phys,2013,85(5):1312-1318.
[12] Parlak C,Mertsoylu H2,Güler OC,et al.Definitive chemoradiation therapy following surgical resection or radiosurgery plus whole-brain radiation therapy in non-small cell lung cancer patients with synchronous solitary brain metastasis:A curative approach〔J〕.Int J Radiat Oncol Biol Phys,2014,88(4):885-891.
(编辑:吴小红)
Therapeutic Effect of Radiation Therapy and Molecular Targeted Drugs in the Treatment of Brain Metastases
LIJun,CHENFei.
TheAffiliatedXiaoganHospitalofWuhanUniversityofScienceandTechnology,Wuhan,432000
Objective To analyze the effect of radiotherapy and molecular targeted therapy in the treatment of brain metastases,and to provide scientific evidence for improving the clinical efficacy of brain metastases.Methods 60 cases of patients with brain metastases were selected,all patients had histologic diagnosis of the primary lesion and by CT or MRI diagnosis of brain metastases,according to the digital table method were randomly divided into the observation group and the control group,30 cases in each group.The control group was treated with whole brain radiation therapy,and the observation group was treated with stereotactic radiotherapy combined with molecular targeted drug therapy.Results The effective rate of the observation group was 83.3%;the effective rate of the control group was 26.7%,the difference was statistically significant between the 2 groups(P<0.05).Conclusion Stereotactic radiotherapy combined with molecular target drugs in brain transfer tumor therapy has better effect,can improve the clinical efficacy and quality of life,improve the patient prognosis,has important practical significance.
Stereotactic radiotherapy;Molecular targeted drugs;Brain metastases;Clinical efficacy
432000 武汉科技大学附属孝感医院(李 俊,陈 飞);432000 孝感市中心医院(李 俊,陈 飞)
陈 飞
10.3969/j.issn.1001-5930.2017.01.047
R73-37
A
1001-5930(2017)01-0150-03
2016-03-08
2016-10-09)
