体外诱导的粘蛋白抗原特异性细胞毒性T淋巴细胞抗乳腺癌的研究
2017-02-10史鹏燕董文娟
李 帆 姬 静 史鹏燕 董文娟 刘 勇
体外诱导的粘蛋白抗原特异性细胞毒性T淋巴细胞抗乳腺癌的研究
李 帆 姬 静 史鹏燕 董文娟 刘 勇
目的 制备携带粘蛋白(MUC1)抗原基因的重组腺相关病毒(AAV/MUC1),研究其感染树突状细胞(DC)所诱导的细胞毒性T淋巴细胞(CTL)特异性杀伤肿瘤细胞的活性。方法 应用分子生物学方法制备高低度的重组腺相关病毒(AAV/MUC1)。AAV/MUC1体外感染外周血单核细胞,诱导分化为DC。DC与T淋巴细胞混合,刺激产生CTL。流式细胞技术检测DC和CTL的分化和功能指标,MTS方法检测CTL的杀伤活性和特异性。结果 成功制备的重组病毒(AAV/MUC1)滴度为6×1010拷贝/ml。感染单核细胞率为84.27%。所获得的CTL对MUC1阳性的乳腺癌细胞株的杀伤率为(46.32±0.07)%。其杀伤作用具有MUC1抗原特异性和MHC-I类分子限制性的特征。结论 以MUC1抗原为靶点的CTL可有效地杀伤乳腺癌细胞,为乳腺癌提供了一条新的治疗途径。
树突状细胞;细胞毒性T淋巴细胞;粘蛋白;腺相关病毒;乳腺癌
(ThePracticalJournalofCancer,2017,32:012~015)
粘蛋白(MUC1)又称糖类抗原CA15-3,是1种肿瘤相关抗原,具有较强的免疫原性。MUC-1在90%的乳腺癌中高表达,且MUC-1的表达量与乳腺癌患者的瘤负荷量成正相关[1-2]。肿瘤细胞表达的MUC1与正常细胞有所不同,是免疫细胞攻击的重要靶点[3]。本研究的目的是以MUC1作为乳腺癌治疗的靶点,为建立一种有效的靶向性细胞免疫治疗的方法提供理论基础。
1 材料与方法
1.1 载体、细胞和主要试剂
腺相关病毒(AAV)载体构建系统(美国阿肯色大学赠送),细胞株(ATCC公司),细胞培养基和细胞因子(Life公司),限制性内切酶和MTS试剂(Promega公司),单克隆抗体(BD公司)。引物由Invitrogen公司合成。MHC-I类分子配型相符的患者外周血细胞和MUC1抗原阳性的肿瘤组织标本来源于深圳市第二人民医院。
1.2 携带MUC1基因的重组腺相关病毒的包装和鉴定
采用常规RT-PCR方法从肿瘤组织中获得MUC1 cDNA。PCR引物序列为ATGAATTCGCCTGCCTGAATCTGTTCTG和ATGGATCCAACCTGAGTGGAGTGGAATG。采用常规的分子克隆技术,将MUC1 cDNA插入腺相关病毒载体,获得AAV/MUC1质粒后,转染293细胞,获得AAV/MUC1病毒颗粒。按照斑点杂交法检测病毒滴度。
1.3 制备MUC1抗原特异性的细胞毒性T淋巴细胞(CTL)
按照常规方法,从80 ml乳腺癌患者的外周静脉血中分离出人外周血单个核细胞,再分离出单核细胞和T淋巴细胞,在AIM-V培养基中培养。单核细胞培养体系中加入100 MOI AAV/MUC1,600 IU/ml GM-CSF以及100 IU/ml IL-4。5天后收获悬浮的DC,并与T淋巴细胞混合,并加入20 IU/ml IL-2。继续培养9天后收获细胞。
1.4 AAV/MUC1感染效率的检测
收获1.3培养的DC,按常规方法,应用流式细胞技术检测MUC1阳性细胞率,确定病毒感染单核细胞的感染率。
1.5 DC和CTL的功能检测
应用常规的流式细胞技术分别检测研究组(感染)和对照组(未感染)的细胞,DC的检测指标为CD14、CD80、CD83、CD86、IL-10和IL-12,CTL的检测指标为CD8、CD25、CD4、CD69和IFN-γ。
1.6 CTL特异性体外杀伤实验
采用常规的细胞毒性检测(MTS)方法。以上述所获得的CTL为效应细胞,MUC1阳性细胞株MCF7以及MUC1阴性细胞株LNCap、HepG2为靶细胞[4-6],细胞混合培养6 h后,测定OD值。计算效应细胞的杀伤率。
1.7 统计学分析
应用PASW Statistics 18统计软件。计量方法采用2组数据的比较均值t检验。
2 结果
2.1 AAV/MUC1质粒构建及其病毒鉴定结果
RT-PCR结果如图1A所示,MUC1 cDNA长度为927bp,与电泳结果一致。所构建的AAV/MUC1质粒的酶切鉴定结果如图1B所示,在927bp的位置出现阳性条带,证明载体构建成功。如图2所示,AAV/MUC1的斑点深浅与6×1010copys/ml的标准品相近,因此确定所获得的AAV/MUC1病毒滴度为6×1010copys/ml。
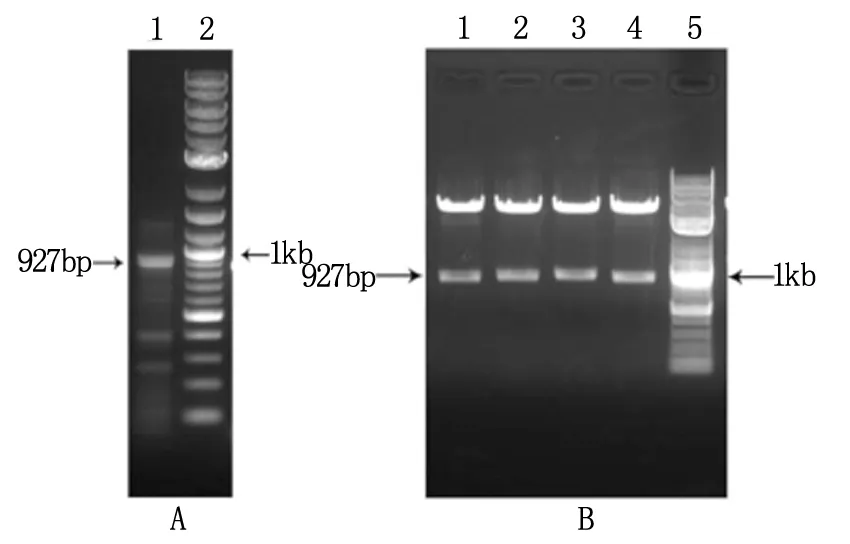
A为MUC1 cDNA PCR扩增结果电泳图;B为重组 MUC1腺相关病毒载体的双酶切鉴定结果图;1-4 为酶切结果;5为核酸Marker(0.1~10kb)。图1 电泳图

图2 斑点杂交法检测AAV/MUC1病毒滴度结果
2.2 AAV/MUC1的感染率
如图3所示,AAV/MUC1感染后的DC,其MUC1抗原的表达率为84.27%,即病毒的感染率。
2.3 DC的功能检测结果
AAV/MUC1感染的DC表达CD80、CD83、D86和IL-12的平均水平分别为88.23%、80.64%、88.81%和72.69%,明显高于对照DC(P<0.01),而CD14(5.76%)以及IL-10(3.06%)水平无明显差别(P>0.05),提示受病毒感染的DC的成熟度,抗原提呈功能较好,并倾向于刺激CTL产生。
2.4 CTL的功能检测结果
在AAV/MUC1感染的DC所激活的CTL中,CD69+CD8+双阳性细胞的平均百分率为58.22%,明显高于对照组(34.08%,P<0.01),提示具有杀伤活性的CTL较多。而CD25+CD4+双阳性的Treg细胞的平均百分率为7.83%,与对照组(11.56%)比较无显著性差异(P>0.05)。
2.5 CTL表达的γ干扰素(IFN-γ)水平的检测结果
与对照组相比,AAV/MUC1感染的DC所激活的CTL的IFN-γ表达水平较高,平均为44.26%,明显高于对照组(20.34%),表明CTL的杀伤活性较高(P<0.01)。
2.6 CTL的特异性体外杀伤实验结果
如图4A所示,AAV/MUC1感染的DC所激活的CTL能有效地杀伤(裂解)MUC1阳性的乳腺癌细胞,对MCF7细胞株的杀伤率为(46.32±0.07)%,而对MUC1阴性的细胞株(LNCap和HepG2)没有明显的杀伤作用,杀伤率为(11.40±2.99)%和(9.94±3.33)%,而无AAV激活的CTL,其对MCF7的杀伤率为(12.47%±3.68)%。MCF7细胞组的杀伤率与其它组相比较存在显著性差异(P<0.01)。如图4B所示,在进行杀伤试验之前,加入MUC1抗体或MHC-I类分子抗体,均可有效地抑制CTL杀伤肿瘤细胞的活性,杀伤率分别下降为(10.80±4.01)%和(10.91±3.29)%,与上述结果均存在显著性差异(P<0.01)。

A为AAV/MUC1感染后的DC;B为对照组DC。图3 流式细胞仪检测MUC1抗原表达情况

A横坐标以AAV/MUC1+MCF7为例,其代表的是AAV/MUC1激 活的CTL对MCF7的杀伤活性;B中MUC1抗体和MHC-I抗体代表CTL与MCF7混合前添加MUC1抗体或MHC-I类分子抗体。图4 CTL的特异性体外杀伤实验结果
3 讨论
MUC1在正常细胞表达较弱或无表达,但在包括乳腺癌的多种肿瘤组织中高表达。由于癌组织中的MUC1糖基化不完全,使得MUC1核心蛋白暴露在细胞表面,容易为免疫系统发现,且免疫原性较强,因此,MUC1是较理想的免疫攻击的靶点。目前,将MUC1作为免疫治疗靶点的研究却很少。本研究的创新性在于将MUC1基因克隆至AAV病毒载体中,并制备相应的感染性病毒。被感染的DC将MUC1抗原信息提呈给T淋巴细胞,刺激其分化成为特异性杀伤乳腺癌细胞的CT。此研究结果具有临床应用价值。
AAV载体是已知的最安全的病毒载体,不导致任何人体生理改变或病理变化。美国国立卫生研究院(NIH)和食品及药品管理局(FDA)连续多年宣布AAV是用于基因治疗的最安全的病毒载体。AAV病毒本身免疫原性极低,而且本研究证实其对单核细胞具有较高的感染率(84.27%),明显高于通常的15%~30%蛋白转染效率。因此,无论是实验室研究和临床应用,通过AAV携带抗原基因感染DC是DC负载抗原的最佳方法之一。
CD83分子是成熟DC的标志物,共刺激分子CD80和CD86是激活T淋巴细胞的必要信号[7]。这些CD分子表达水平与DC的成熟度和诱导细胞免疫反应等功能直接相关。DC的IL-12 的表达水平与DC诱导细胞免疫反应呈正相关,而IL-10的表达水平与DC诱导免疫抑制反应呈负相关[8]。本研究结果表明被AAV/MUC1感染的DC与对照组相比,CD80,CD83和CD86分子的表达水平显著性地提高,提示DC具有强大的诱导细胞免疫反应的能力。本研究发现的高水
平的IL-12表达,低水平的IL-10表达,证明被AAV/MUC1感染的DC倾向于激发细胞免疫反应,产生CTL。
在T淋巴细胞亚群中,CD25+CD4+细胞代表的是调节性T淋巴细胞(Regulatory T cell,Treg),其功能是抑制细胞免疫反应。CD69+CD8+细胞则代表被激活的CD8阳性T细胞[9],即CTL,其主要功能是特异性裂解抗原阳性的靶细胞,具有MHC-I类分子限制性。在AAV/MUC1感染的DC刺激的T淋巴细胞亚群中,CD8+CD69+T细胞数量明显增多,而CD25+CD4+Treg细胞数量减少,有利于CTL发挥最大的裂解靶细胞作用。抗原激活成熟的CD8淋巴细胞分泌IFN-γ,IFN-γ是免疫应答的正向调节剂,不仅能通过多种机制上调免疫应答,且能直接杀伤肿瘤和病毒感染的细胞[10]。本研究所获得的CTL高表达IFN-γ,证明该CTL杀伤(裂解)乳腺癌细胞的功能较强。
针对肿瘤细胞的杀伤实验证明,AAV/MUC1感染的DC所激活的CTL对于MUC1阳性的乳腺癌细胞具有较强的杀伤(裂解)作用,但对于该抗原阴性的细胞无杀伤作用。进一步地,在杀伤实验之前,分别以MUC1抗体和MHC-I类分子抗体封闭乳腺癌细胞之后,CTL对于乳腺癌细胞的杀伤作用被抑制。本研究证明该杀伤作用具有MUC1抗原特异性,即靶向性,且具有MHC-I分子限制性的。CTL的杀伤作用特征明显。
本研究证明AAV/MUC1感染的DC及其激活的CTL功能较强,且CTL能有效地杀伤MUC1抗原阳性的乳腺癌细胞,杀伤作用具有特异性、靶向性特征。因此本研究结果为今后的临床应用奠定了基础。
[1] McGuckin MA,Walsh MD,Hohn BG,et al.Prognostic significance of MUC1 epithelial mucin expression in breast cancer〔J〕.Hum Pathol,1995,26(4):432-439.
[2] 康美和,熊汉鹏.MUC1基因,CA15-3与肺癌的临床研究进展〔J〕.江西医药,2008,43(2):166-169.
[3] Soares MM,Mehta V,Finn OJ.Three different vaccines ba- sed on the 140-amino acid MUC1 peptide with seven tandemly repeated tumor-specific epitopes elicit distinct immune effector mechanisms in wild-type versus MUC1-transgenic mice with different potential for tumor rejection〔J〕.J Immunol,2001,166(11):6555-6563.
[4] Ren L,Marquardt MA,Lech JJ.Estrogenic effects of nonylphenol on pS2,ER and MUC1 gene expression in human breast cancer cells-MCF-7〔J〕.Chem Biol Interact,1997,104(1):55-64.
[5] Joshi MD1,Ahmad R,Yin L,et al.MUC1 oncoprotein is a druggable target in human prostate cancer cells〔J〕.Mol Cancer Ther,2009,8(11):3056-3065.
[6] Yu C1,Hu Y,Duan J,et al.Novel aptamer-nanoparticle bi- oconjugates enhances delivery of anticancer drug to MUC1-positive cancer cells in vitro〔J〕.PLoS One,2011,6(9):e24077.
[7] 高 超.CD83 分子的研究进展〔J〕.现代免疫学,2008,28(15):433-436.
[8] 孙 敬,洪杰华,郑世民.IL-12及其免疫调节作用〔J〕.动物医学进展,2010,31(2):111-114.
[9] 申 蓉,李丽珍.CD69与免疫功能的调节〔J〕.国外医学(免疫学分册),2004,27(1):24-27.
[10] Boehm U1,Klamp T,Groot M et al.Cellular responses to interferon-gamma〔J〕.Annu Rev Immunol,1997,15(15):749-795.
(编辑:吴小红)
Research on MUC1 Antigen-specific Cytotoxic T Lymphocytes for Breast Cancer
LIFan,JIJing,SHIPengyan,etal.
ShenzhenImmuclinBiomedIncorporated,Shenzhen,518000
Objective To study recombinant adeno-associated virus with human MUC-1 antigen gene(AAV/MUC1),and observe anti-tumor cell effects of MUC1 antigen-specific cytotoxic T lymphocytes(CTL)stimulated by dendritic cells(DC)infected by AAV/MUC1.Methods High titers of infectious AAV/MUC1 were packaged with molecular biological methods.After the monocytes were infected by AAV/MUC1,the dendritic cells(DC)were induced and generated.To generate CTL the DC were mixed with T lymphocytes.Function of the DC and CTL were detected by flow cytometry.Killing activity of the CTL against the breast cancer cells was tested by MTS.Results AAV/MUC1 was successfully generated with titers at 6×1010copies/ml.The infection rate in monocytes was 84.27%.The killing rates of the CTL were(46.32±0.07)%.The killing activity was MUC1 antigen-specific and MHC class I molecule-restricted.Conclusion MUC1 antigen-specific CTL’s effectiveness in killing breast cancer cell provides a new option in breast cancer treatment.
Dendritic cells;Cytotoxic T lymphocytes;MUC1;Adeno-associated virus;Breast cancer
深圳市战略新兴产业发展专项资金(编号:JSGG20141118110447437)
518000 深圳益世康宁生物科技有限公司(李 帆,姬 静,史鹏燕,董文娟);518000 深圳市第二人民医院(姬 静);518000 深圳北京大学香港科技大学医学中心(刘 勇)
刘 勇
10.3969/j.issn.1001-5930.2017.01.004
R737.9
A
1001-5930(2017)01-0012-04
2016-08-19
2016-12-15)
