BMPR1B基因在细毛羊皮肤毛囊中的表达及与羊毛性状关系的研究
2017-02-10王小佳贺建宁刘开东刘积凤
王小佳,贺建宁,程 明,刘开东,刘积凤,柳 楠*
(1. 青岛农业大学动物科技学院,山东青岛 266109;2. 青岛畜牧兽医研究所,山东青岛 266100)
BMPR1B基因在细毛羊皮肤毛囊中的表达及与羊毛性状关系的研究
王小佳1,贺建宁1,程 明2,刘开东2,刘积凤1,柳 楠1*
(1. 青岛农业大学动物科技学院,山东青岛 266109;2. 青岛畜牧兽医研究所,山东青岛 266100)
本研究旨在探讨BMPR1B基因在皮肤毛囊的表达及与羊毛性状的关系,为解析其对羊毛相关性状的调控机理奠定理论基础。以敖汉细毛羊为研究材料,分别采集肩部(多毛区)和腹股沟部(少毛区)皮肤组织样。通过基因芯片技术,分析BMPR1B基因在皮肤不同部位表达量的差异;应用实时荧光定量PCR技术,检测BMPR1B基因在细毛羊肩部的表达量,并与羊毛性状和毛囊密度进行关联性分析;应用免疫组化方法,定位BMPR1B基因在细毛羊毛囊中表达的位置。结果表明:BMPR1B基因在肩部和腹股沟部均有表达,且在肩部表达量较高,差异倍数在2倍以上(P<0.05);关联分析显示,BMPR1B基因的mRNA表达量与羊毛细度呈显著正相关,相关系数为0.382(P<0.05);免疫组化结果显示,BMPR1B基因在细毛羊皮肤中,主要表达于表皮上皮细胞和内根鞘细胞中。综上,可推测在内根鞘中表达的BMPR1B基因,可能对羊毛细度具有调控作用,这可对细毛羊的育种实践提供理论参考。
细毛羊;皮肤;BMPR1B;表达;羊毛性状
羊毛细度、长度和纤维强力是影响羊毛品质的重要经济性状,受多种因素影响,其中遗传因素起着重要作用,但目前关于调控羊毛性状的主效基因研究还鲜有报道。
骨形态发生蛋白家族(Bone Morphogenetic Proteins,BMPs)是一族独特的糖蛋白,具有诱导IOPC(Inducible Osteogenic Precursor Cells)类细胞向成骨细胞方向转化的特性[1]。研究显示,BMPs在造血组织、皮肤附属物等的形成和分化以及脂肪、肾脏、肝脏、骨骼及神经系统发育中起一定作用[2-3],且其可通过控制毛基质前体细胞的增殖和分化,进而调控毛囊形态发生、出生后毛囊再生和毛囊的周期循环[4]。研究发现,BMPs家族受体分为Ⅰ型和Ⅱ型[5],BMPs可以结合不同的Ⅰ型受体,其信号传递具有多样性,并且由Ⅰ型受体决定其信号传递的特异性[6]。其中,BMPR1B属于BMPs家族的Ⅰ型受体成员,参与调节BMP信号对细胞分化和凋亡的诱导过程,还与骨生成和动物的繁殖性能有密切的关系[7]。报道指出,在成年人表皮中,发现BMPR1B基因在上基部的角质细胞和毛囊中表达[8]。尹俊[9]构建了绒山羊105 d胚胎体侧部皮肤的cDNA文库,通过ESTs研究绒山羊皮肤的基因表达谱,从而发现BMPR1B 基因与绒毛生长有关。李荣等[10]研究发现,在绒山羊胚胎期的上皮细胞和毛囊中,以及出生后毛囊生长的兴盛期、退行期和休止期,均有BMPR1B基因的表达,这表明其在毛囊的形态发生以及出生后毛囊的发育、分化过程中都具有重要意义。
综上研究推测,BMPR1B基因可能对细毛羊的羊毛性状具有调控作用,但尚无相关研究报道。本研究旨在通过对敖汉细毛羊皮肤毛囊中BMPR1B基因表达量变化和表达位置定位的进行,并将表达量与羊毛性状进行关联分析,以期揭示BMPR1B基因与羊毛生长发育的关系,进而为应用分子生物学技术提高羊毛的经济性状提供理论依据。
1 材料与方法
1.1 实验材料 实验用敖汉细毛羊来自青岛奥特种羊场,饲养管理条件一致,选择健康的周岁母羊39只。于9月份(剪毛后3个月)在每只羊体侧肩胛处,紧贴皮肤剪取2 cm2毛样,存放在封口袋内,用于羊毛性状测定;在每只羊的肩部(多毛区)和腹股沟部(少毛区)分别剪取2份2 cm2皮肤组织样品,一份放入1.5 mL冻存管中,并置入液氮中保存,用于基因芯片和实时荧光定量PCR检测;另一份投入4%多聚甲醛溶液固定,用于石蜡切片制作,进行毛囊密度统计和免疫组化实验。
1.2 实验仪器和试剂 OLympus BX51正置显微镜(日本奥林巴斯公司生产),leica RM2235切片机(德国莱卡公司生产),核酸蛋白分析仪(德国EPPendorf公司生产),EDC-810PCR 仪(东胜创新生物科技有限公司生产),DYY-11 型电泳仪(北京市六一仪器厂生产),DNR凝胶成像仪(以色列生产),Roche Light Cycler 480Ⅱ荧光定量PCR系统(罗氏生产),Feather micro blade R35切片刀(日本羽毛公司生产),染色架、湿盒(北京益利精细化学品有限公司生产)。琼脂糖、溴化乙锭(EB)、DEPC、DAPI等均购自青岛赛尚科贸有限公司,TriPure RNA Isolation Reagent,SYBR@Premix EX TaqTMⅡ( 2×)(均为罗氏生产),Thermoscientific RevertAid Firststrand cDNAsynthesis Kit,DNA ladder 2 000,Dream TaqTMgreen PCR Master Mix(2×)(北京索莱宝科技有限公司生产),一抗:Rabbit Anti-BMPR1B antibody(bs-6639R)(博奥森生产),二抗:Anti-Rabbit Igg (whole moLecule)–FITC(Sigma生产),PBS溶液,无水酒精,枸橼酸缓冲溶液,二甲苯,中性树脂,4%多聚甲醛,苏木素,伊红,石蜡,抗荧光衰减封片剂。
1.3 RNA的提取和检测 选取肩部与腹股沟部皮肤组织样品120 mg,加入1 mL的TRNzol(Roche)试剂粉碎匀浆后抽提RNA。使用德国EPPendorf公司Bio-Photometer型核酸蛋白测定仪测定其浓度和纯度,用于实时荧光定量PCR测定。
1.4 差异基因筛选 使用安捷伦科技公司提供15 208个cDNA探针进行芯片杂交,应用Genepix4 000B芯片扫描仪扫描芯片的荧光强度,并将实验结果转换成数字型数据保存,通过Agilent Gene Spring GX Software 7.3 进行分析。分析得到BMPR1B基因肩部和腹股沟部的表达量,利用t检验法进行差异显著性分析,并计算肩部与腹股沟部的表达差异倍数。
1.5 实时荧光定量PCR检测 对39只羊肩部皮肤组织的RNA进行抽提,用反转录试剂盒将抽提的RNA逆转录成cDNA。根据绵羊BMPR1B基因( GenBank登录号NM_001009431.1)和绵羊GAPDH基因( GenBank登录号NM001190390)的序列,使用Primer5.0软件设计引物(表1)。
荧光定量PCR仪器型号为罗氏Roche light Cycler 480Ⅱ。PCR反应程序:94℃预变性10 min;94℃变性30 s,60℃退火30 s,72℃延伸40 s,40个循环。每个样品设置3次重复,采用CT(2-△△CT)值法计算各样本中肩部BMPR1B相对于内参基因GAPDH的表达量。

表1 BMPR1B和 GAPDH基因的引物信息
1.6 石蜡切片制作 将甲醛中固定好的组织取出,修整成5 mm×5 mm×3 mm的组织块。用PBS溶液浸泡组织块共10 h,每间隔1 h更换1次。然后浸于50%的酒精40 min,置于70%酒精过夜。浸于80%酒精3~4 h,95%的酒精(Ⅰ)和(Ⅱ)各2 h,无水酒精(Ⅰ)和(Ⅱ)各1 h,逐级脱水,继而用二甲苯透明。接着浸蜡,依次用石蜡(Ⅰ)、石蜡(Ⅱ)、石蜡(Ⅲ)浸蜡3次,每间隔1 h更换1次,用小纸盒包埋组织块。修整完全凝固的蜡块,之后固定于切片机上连续切片,切片厚度为5 μm,一共切得2套切片,一套用于免疫组化染色,一套用于空白对照实验。
1.7 免疫组化 将烘箱设置为58℃,烘片12 h。取出脱蜡和水化后,浸于PBS溶液10 min。抗原修复盒中加入0.01 mol/L枸橼酸钠缓冲液,置于水浴锅中加热至99℃,把玻片完全浸入,持续15 min,继而自然冷却至室温。PBS溶液洗7 min×3次,小心拭去玻片上多余液体,滴加适量山羊封闭血清,覆盖组织片即可,放于湿盒后,置于37℃的恒温箱中静置20 min。取出后倾去多余的封闭血清,滴加一抗(兔抗绵羊BMPR1B),以1:150的浓度稀释,用PBS溶液代替一抗,作为阴性对照,小心置4℃冰箱中过夜。PBS溶液洗7 min×3次,继续滴加FITC标记的山羊抗兔IgG,放于湿盒后置于37℃的恒温箱中静置30 min。PBS溶液洗7 min×3次,滴加DAPI,放入湿盒后可置于37℃的恒温箱中静置5 min。PBS溶液洗7 min×3次,抗荧光衰减封片剂进行封片处理,继而荧光显微镜镜检及拍片。
1.8 羊毛性状与毛囊密度测定 羊毛性状主要是对羊毛细度、羊毛长度和单纤维强力进行测定。羊毛细度使用OFDA2 000 细度分析仪测定,方法参照SN/T0478-2003;羊毛长度测定方法参照GB/ T14270-2008;单纤维强力使用单纤维强力测试仪测定,方法参照GB/T4711-1984;毛囊密度测定采用肩部皮肤组织,经石蜡包埋后连续切片,经HE染色后,显微镜镜检,放大200倍的条件下,每个个体分别选取10个不同的视野范围,用计数器统计每个视野内的毛囊个数,逐一记录毛囊密度数据。
1.9 统计分析 利用SPSS17.0软件,对羊毛性状和毛囊密度之间,以及BMPR1B基因mRNA表达量与羊毛性状及毛囊密度进行双变量双侧相关性检验,结果均以平均值±标准差表示。
2 结果与分析
2.1 基因芯片分析 通过基因芯片分析,可知BMPR1B基因在敖汉细毛羊肩部和腹股沟部均有表达,在肩部(多毛区)的相对表达量高于腹股沟部(少毛区),且其相对表达差异倍数为2.073(P<0.05),初步推测此基因可能对细毛羊毛囊的生长发育具有一定的促进作用。
2.2 BMPR1B基因PCR扩增结果 由图1可知,引物扩增的条带清晰且单一,产物大小约为125 bp和167 bp,与目的片段大小一致,可以用于后续的荧光定量PCR实验。
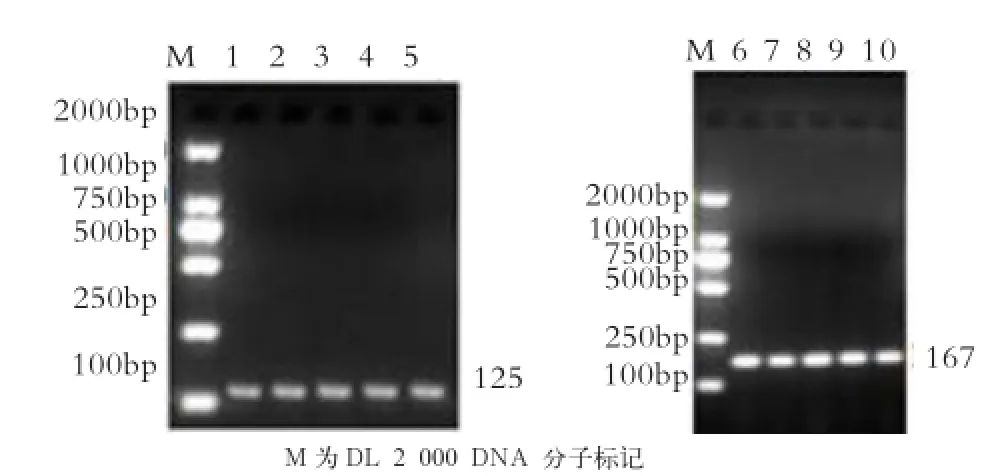
图1 GAPDH和BMPR1B基因PCR扩增
2.3 实时荧光定量PCR结果 由图2可见,BMPR1B和内参基因GAPDH的熔解曲线峰值图上只有1个明显的峰,表明在实时荧光定量PCR过程中荧光信号均来自特异性扩增产物,BMPR1B和内参基因GAPDH均没有产生非特异性扩增及引物二聚体,引物可以用来进行下一步实验。如表2所示,BMPR1B基因mRNA的相对表达量在不同个体间存在差异,相对表达量处于0.11~3.05之间。
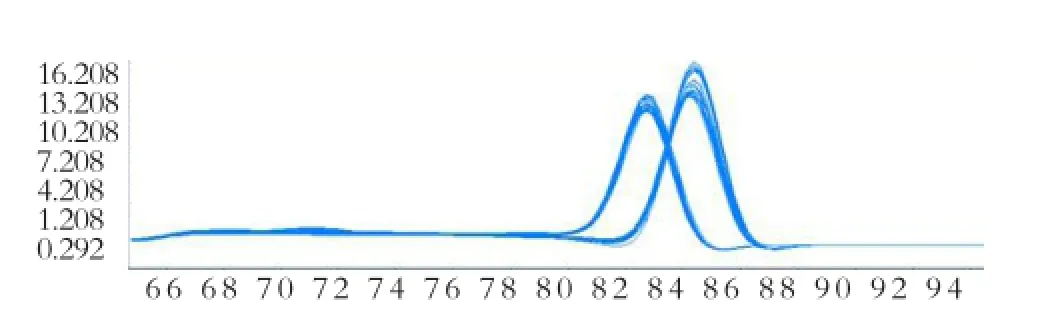
图2 BMPR1B和GAPDH熔解曲线峰值图
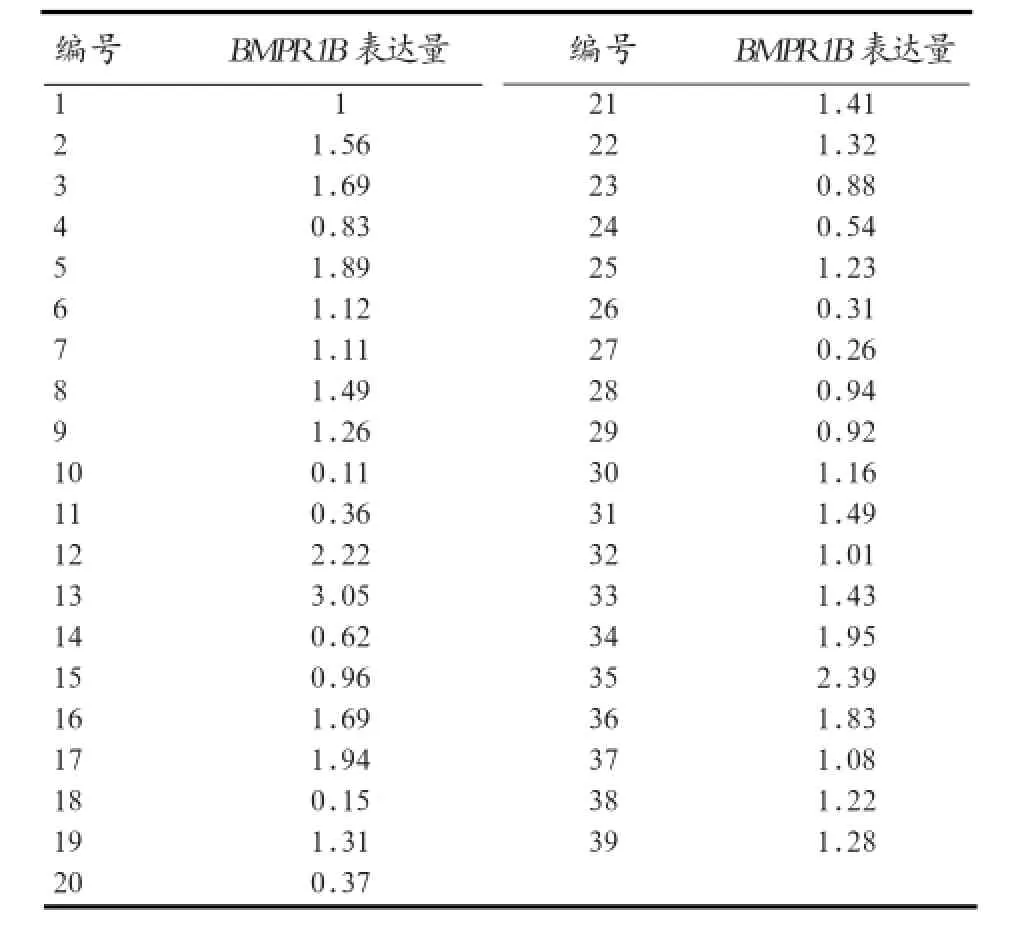
表2 BMPR1B基因mRNA表达量

图3 细毛羊皮肤毛囊中BMPR1B蛋白的表达特征
2.4 免疫组化结果分析 由图3可知,在敖汉细毛羊皮肤毛囊中,BMPR1B蛋白主要在表皮上皮细胞和内根鞘细胞中表达,揭示BMPR1B基因可能在这些部位对毛囊起作用。
2.5 羊毛性状与毛囊密度测定结果 由表3可知,羊毛长度测量值为4.45~7.88 cm,平均值为5.87 cm(此为3个月内生长出的羊毛长度),标准差为0.93 cm;羊毛细度测量值为14.82~22.99 μm,平均值为19.25 μm;羊毛单纤维强力测量值为4.31~6.24 cN,平均值为5.16 cN;毛囊密度测量值为80.40~132.20根/mm2,平均值106.38根/mm2。

表3 羊毛性状与毛囊密度测量值
2.6 关联性分析结果 由表4可知,羊毛长度与羊毛细度呈显著正相关(P<0.05),相关系数为0.348,说明羊毛长度与羊毛细度有密切关联,推测羊毛细度越细,羊毛长度越短。其他性状之间没有显著性相关关系。由表5可知,BMPR1B基因与羊毛细度呈显著正相关(P<0.05),相关系数为0.382,而与羊毛长度、单纤维强力和毛囊密度没有显著性相关关系,表明BMPR1B基因可能对羊毛细度有影响,对羊毛长度、单纤维强力和毛囊密度可能没有影响或影响较小。
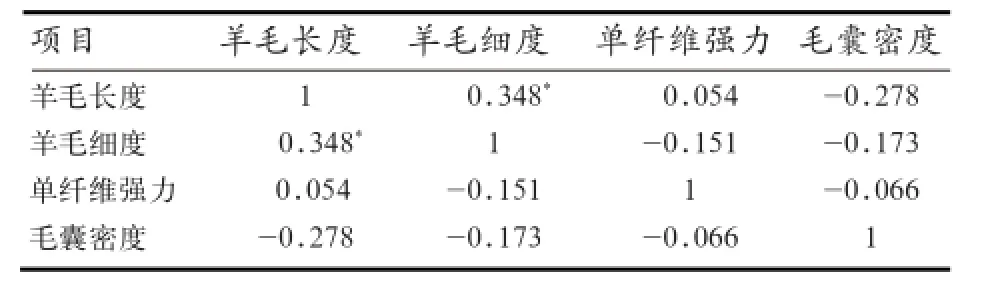
表4 羊毛性状与毛囊密度的相关性分析

表5 BMPR1B基因表达量与羊毛性状和毛囊密度相关性
3 讨 论
ChristoPher等[11]研究发现,在伤口愈合时,BMPs可抑制再生皮肤上皮细胞中角细胞的增殖、重组和迁移。报道指出,BMPs信号可维持上皮的内环境稳态,调控上皮细胞的增殖与分化,还能够控制毛发角质细胞中的细胞增殖,进而调控生长期毛囊毛乳头的大小,以及毛发类型和毛纤维直径。此外,BMPs信号对毛囊的分化、发育以及毛干的生长都有一定影响,是与毛囊周期性相关的典型信号通路[12],其家族成员在毛囊中的表达方式比较复杂,无论是在胚胎期的毛囊形成,还是在出生后毛囊循环周期中都发挥重要作用。研究证实,BMPR1B基因参与调节BMPs信号对细胞分化和凋亡的诱导过程,在神经祖细胞的增殖与分化过程中,BMPs先是通过BMPR1A受体途径促进神经祖细胞的增殖,然后通过BMPR1B受体途径诱导神经祖细胞的分化[13]。目前研究显示,在出生后的第1个毛发周期中,BMPR1A或BMPR1A在内根鞘有特异性的转录,且BMPR1A基因还能够参与调节毛囊角质化细胞的增殖,在毛囊的程序性细胞凋亡和周期性变化中发挥一定作用[14]。
本研究芯片结果显示,BMPR1A基因在细毛羊肩部的表达量显著高于腹股沟部,初步推测此基因可能对毛囊的生长发育有促进作用,当其表达量低于一定值则会抑制毛囊和羊毛的生长发育。有研究显示,BMPs家族成员对毛囊的发生发育有促进作用[15],与本研究结果一致,说明BMPR1A基因与细毛羊毛囊的生长发育有密切关系。
目前尚未发现有关BMPR1A基因的表达量与羊毛性状和毛囊密度之间关系的研究报道,本实验可对此起到补充作用。将BMPR1A基因的表达量分别与羊毛性状和毛囊密度进行关联性分析,结果得出,BMPR1A基因的mRNA表达量与羊毛细度呈显著正相关,相关系数为0.382,而与羊毛长度、单纤维强力和毛囊密度没有显著性相关关系,推测BMPR1A基因可能对羊毛细度有影响,但对影响羊毛长度、单纤维强力和毛囊密度的作用微小或没有作用。BMPR1B基因与羊毛细度的关联性,与羊毛的生长发育、羊毛产量及品质等是否存在其他内在联系还需进一步探究。
本研究发现,在敖汉细毛羊皮肤毛囊中,BMPR1A蛋白主要表达于表皮上皮细胞和内根鞘细胞。李荣[10]研究表明,BMPR1A基因在胚胎期75 d的上皮细胞和毛乳头细胞中表达,出生后在内根鞘和毛干中都有表达,与本实验结果不尽相同,可能是由于BMPR1A基因在细毛羊与绒山羊毛囊中存在不同的表达机制。
本实验对细毛羊肩部的羊毛细度、长度和单纤维强力进行测定,测定方法参考细毛羊育种生产实际。羊毛细度测量值为14.82~22.99 μm,主体在17~20 μm,属于70~80支的细毛羊。梅花[16]测得两周岁的敖汉细毛羊平均毛细度为65.32支,即处于20.1~23.0 μm之间,与本实验所得羊毛细度数据有些差别,主要是因为本实验群体来自于超细毛品系群体。对羊毛性状和毛囊密度间双变量双侧相关性分析得出,羊毛长度与羊毛细度呈显著正相关,相关系数为0.348,说明羊毛长度与细度有密切关联,随着羊毛长度的增长,羊毛纤维细度越粗;反之,羊毛长度越短,其细度越细,这与实际情况相一致,在细毛羊育种实践中应予以重视。综上结果表明,BMPR1A基因对细毛羊毛用性状有一定影响,与羊毛细度关系密切,而与羊毛长度和强度关系甚小或无关系,其具体的内在联系还需进一步研究。
4 结 论
BMPR1A在细毛羊肩部皮肤的表达量高于腹股沟部,且在肩部的表达量与羊毛细度呈显著正相关;BMPR1A蛋白在细毛羊皮肤毛囊中,主要表达于表皮上皮细胞和内根鞘细胞。综上,推测在内根鞘中表达的BMPR1A基因,可能参与了羊毛细度的调控,可为细毛羊的分子育种提供参考。
[1] 杨宁, 陈增海, 栾怡, 等. 骨形态发生蛋白的研究进展[J].山东大学学报:医学版, 2004, 42(2): 244-248.
[2] 何晓曼. BMP家族成员在毛囊生长发育方面的研究[J].新疆畜牧业, 2011, (6): 36-37.
[3] 李森, 靳安民, 付国建, 等. 被动训练对兔冈上肌腱急性断裂术后腱-骨修复中BMP-2表达的影响[J]. 重庆医学, 2010, 39(15): 1985-1987.
[4] Pisal R, Kapil D, Daniel D, et al. Signaling Ⅰnvolved in Hair Follicle Morphogenesis and Development[J]. MolSci, 2014, 15(1): 1647-1670.
[5] Horbelt D, Denkis A, Knaus P. A portrait of Transforming Growth Factor β superfamily signalling: Background matters [J]. Ⅰnt J Biochem Cell B, 2012, 44(3): 469-474.
[6] 徐慧慧, 齐艳丽, 顿嵩,等. 骨形成蛋白7通过激活Ⅰ型受体BMPR1A,BMPR1B抑制肺大细胞癌NCⅠ-H460细胞的增殖[J]. 中国肺癌杂志, 2010, 13(7): 659-664.
[7] 贾伟, 张龚炜, 陈仕毅,等. 家兔BMPR1B基因多态性及其与生长速度的相关性分析[J]. 西南农业学报, 2014, 27(4): 1781-1785.
[8] Hwang E A , Lee H B, Tark K C. Comparison of bone morphogenetic protein receptors expression in the fetal and adult skin[J]. Yonsei Med J, 2001, 42(6): 581-586.
[9] 尹俊, 李金泉, 郭志成,等. 内蒙古绒山羊105d胎儿皮肤的基因表达[J]. 畜牧兽医学报, 2005, 36(11): 1121-1124.
[10] 李荣. 内蒙古绒山羊BMP-4,BMPR-ⅠB 基因cDNA 的克隆及BMPR-ⅠB 在皮肤毛囊中的表达[D].呼和浩特: 内蒙古农业大学, 2007: 43-44.
[11] Christopher J, Andrei N, Krzysztof P, et al. Bone morpho -genetic protein signaling suppresses wound-induced skin repair by inhibiting keratinocyte proliferation and migration[J]. J Ⅰnvest Dermatol, 2014, 134(3): 827-837.
[12] 许永安, 付小兵. 毛囊干细胞增殖与分化相关信号通路研究进展[J]. 中国修复重建外科杂志, 2010, (2): 161-164.
[13] Panchison D M, Pickel J M, Studer L, et al. Sequential action of BMP receptors control neural precursor cell production and fate[J]. Genes Dev, 2001, 15(16):2094-2110.
[14] 顾华. BMP-4对人毛囊外根鞘细胞增殖和迁移的影响[J].皮肤病与性病, 2012, 34(4): 187-189.
[15] 陈兴勇, 谢珊珊, 周丽,等. 皖西白鹅换羽前后基因表达谱差异分析[J]. 畜牧兽医学报, 2013, 44(7): 1030-1036.
[16] 梅花. 敖汉细毛羊主要经济性状的遗传力估计[J]. 家畜生态学报, 2011, 32(4): 13-14.
Expression of BMPR1B Gene in Skin and Its Association with Wool Traits in Fine Wool Sheep
WANG Xiao-jia1, LⅠU Kai-dong2, HE Jian-ning1, CHENG Ming2, LⅠU Nan1*
(1.College of Animal Science and Technology, Qingdao Agricultural University, Shandong Qingdao 266109, China; 2. Qingdao Ⅰnstitute of Animal Science and Veterinary Medicine, Shandong Qingdao 266100, China)
The study aimed to identify expression of BMPR1B gene and the relationship with wool traits, the results would lay theoretical foundation for understanding the regulation mechanism of BMPR1B gene in wool traits. AoHan fne-wool sheep were selected as the research material, skin tissues were selected from shoulder (rich wool) and belly (poor wool). Firstly, gene microarray was used to screen the diferences of expression level of BMPR1B gene in diferent parts of the skin; Then qRT-PCR was used to determine the expression level of BMPR1B gene in shoulder, and the association between wool traits, follicles density and expression levels were also analyzed; the location of BMPR1B protein in hair follicles was determined by immunohistochemical detection. Results showed that, the BMPR1B gene was expressed in both shoulder and belly,and the expression level in shoulder was more two times higher than in belly (P<0.05).The association results showed that, the mRNA expression level of BMPR1B gene was positive associated with wool fineness,the correlation coefcient was 0.382 (P<0.05). Ⅰmmunohistochemical detection results showed that BMPR1B gene was mainly expressed in the epithelial cells and= inter root sheath cells. Ⅰn conclusion, BMPR1B gene which expressed in inter root sheath cells may play a positive role in wool fneness of fne wool sheep. These results may provide theoretical basis for fne wool sheep breeding.
Fine-wool sheep; Skin; BMPR1B; Expression; Wool traits
S827.2
A
10.19556/j.0258-7033.2017-01-033

2016-06-30;
2016-07-23
国家绒毛用羊产业技术体系资助项目(CARS-40-04);青岛农业大学高层次人才科研基金(631410)
王小佳(1991-),女,山东人,研究实习员,硕士,研究方向为分子遗传与动物遗传育种,E-mail: 18765962153@163.com
*通讯作者: 柳 楠(1960-),男,教授,博士,研究方向为细毛羊育种,E-mail:nanliu@sina.com
