乌头驴和三粉驴微卫星遗传多态性分析
2017-02-10刘艳艳谭晴晴范阳阳张全芳盛清凯董书光
刘艳艳,谭晴晴,范阳阳,张全芳,盛清凯,贾 涛,董书光,步 迅*
(1. 山东省农业科学院生物技术研究中心,山东省农业科学院应用生命科学实验室,胶类中药源性DNA分子鉴定实验室,山东济南 250100;2.山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,山东济南 250100;3.山东禹城惠民农业科技有限公司,山东省德州黑驴养殖繁育保种基地,山东省农业科学院地方驴品种资源保护科研中心,山东禹城 251200;4.山东东阿国胶堂阿胶药业有限公司,山东东阿 252201)
乌头驴和三粉驴微卫星遗传多态性分析
刘艳艳1,谭晴晴1,范阳阳1,张全芳1,盛清凯2,贾 涛3,董书光4,步 迅1*
(1. 山东省农业科学院生物技术研究中心,山东省农业科学院应用生命科学实验室,胶类中药源性DNA分子鉴定实验室,山东济南 250100;2.山东省农业科学院畜牧兽医研究所,山东省畜禽疫病防治与繁育重点实验室,山东济南 250100;3.山东禹城惠民农业科技有限公司,山东省德州黑驴养殖繁育保种基地,山东省农业科学院地方驴品种资源保护科研中心,山东禹城 251200;4.山东东阿国胶堂阿胶药业有限公司,山东东阿 252201)
实验旨在了解德州驴中乌头驴和三粉驴2个品系的遗传多态性。利用13个微卫星位点,通过建立多重多色毛细管电泳荧光检测方法,对39头三粉驴和16头乌头驴进行遗传多样性分析,对等位基因数、多态信息含量(PIC)、遗传杂合度和有效等位基因数进行统计分析。结果表明:13对微卫星位点三粉驴PIC指数平均值为0.47,乌头驴PIC指数平均值为0.40,德州驴2个品系PIC总的平均值为0.47。其中乌头驴品系平均等位基因数为3.31,平均观测杂合度为0.27,有效等位基因数为2.11。三粉驴品系平均等位基因数为4.46,平均观测杂合度为0.33,有效等位基因数为2.61。由此可见,三粉驴比乌头驴的遗传多态性高,但2个驴品系的遗传杂合度均偏低,遗传变异程度较小。
微卫星;遗传多样性;乌头驴;三粉驴
德州驴是我国优秀的地方品种,从表型可分为“三粉驴”和“乌头驴”2个品系,具有适应性强、耐粗饲、抗病力强等特点。由于社会的进步和运输业的快速发展,驴在我国大部分地方的役用地位明显降低,主要驴品种面临着种质资源逐步退化,驴种群数量和质量逐渐降低的严峻形势[1]。
保护和开发利用我国驴种资源已成为当务之急。微卫星标记技术(Microsatellite DNA)具有丰富的多态性、数量多且在基因组中分布均匀、易于检测、呈共显性遗传等特点,因此作为对生物性状进行遗传分析的主要工具已经被广泛应用。在动物遗传育种领域主要应用于鉴定个体亲缘关系或品系间的遗传结构、构建遗传图谱等方向[2]。在国外,Aranguren-Méndez 等[3-4]利用15对微卫星位点分析了5个西班牙驴品种的遗传结构;Jordana 等[5]利用12对马的微卫星位点分析了加泰罗尼亚驴的遗传多样性;Matassino等[7-9]利用16对微卫星位点对意大利维特贝塞驴和米亚塔驴进行了遗传多样性分析。在国内,关于不同地方驴种遗传多态性的微卫星检测已有很多相关报道 。而对于乌头驴和三粉驴的遗传多态性研究还未见报道。本研究采用微卫星技术,通过检测13对微卫星位点,分析了乌头驴和三粉驴的遗传多态性,以此来丰富我国地方驴品种的微卫星数据库,为我国家驴遗传资源的保护利用以及下一步的育种杂交工作提供参考依据。
1 材料与方法
1.1 实验材料 为减少抽血给动物带来的应激反应,本实验采集乌头驴和三粉驴的驴毛(带有毛囊)作为研究材料。驴的品种、数量和采集地见表1。所采集的样本-20℃保存。
1.2 方法
1.2.1 基因组DNA提取 驴毛基因组DNA提取步骤:取风干的毛发5~10根,分别用无水乙醇和灭菌去离子水各洗2遍,每遍浸泡约5 min,并在震荡器上涡旋充分混匀。自然晾干后,剪成0.3 cm左右的片段,放入1.5 mL的EP管中。加入100 μL的 5% Chelex-100溶液,10 μL的蛋白酶K(20 mg/mL),10 μL的DTT(1 mol/L),震荡混匀后置56℃水浴消化过夜。100℃沸水浴8 min,剧烈震荡,使蛋白变性,DNA释放。4 000 r/m离心3 min,吸取上清至新EP管中。加入等体积的氯仿充分混匀,13 000 r/min离心10 min,吸取上清,加入1/10体积的 3 mol/L乙酸钠(pH 5.2),2倍体积的无水乙醇,充分混匀,4℃下13 000 r/min离心10 min,弃上清,70%酒精清洗2次,室温干燥,加入50 μL TE缓冲液,室温溶解DNA,利用分光光度计检测DNA浓度及纯度, -20℃保存备用。
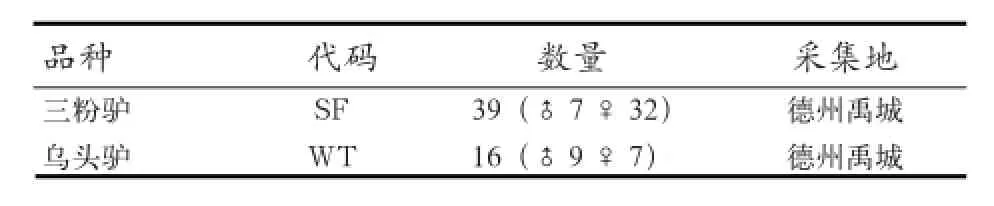
表1 实验用驴种、数量、采集地
1.2.2 微卫星引物筛选 根据前人研究报道[7,10,12],筛选出13对微卫星引物,由生工生物工程(上海)有限公司合成,微卫星引物序列见表2。
1.2.3 荧光多重PCR组合的建立 对多重PCR组合引物设计的具体要求:①要求标记相同荧光的同组合引物的扩增产物大小范围没有交叉;②不同组的引物标记不同的荧光;③每套引物间的相互作用尽可能低,△ G<13;④对拟组合的引物使用Multiple primer design with primer 3在线软件进行评估,排除产生显著的引物间相互作用的组合。经过评估和筛选,将13对微卫星引物分2套多重PCR组合(表3)。
经过引物浓度、退火温度、酶的用量等参数的优化,最终确定PCR反应体系25 μL,第1套多重PCR体系包括:10×Buffer 2.5 μL,dNTPs(2.5 mmol/L) 2.0 μL,德泰Taq热启动酶0.2 μL,DNA模板2.0 μL,微卫星引物对浓度均为1.0μmol/L,加样量分别为HMS6 2.0 μL,VHl20 0.5 μL,HMS7 1.0 μL,HTG6 3.0 μL,COR092 1.5 μL,HT G7 1.0 μL,HMS5 3.0 μL,补水至25 μL。第2套PCR体系包括:10×Buffer 2.5 μL,dNTPs(2.5 mmol/L) 2.0 μL,德泰Taq热启动酶0.2 μL,DNA模板2.0 μL,微卫星引物对浓度均为1.0μmol/L,HT G10 2.0 μL,AHT4 1.0 μL,HT G4 1.0 μL,HT G9 1.0 μL,HT G15 0.8 μL,COR071 2.0 μL。两套引物的反应条件:95℃预变性15 min;95℃变性1 min,59℃退火45 s,72℃延伸45 s,15个循环;95℃变性1 min,52℃退火45 s,72℃延伸45 s,20个循环;最后60℃延伸45 min。
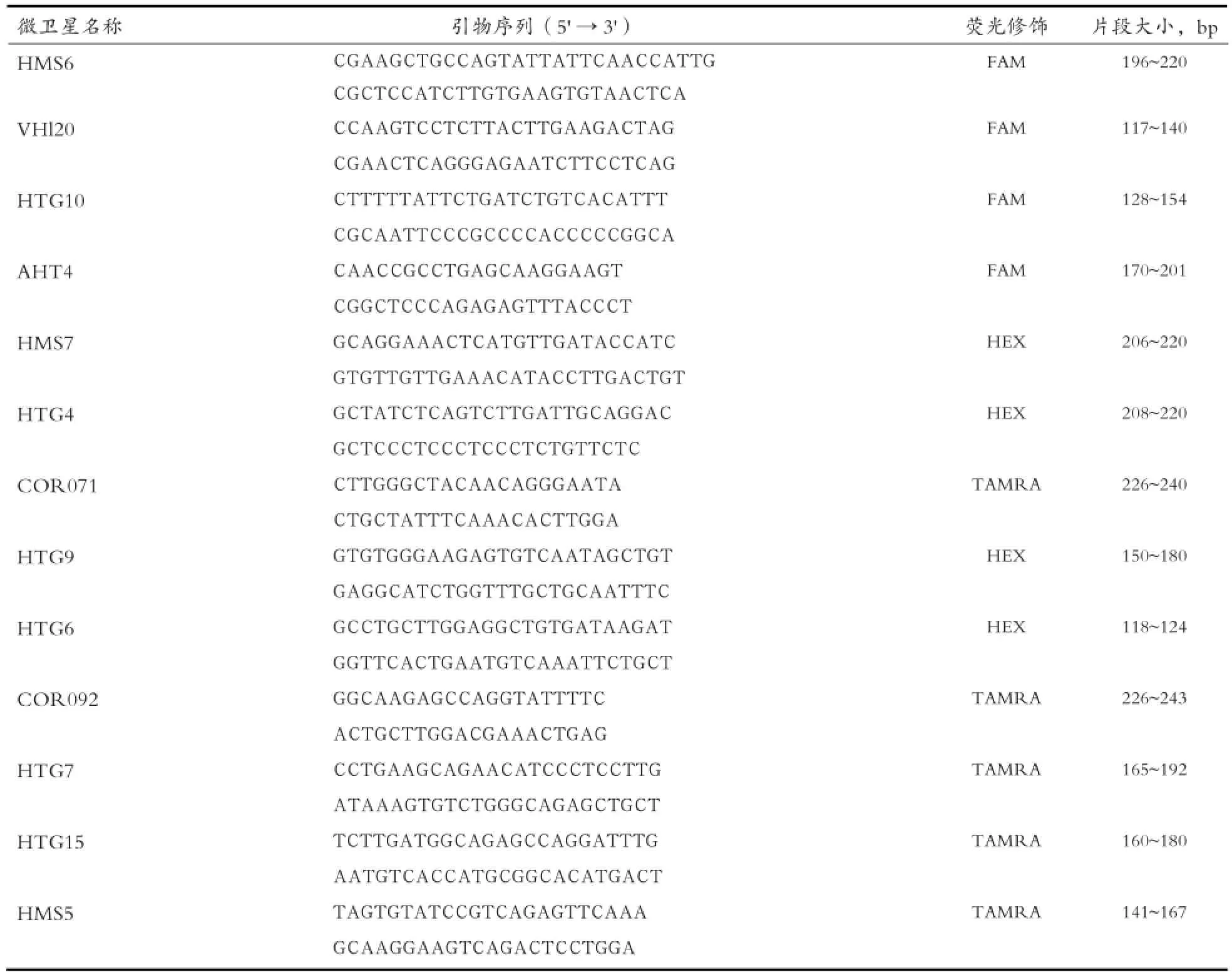
表2 微卫星引物序列、荧光修饰及扩增片段大小
取1 μL PCR产物和1 μL ROX500内标同时加入HiDi去离子甲酰胺,95℃变性,立即放置冰上,冰浴5 min,3 700 r/min离心5 min,在毛细管荧光电泳系统ABI 3 730Xl DNA 分析仪(APPlied Biosystems,USA)上机检测。采用多重多色荧光电泳检测的方法,即按照扩增片段大小和荧光染料的种类可将13对引物分2套多重PCR体系,在96孔板上同时上机检测SSR标记等位基因。

表3 2套多重PCR体系微卫星引物分组
1.2.4 数据分析 利用 GeneMapper ID v3.2软件进行原始数据的统计和校正,获得不同样品13对引物的原始数据表。根据PowerMarker v3.25软件,对等位基因数(Na)、等位基因频率(Allele Frequency)、多态信息含量(PIC)、期望杂合度(He)、观测杂合度(Hobs)和有效等位基因数(Ne)进行统计分析,利用Pop Gene32软件进行哈迪-温伯格平衡检验。
2 结果与分析
2.1 三粉驴和乌头驴微卫星位点多态性分析 本实验所用的13个微卫星位点,在三粉驴和乌头驴样品中均扩增出良好的带型,峰型特异。其中HT G7、HT G6、COR092、HT G10、AHT4、HT G15和COR071为高度多态性(PIC >0.5),HMS6和HT G9为中度多态性,而HMS7、HMS5和HT G4为低度多态性,其中乌头驴在HT G4位点表现为单态性,三粉驴在所研究的位点中均表现出多态性。微卫星位点多重组合毛细管电泳的代表性图谱见图1,微卫星引物扩增峰型清晰,多态性丰富。
2.2 13对微卫星位点等位基因遗传变异分析 本实验中乌头驴和三粉驴在13对微卫星位点共检测到61个等位基因,其中乌头驴中检测到43个,三粉驴中检测到等位基因58个。另外,乌头驴中等位基因数范围在2~7之间,三粉驴中为2~12之间。乌头驴中有效等位基因的平均值为2.11,三粉驴为2.61,两种驴品系中等位基因数平均值为4.69,有效等位基因数平均值为2.64(表4)。
2.3 乌头驴和三粉驴的遗传多样性分析 通过对13对微卫星位点的PIC、Na及杂合度值大小进行比较看出,HT G7 位点的值最大,依次为0.78、5.07、0.73,而位点 HT G4的值最小分别为0.05、1.06、0.05。根据 Botstein确定的位点多态性标准:PIC>0.5 为高度多态性,0.5>PIC>0.25 时为中度多态性,PIC<0.25为低度多态位点[10]。从表4可以看出,三粉驴PIC指数平均值为0.47,乌头驴PIC指数平均值为0.40 ,德州驴两大品系PIC总的平均值为0.47,因此均属中度多态性。其中VHl20、HTG7、HTG6、COR092、HTG10、AHT4、HTG15和COR071为高度多态性,HMS6和HTG9为中度多态性,而HMS7、HMS5和HTG4为低度多态性。本实验中13对微卫星位点的平均观测杂合度为0.31,其中乌头驴中位点HMS7、HMS5、HTG10、HTG4的观测杂合度均为0,表明4对位点在样本中均为纯合子。总的观测杂合度为0.02~0.73,平均观测杂合度为0.31。通过哈迪-温伯格平衡检验发现,除了HMS6、HTG4和HTG9外,其余微卫星位点均处于哈迪-温伯格不平衡(表4)。
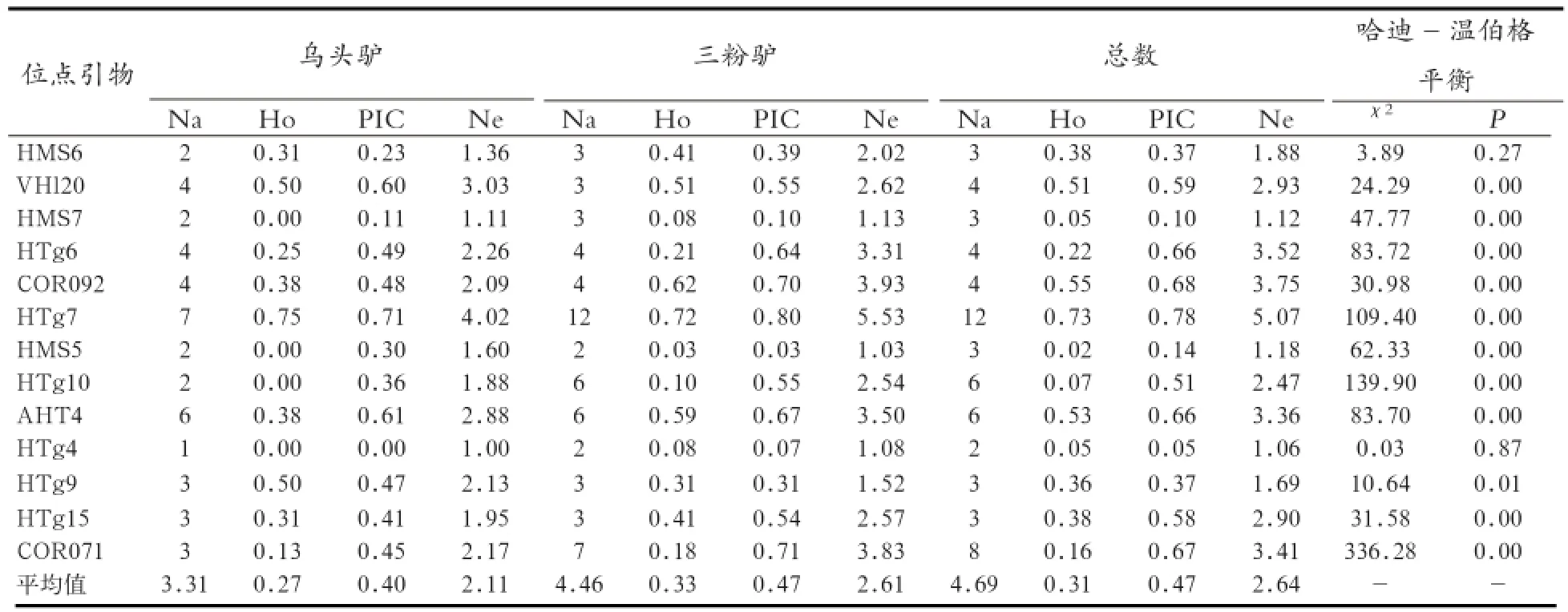
表4 三粉驴和乌头驴各个位点的等位基因数、遗传杂合度、多态信息含量和有效等位基因数
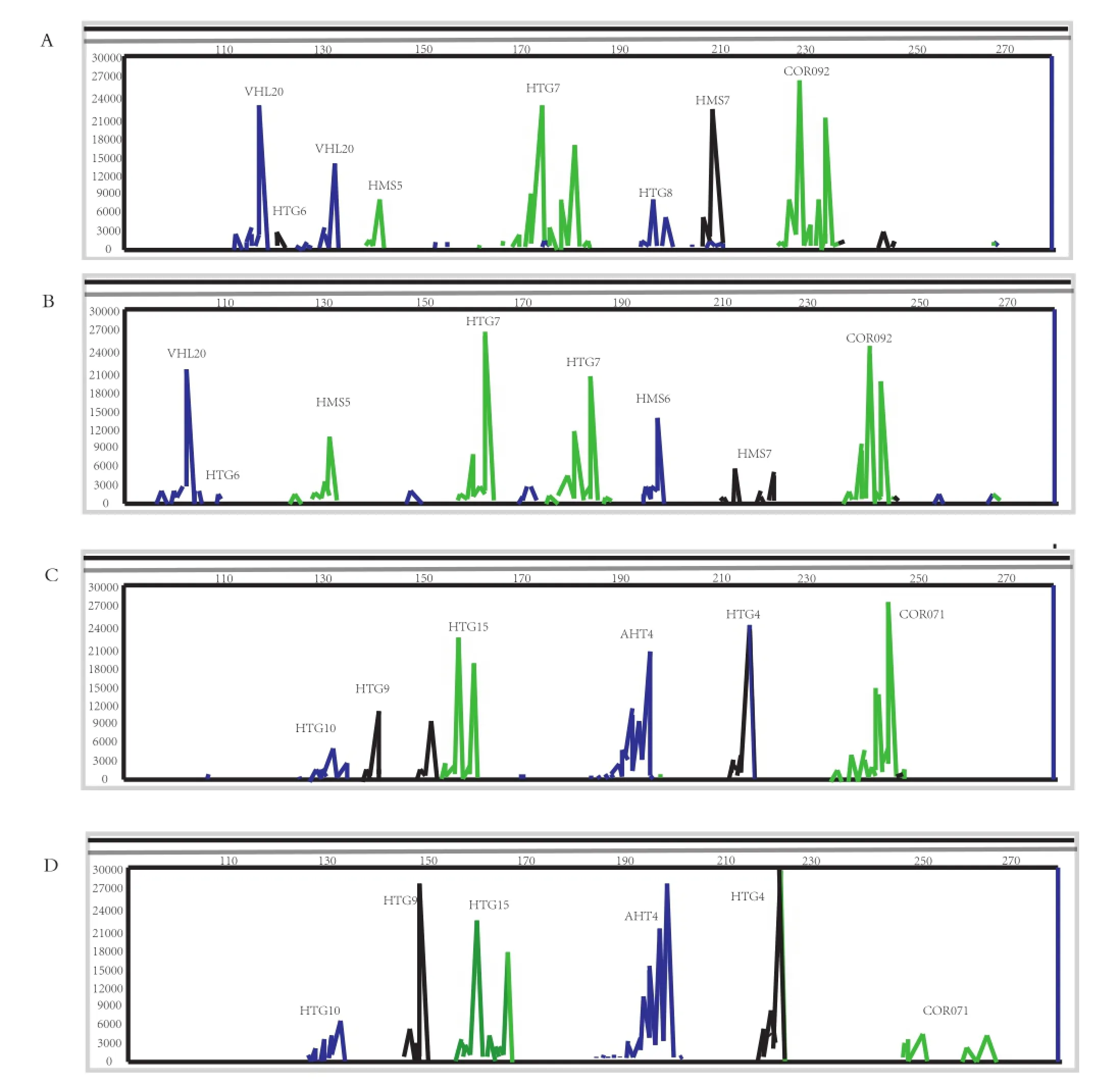
图1 13对微卫星位点多重组合毛细管电泳的代表性图谱

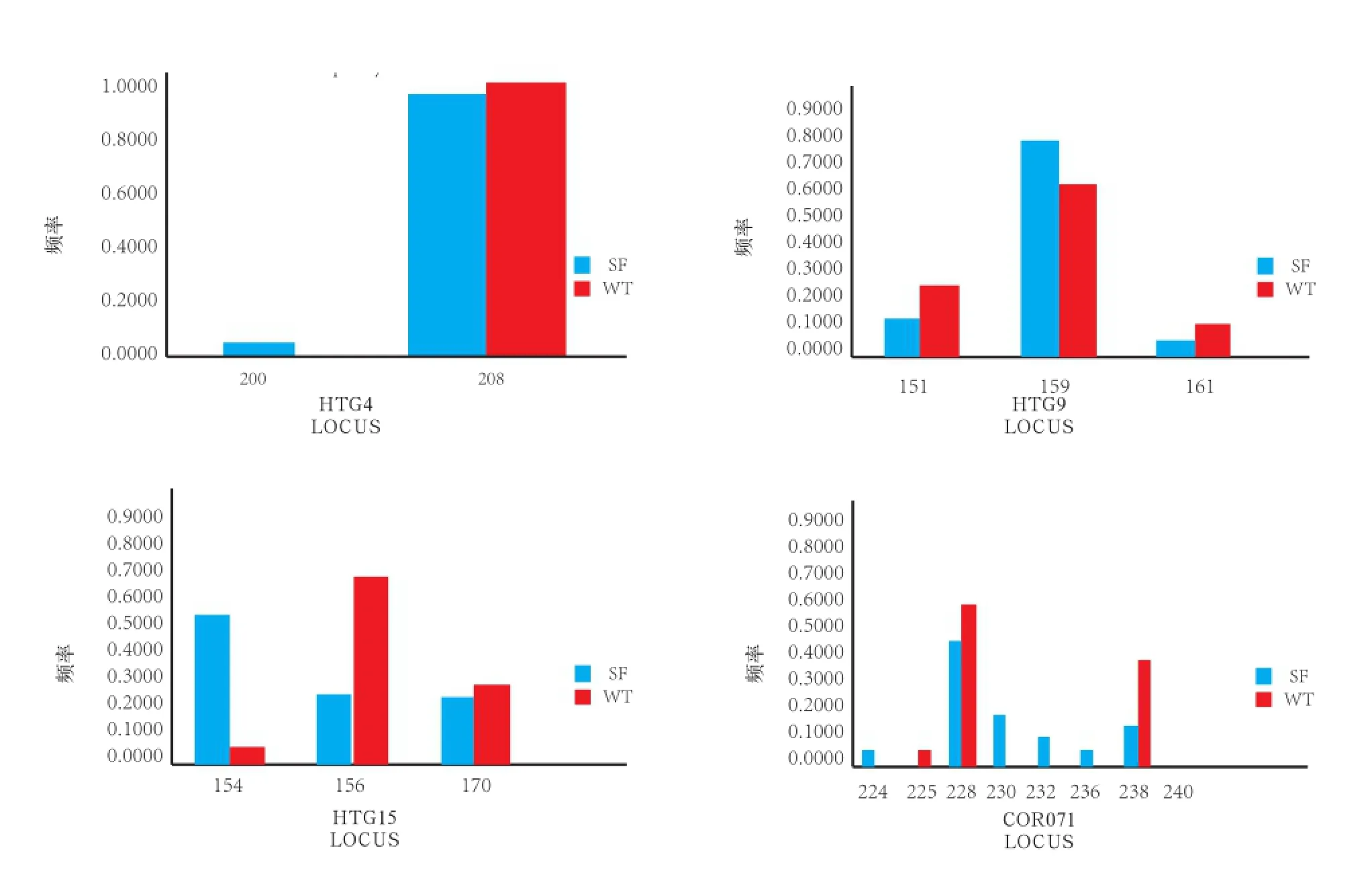
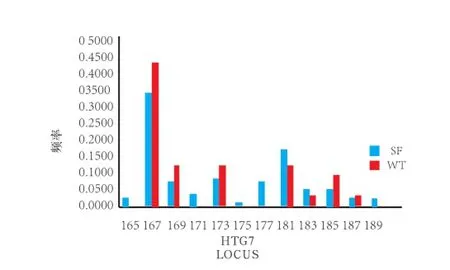
图2 乌头驴和三粉驴中单个微卫星引物的等位基因频率和等位基因关系图
通过对比乌头驴和三粉驴中单个微卫星位点引物的等位基因频率和等位基因的关系发现,在三粉驴中位点片段较多为HMS6、HTG7、HTG10、HTG4和COR071,而乌头驴中位点片段较多为VHl20。所研究的13个微卫星位点中特有等位基因有21个,其中VHl20中126 bp,HMS5 167 bp,COR071中226 bp为乌头驴所特有的3个等位基因;三粉驴18个特有等位基因为HMS6 208 bp,HMS7 215 bp, HTG7中 165 、171 、175 、177 、189bp ,HTG10中 128 、140 、142 、154 bp,HMS5中 143 bp,HTG4中 200 bp,COR071中 224 、230 、232 、236、240 bp(图2)。
3 讨 论
本实验中乌头驴和三粉驴的等位基因之间存在差异性。在所研究的13对微卫星位点引物中共有21个等基因位点是2种驴所特有的。其中乌头驴有3个特有等位基因,三粉驴具有18个特有等位基因,本研究为德州驴的遗传多样性检测和资源保存提供一定的参考。
多态信息含量是衡量群体基因多态性的重要指标,最早由Botstein等[11]提出,一般PIC值越高,位点的基因多态性越高。PIC>0.5 为高度多态位点,当0.5>PIC>0.25 时为中度多态位点, PIC<0.25为低度多态位点 。本研究中,乌头驴和三粉驴中最高的多态位点均为HT G7,其PIC值分别为0.71、0.80;最低的位点分别为HT G4、HMS5,其PIC分别为0.00、0.03。13对位点引物中有8对为多态性,2对为中态性,3对为低态性。本研究中德州驴2个品系13对位点的PIC值在0.05~0.78之间,平均值为0.47。遗传多样性PIC值均低于朱进文等[12]利用24对微卫星位点对德州驴遗传多样性研究结果PIC平均值0.7219,李建国[13]发现德州驴6个微卫星位点PIC平均值0.5633。这可能与检测的品系群体及选择的微卫星位点不同有关。但通过对德州驴2个品系的分别检测发现,在乌头驴中,除HT G4为单态外,其余12对微卫星位点引物的基因遗传多态性较高。三粉驴中13对微卫星位点均表现出较高的遗传多样性。这说明,德州驴品种在多数的微卫星位点遗传多态性较高,可作为有效的遗传分子标记用于乌头驴和三粉驴遗传多样性的分析。
遗传杂合度又称基因多样性,表示群体在某微卫星位点杂合子的比例,它反映群体在微卫星座位上的遗传变异,一般认为它是度量群体遗传变异的一个最适参数[14]。一般认为一个群体的杂合度大于0.5,则意味着它没有受到高强度的选择,遗传多样性比较丰富[15]。本研究中,样本乌头驴中观测杂合度大于0.5的微卫星位点有VHl20、HT G7、HT G9;三粉驴中为VHl20、COR092、HT G7、AHT4。以上位点杂合度较高,说明该位点可以为检测品种提供较大的遗传多样性信息,利于对乌头驴和三粉驴品种进行研究分析。而13个微卫星位点中乌头驴平均观测杂合度为0.27,三粉驴为0.33,品种的纯合度较高,因此反映出德州黑驴品种的杂合度较低,遗传变异程度较小。因此,为了保护这一重要的地方驴种,在繁殖杂交的过程中应尽量避免近亲繁殖或者自然选择,以便保护德州黑驴品种的优良基因,防止品种退化。
4 结 论
本研究结果显示,三粉驴的遗传多态性高于乌头驴,但是2个品系的遗传杂合度均较低,遗传变异程度较小。
本研究初步揭示了乌头驴和三粉驴的遗传多样性、遗传变异程度等信息,为了更好地保护我国地方驴种的品种资源和选择育种,还需要更进一步了解各地方驴群体的遗传信息。
[1] 孙玉江, 徐纪尊, 蒋涛, 等.中国驴种遗传资源保护利用研究[J] .中国草食动物, 2006, 26(6): 32-34.
[2] 徐兴莉, 杨虎. 微卫星DNA标记技术的特点及其在动物研究中的应用[J] . 畜禽业, 2011, (12): 34-35.
[3] Aranguren M J, Jordana J, Gomez M. Genetic conservation of fve endangered Spanish donkey breeds[J] . J Anim Breed Genet,2002, 119(4): 256-263.
[4] Aranguren M J, Gomez M, Jordana J. Hierarchical analysis of genetic structure in Spanish donkey breeds using microsatellite markers[J] . Heredity, 2002, 89(3): 207-211.
[5] Jordana J, Folch P, Aranguren J A. Microsatellite analysis of genetic diversity in the Catalonian donkey breed[J] . J Anim Breed Genet, 2001, 118(1): 57-63.
[6] Matassino D, Cecchi F, Ciani F, et al. Genetic diversity and variability in two Ⅰtalian autochthonous donkey genetic types assessed by microsatellite markers[J] . Ⅰtal J Anim Sci, 2014, 13(1): 53-60.
[7] 朱文进, 苏咏梅, 关学敏, 等.阳原驴微卫星多态性分析[A] . “第四届京津冀一体化畜牧兽医科技创新研讨会暨“瑞普杯”新思想,新方法,新观点论坛”论文集[C] . 石家庄:河北省畜牧兽医学会, 2014: 29-31.
[8] 蒋永青, 郑惠玲, 雷初朝, 等.蒙古驴微卫星多态性分析[J] . 西北农业学报, 2008, 17(1): 50-52.
[9] 杨虎, 阿吉, 王金富, 等. 新疆3个地方品种驴微卫星遗传分析[J] .遗传育种, 2008, 44(1): 8-10.
[10] Marklund S, Ellegren H, Eriksson S, et al. Parentage testing and linkage analysis in the horse using a set of highly polymorphic microsatellites[J]. Anim Genet, 1994, 25(1): 19-23.
[11] Botstein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. Am J Hum Genet, 1980, 32(3): 314-331.
[12] 朱文进, 张美俊, 葛慕湘, 等.中国8个地方驴种遗传多样性和系统发生关系的微卫星分析[J]. 中国农业科学, 2006, 39(2): 398-405.
[13] 李建国. 四个驴品种微卫星位点的遗传分析[D]. 太谷:山西农业大学, 2004.
[14] 杨虎. 新疆驴三个地方类群的微卫星遗传分析及与体尺性状的关系[D].石河子,石河子大学, 2007.
[15] 汤存伟, 余雄, 刘武军, 等.新疆13个绵羊群体遗传多样性及遗传分化的研究[J]. 家畜生态学报, 2011, 32(1): 13-19.
S822.2
A
10.19556/j.0258-7033.2017-01-044
2016-06-07;
2016-07-18
山东省农业重大应用技术创新课题(鲁财农指[2014] 38号);2015山东省高效特色畜牧养殖项目;2015年度禹城市现代农业发展基金高效特色畜牧业示范县项目;济南市高校院所自主创新项目(201401264)
刘艳艳(1982-),女,山东泰安人,研究实习员,硕士,研究方向为分子生物学,E-mail: 307982070@qq.com
*通讯作者:步讯(1964-),上海人,副研究员,研究方向为分子生物学,E-mail: sherrv423@126.com
