池塘养殖尾水经稻田生态工程净化后的浮游细菌群落特征
2017-02-09李晓丽朱建强
陶 玲,李晓丽,朱建强,李 谷
(1.长江大学湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025 ;2.中国水产科学研究院长江水产研究所,武汉 430223; 3.淡水水产健康养殖湖北省协同创新中心,武汉 430070)
池塘养殖尾水经稻田生态工程净化后的浮游细菌群落特征
陶 玲1, 2,3,李晓丽2,朱建强1,李 谷2
(1.长江大学湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025 ;2.中国水产科学研究院长江水产研究所,武汉 430223; 3.淡水水产健康养殖湖北省协同创新中心,武汉 430070)
为利用稻田生态工程对精养池塘尾水进行循环利用,采用Illumina MiSeq 第二代测序技术比较分析了稻田生态工程进出水中浮游细菌群落结构和多样性差异,以探讨稻田生态工程净化回用水中浮游细菌群落变化对池塘养殖的影响。结果显示,稻田生态工程进出水中优势浮游细菌在门水平上的组成相同,均为蓝细菌门(Cyanobacteria ) 、变形菌门(Proteobacteria)、放线菌门(Actinobacteria )、浮霉菌门(Planctomycetes)和拟杆菌门(Bacteroidetes)。但优势门类的相对丰度发生变化,蓝细菌门的相对丰度由进水中的46.72%显著降低至表面流出水中的41.82%和渗流出水中的34.77%;而放线菌门的相对丰度由3.90%增加至表面流出水中的5.65%和渗流出水中的6.45%。属水平上优势浮游细菌组成也相同,但微囊藻属(Microcystis)的相对丰度由0.83%显著降低至渗流出水中的0.46%(P<0.05)。另外,稻田生态工程表面流出水中浮游细菌物种丰富度指数(Chao 1)显著提高,渗流出水中Shannon多样性指数显著提高,且Simpson指数显著降低(P<0.05)。
池塘养殖;生态工程;稻田;浮游细菌;高通量测序
我国淡水养殖目前普遍采用高密度集约化养殖模式,存在过量放养、饵料过剩等突出问题,导致养殖池塘水体富营养化严重和养殖病害频发。池塘养殖的水环境污染问题已成为当前淡水养殖发展的主要制约因素[1]。有效处理池塘养殖尾水,并对其再次利用,是实现池塘养殖可持续发展的关键途径之一。稻田在净化水质中具有独特的作用[2-4]。水稻生长需肥旺盛时期与池塘需换水周期一致,利用稻田异位净化精养池塘尾水,可使总氮、总磷、硝态氮和铵态氮的含量分别下降 65.2% 、72.0% 、87.3% 和 66.8%[5]。精养池塘中多余的营养物质在稻田中被水稻吸收转化而得到循环利用,使稻田常规施肥量节省20%[5],种养系统间资源得到高效循环并使污染物减量排放[6]。同时,经稻田净化的出水满足了养殖池塘用水水质如:溶氧、氨氮、亚硝酸氮等指标要求[7-9],可回用到养殖池塘进行循环利用。
养殖生态系统中浮游细菌与养殖生物的健康生长以及养殖环境关系密切,是影响养殖池塘水质和生态平衡的重要生态因子[10-11]。利用稻田生态工程对精养池塘尾水进行循环利用时,经稻田净化后的回用水中浮游细菌群落结构会产生怎样变化,是否对池塘养殖水质产生不利影响还不得而知。Illumina MiSeq测序平台在微生物多样性和群落结构研究方面已获得了广大科研人员的认可[12-13],该方法相较于传统的纯培养方法,能够产生覆盖深度更大的数据量,检测到纯培养技术未能发现的低丰度浮游细菌种类。本研究拟利用Illumina MiSeq 第二代测序技术比较分析稻田生态工程进出水中浮游细菌群落结构和多样性差异,以期明确池塘养殖尾水经稻田生态工程处理后的回用水中浮游细菌群落结构特征,为利用稻田生态净化工程循环利用精养池塘尾水,实现稻作系统和养殖池塘系统的最优生态耦合提供理论基础。
1 材料与方法
1.1 稻田生态工程构建
用于精养池塘尾水净化和循环利用的稻田面积为420 m2,长×宽为30 m×14 m。依照池塘尾水在稻田中的水流状态可将稻田异位净化方式分为渗流净化和表面流净化。池塘养殖尾水在稻田土壤表面流动并经由稻田表面出水,依靠稻田表面土壤、植物根茎的拦截及其上的生物膜降解达到净化作用的处理方式为表面流净化;养殖尾水进入稻田后渗入稻田土壤表面以下,并经埋藏在土壤一定深度的收水管收集后流出稻田,通过稻田深层土壤和植物根部的拦截及其上的生物膜的降解达到净化作用的方式为渗流净化。按照两种净化方式要求对稻田进行生态工程改造。稻田渗流的改造方式如下:参照涝渍地排水方法,即在田间纵向开挖长×宽×深分别为20 m×0.3 m×0.6 m沟槽,内置穿孔吸水管(直径11 cm),且吸水管四周用粗砂和谷壳包裹,防止颗粒物质堵塞。田间吸水管间距为4 m,吸水管一端用集水管横向连接,集水管开口于集水井,通过闸阀控制稻田水位(图1)。应用稻田表面流改造时,将稻田用防水土埂(土筑膜覆,宽×高为20 cm×30 cm)隔开,形成3 m×30 m的回型过流通道,增加水流路径(图2)。池塘养殖尾水经水泵提取进入稻田,分别经稻田表面流和渗流途径进入集水管后再进入集水池,集水池与输水生态沟相连,水流经输水沟再回用到养殖池塘。
1.2 系统运行和管理
池塘主养草鱼,配养鲢鳙。草鱼放养规格和密度分别为100 g/尾和1 200 尾/667 m2,鲢放养规格和密度分别为100 g/尾和120 尾/667 m2,鳙放养规格和密度分别为100 g/尾和12尾/667 m2。按照鱼体重的3%~5%投喂骆驼牌颗粒饲料,并视季节、水色、天气、鱼类摄食情况调整投饵量。
2015年7月1日开始,水稻处于分蘖期时,开启水泵将池塘尾水泵入稻田进行净化回用。采取表面流和渗流同时进行的运行方式,即表面流和渗流出水口同时打开,使表面流净化和渗流净化出水均回用到养殖池塘。稻田进水流量为12 m3/h,表面流和渗流出水流量分别为6.7 m3/h和3.6 m3/h。至2015年8月31日期间,每3d开启水泵将池塘肥水泵入稻田,如遇下雨天顺延。稻田尽量避免使用农药,无法避免时,使用低残留、无毒、无公害的农药康宽(氯虫苯甲酰胺)进行稻田杀虫,且稻田喷施农药后5 d内不开启水泵。

图1 稻田渗流田间工程示意图Fig.1 Diagram of the subsurface flow engineering in the paddy field

图2 稻田表面流田间工程示意图Fig.2 Diagram of the surface flow engineering in the paddy field
1.3 样品采集和DNA提取
根据天气情况和水稻生育期,于2015年7月11日、7月29日和8月11日3次采集样品作为平行样品,分析稻田生态工程进出水浮游细菌群落特征。别在开启水泵后8 h,采集稻田进水口、表面流出口以及渗流出水口的水样各500 mL,并迅速带回实验室。从每个样品中取100 mL水样抽滤到0.22 μm孔径的无菌纤维素滤膜上。将滤膜剪碎,用 OMEGA 公司的Water DNA Kit试剂盒按试验步骤提取浮游细菌总DNA,经琼脂糖凝胶电泳检测后-20 ℃保存,尽快送至上海美吉生物医药科技有限公司在Illumina MiSeq平台上进行高通量测序。
1.4 数据分析
测序得到的原始数据存在一定比例的干扰数据,为了使信息分析的结果更加准确、可靠,首先对原始数据采用Flash软件融合双末端序列,然后通过添加的barcode将序列拆分回归到相应样品,并对序列进行预处理和质量控制,去除引物序列及低质量序列,然后进行序列分析。利用Usearch(vsesion 7.1 http://drive5.com/uparse/)软件平台进行OTU聚类,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在各个水平上统计每个样品的群落组成。分别利用香农指数(Shannon),辛普森指数(Simpson) 和物种丰富度指数(ACE,Chao 1) 公式计算浮游细菌生态多样性指数。利用Excel软件制作Venn图。利用SPSS 软件(17.0 版本)对数据做差异显著性分析,设置差异显著性水平P= 0.05,当P<0.05 时表示差异显著。
2 结果
2.1 稻田生态工程进出水中浮游细菌群落结构特征
2.1.1 门水平上浮游细菌组成变化
在门水平上,本实验检测到的浮游细菌可分属27个门。占优势的门类(相对丰度>5.0%)分别是蓝细菌门(Cyanobacteria),占总浮游细菌OTU数目的34.77%~46.72%,变形菌门(Proteobacteria)),占总OTU数目的27.67%~29.40%,拟杆菌门(Bacteroidetes), 占总OTU数目的8.07%~10.08%,浮霉菌门(Planctomycetes),占总OTU数目的6.14 %~8.54 %,放线菌门 (Actinobacteria) ,占总OTU数目的3.90%~6.46%,这5个门共计占了总OTU数目的89.03%~92.74%,是浮游细菌的主要类群,在养殖池塘水中的生物降解中发挥了主要作用,其相对丰度见图3。其次还检测到绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、梭杆菌门(Fusobacteria)、疣微菌门(Verrucomicrobia ) 、芽单胞菌门(Gemmatimonadetes)、Armatimonadetes、螺旋体门(Spirochaetae)、厚壁菌门(Firmicutes)、WCHB1-60、Candidate-division-OP3、Candidate-division-OP11、TM6、异常球菌-栖热菌门(Deinococcus-Thermus)、Candidate-division-TM7、硝化螺菌门(Nitrospirae)、Elusimicrobia、CKC4、纤维杆菌门(Fibrobacteres)和OC31等。此外,还有0.21% ~ 0.25%的OTU分类地位尚不明确。
养殖池塘尾水在经过稻田生态工程净化后,出水中优势浮游细菌在门水平上的组成没有变化,但其相对丰度发生变化。相对丰度降低的门类主要为蓝细菌门,其相对丰度由进水中的46.72%显著降低至表面流出水中的41.82%和渗流出水中的34.77%。而放线菌门的相对丰度由3.90%显著增加至表面流出水中的5.65%和渗流出水中的6.45%(P<0.05)。变形菌门、浮霉菌门和拟杆菌门的相对丰度变化不显著(P>0.05)。
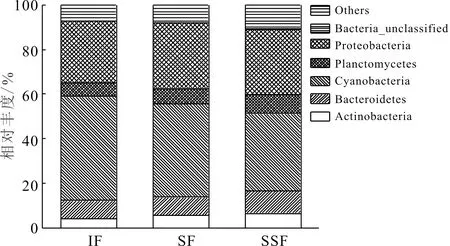
图3 门水平上优势浮游细菌相对丰度Fig.3 The relative abundance of dominate bacteriophankton at phylum levelIF代表进水,SF代表表面流出水,SSF代表渗流出水
2.1.2 属水平上浮游细菌组成变化
在属水平上对每个样品的菌群结构及分布进行了统计分析(图4)。可见,稻田生态工程进出水中占优势的浮游细菌属一致,均是聚球藻属(Synechococcus),SubsectionI-FamilyI-unclassified,Cyanobacteria-norank,CL500-3,hgcI-clade,丛毛单胞菌科未分类的新属(Comamonadaceae-unclassified),OPB56-norank,Snowella,多核杆菌属(Polynucleobacter),这些属占浮游细菌总OTU数目均超过1%。但这些优势浮游细菌属在稻田生态工程出水中相对丰度发生变化。其中,聚球藻属的相对丰度由11.8% 显著降低至渗流出水中的3.31%,SubsectionI-FamilyI-unclassified的相对丰度由7.52% 显著降低至渗流出水中的2.69%,但这两个属的浮游细菌在表面流出水中的相对丰度与进水中差异不显著(P>0.05)。hgcI-clade的相对丰度由1.63% 显著升高至渗流出水中的2.71%,并显著降低至表面流出水中的0.72%,Snowella的相对丰度由4.27% 显著降低至渗流出水中的3.14% 和表面流出水中的1.94%,微囊藻属的相对丰度由0.83% 显著降低至渗流出水中的0.46%(P<0.05),但在表面流出水中差异不显著。

图4 属水平上浮游细菌相对丰度Fig.4 The relative abundance of bacteriophankton at genus level
2.2 浮游细菌群落相似性分析
用维恩图可以比较直观的表现稻田生态工程进出水样品的OTU数目组成相似性及重叠情况。结果表明,稻田生态工程进水中独有112个OTU,渗流出水中独有118个OTU,表面流出水中独有100个OTU。进水和渗流出水之间中共有的OTU为507个,占两者OTU 总数的55.34%;进水和表面流出水之间共有的OTU为547个,占两者OTU 总数的60.91%;表面流和渗流出水之间共有的OTU为518个,占两者OTU 总数的57.30%。
2.3 浮游细菌群落多样性特征
利用多样性指数比较分析稻田生态工程进出水中浮游细菌群落多样性。结果表明进水中浮游细菌的物种丰富度指数(ACE和Chao 1)、Shannon指数和Simpson指数分别为766、778、4.75和0.028,渗流出水中为767、782、4.97和0.019,表面流出水中为816、802、4.78和0.025。相比较于进水,稻田生态工程出水中多样性指数虽然变化率幅度不大,但稻田生态工程表面流出水中物种丰富度(Chao 1)指数显著提高,渗流出水中Shannon指数显著提高,且Simpson指数显著降低(P<0.05)。

图5 浮游细菌Venn相似性Fig.5 Venn diagram of OTUs
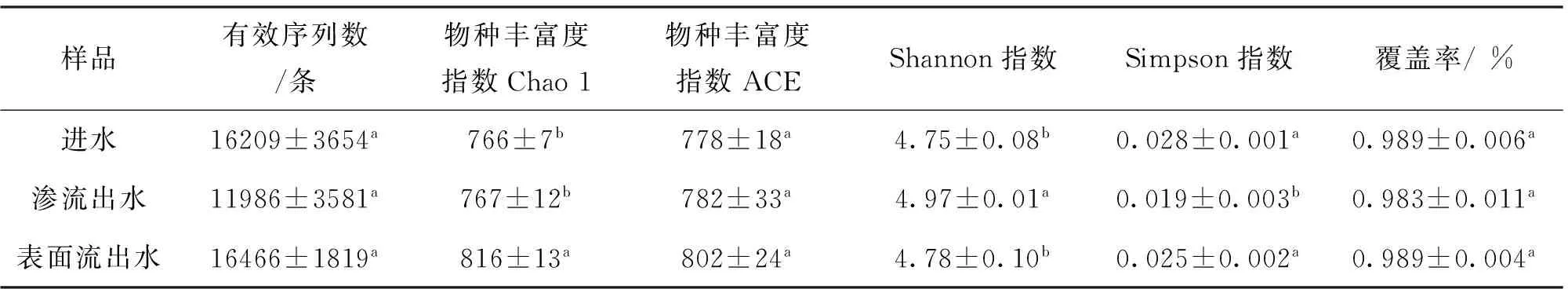
表1 稻田进出水中浮游细菌群落多样性Tab.1 Diversity of bacterioplankon communities in the inflow and outflow of the paddy field
3 讨论
浮游细菌是水域生态系统重要的矿化者,同时也作为初级生产力成为部分微型浮游动物的饵料,其活跃的代谢促进了系统中的物质循环和能量流动,维系着一个系统的正常运转。池塘中的细菌群落与池塘中营养物质循环、水质状况以及养殖生物的健康状况等均具有重要的关系[12]。
本研究结果表明进入稻田生态工程的草鱼养殖池塘尾水和回用出水中的优势浮游细菌组成相同,均为蓝细菌门、变形菌门、放线菌门、浮霉菌门和拟杆菌门,与湖泊及养殖水体优势浮游细菌的研究结果较一致[13-16]。草鱼投饵量大,残饵和粪便产生量多,由此造成的过多的营养物质输入可能是造成蓝细菌门相对丰度较大的原因。另外,不同区域养殖池塘水体的细菌群落组成有其自身的特点,也可能与不同采样季节及水体氮磷水平等有关。稻田生态工程出水中优势浮游细菌相对丰度发生变化,其中蓝细菌门的相对丰度显著降低,放线菌门相对丰度显著增加。蓝细菌门相对丰度降低,这可能是由于蓝细菌门中个体较大的蓝藻能被稻田土壤过滤和吸附截留在稻田中。蓝细菌是稻田主要微生物之一,其通过固氮作用在维持土壤肥力中起重要作用[17]。被截留到稻田中的蓝细菌可能会增加稻田对氮肥的利用率和土壤肥力,但这还有待于进一步证实。放线菌广泛分布于自然界,是一种有分枝倾向或能形成分枝菌丝且可产生孢子的特殊菌种类型,能够产生种类繁多的抗生素、维生素和酶。它的生长能改善水体的气味并对水体有消毒作用,对病原微生物有抑制作用,特别是能够抑制腐败菌的生长繁殖[18]。放线菌对养殖水体的氨氮有高效的去除效果[19]。本研究中回用水中放线菌相对丰度显著增加,可认为对养殖池塘是有益的,可对池塘微生态环境稳定起到积极作用。
草鱼养殖池塘水体中假单胞菌(Pseudomonas)和气单胞(Aeromonas)菌是主要的优势菌[20]。草鱼综合养殖池塘中水体浮游细菌优势菌群为类芽孢杆菌属(Paenibacillus)[21]。本研究中检测到草鱼精养池塘水体中的优势属与上述研究结果不尽相同,可能原因是不同养殖区域浮游细菌本底状况不同,也有可能是样品采集季节不同。另外,本研究中蓝细菌门相对丰度占34%以上,也有可能使其它菌群的相对丰度差异不能体现。优势属聚球藻属,微囊藻属和Cyanobacteria-norank均属于蓝细菌门,这些属相对丰度的显著降低与在门水平上蓝细菌门相对丰度降低的结果一致,表明截留在稻田中的蓝细菌主要为这些属类。池塘水中过高的微囊藻属含量会对养殖动物产生危害[22]。微囊藻属相对丰度显著降低,表明利用稻田生态工程回用池塘养殖尾水可直接去除微囊藻,从而可直接减少池塘水中微囊藻属含量,降低养殖池塘发生微囊藻水华的可能性。
本研究中未检测到荧光假单胞菌(Pseudomonasfluorescens)、柱状黄杆菌(Flavobacteriumcolumnare)、温和气单胞菌(Aeromonassobria)、嗜水气单胞菌(Aeromonashydrophila) 以及点状产气单胞菌(Aeromonaspunctata)等草鱼常见的细菌病病原。表明本养殖系统在本实验采样期间内具有较好的微生物环境,但也有可能是这些病原菌在池塘浮游菌群中所占比例很小。因此,稻田生态工程对这些潜在致病菌的影响还需要进一步采用其它方法,并在不同的养殖周期采样进行分析研究。
多样性指数是评价微生物群落多样性的有效方法[23]。多样性指数的变化与水体环境的变化有关,当群落结构从多样性指数较高的稳定结构向多样性指数较低的不稳定结构转变,对应的环境变得相对脆弱,增大养殖病害暴发的几率[24]。本研究中利用稻田异位净化和回用池塘养殖尾水时,表面流出水中浮游细菌物种丰富度显著提高,渗流出水中浮游细菌Shannon指数显著提高,且Simpson显著降低。表明两种出水方式下,稻田生态工程出水中浮游细菌群落结构均更加稳定。
比较两种不同出水方式中浮游细菌群落结构和多样性差异,可以看出,不同运行方式下稻田生态工程对浮游细菌群落的影响程度不同。渗流出水中蓝细菌门和微囊藻相对丰度的降低幅度和放线菌门相对丰度的提高幅度均大于表面流出水。其原因可能是不同运行方式下池塘尾水在稻田中流经的路径差异引起的。渗流出水方式中养殖尾水进入稻田后渗入稻田土壤表面以下,养殖尾水中的浮游细菌可能通过稻田深层土壤的拦截、植物根部及生物膜的作用而产生改变,且稻田土壤中部分微生物可能通过水流作用随水流进入出水中,而表面流出水方式中池塘养殖尾水仅在稻田土壤表面流动,与稻田土壤的交换作用更小,因而对养殖尾水中浮游细菌的影响相对较小。综合浮游细菌多样性指数和群落结构变化,相比较而言,稻田渗流出水中多样性提高和微囊藻等有害微生物的降低程度更大,使回用水更加满足养殖用水对微生物环境要求。但渗流出水流量(3.6 m3/h)低于表面流出水流量(6.7 m3/h),表面流出水方式在相同能耗下能回用更多的养殖尾水。因此,在实际生产中,可针对池塘尾水特性和回用水量要求,通过改变稻田运行方式而调控出水中浮游细菌群落结构,以适应池塘养殖环境要求。
4 结论
(1)采用Illumina MiSeq 第二代测序技术比较分析了稻田生态工程进出水中浮游细菌群落结构和多样性差异。在门水平和属水平上,稻田生态工程进出水中优势浮游细菌均相同,但相对丰度均产生变化。优势门类均是蓝细菌门、变形菌门、放线菌门、浮霉菌门和拟杆菌门。其中,蓝细菌门的相对丰度由进水中的46.72% 显著降低至表面流出水中的41.82% 和渗流出水中的34.77%,而放线菌门的相对丰度由3.90% 增加至渗流出水中的5.65% 和表面流出水中的6.45%。属水平上微囊藻属的相对丰度由0.83% 显著降低至渗流出水中的0.46%(P<0.05)。
(2)稻田生态工程表面流出水中物种丰富度(Chao 1)指数显著提高,渗流出水中Shannon多样性指数显著提高,且Simpson多样性指数显著降低(P<0.05),出水中浮游细菌群落结构更加稳定。
(3)研究结果为利用稻田生态工程净化和回用养殖池塘尾水,构建鱼稻耦合池塘养殖系统提供了理论基础和有价值的参考。实际生产中,可针对池塘尾水特性和回用水量要求,通过改变稻田运行方式而调控出水中浮游细菌群落结构,以适应池塘养殖环境要求。
[1]Cao L,Wang W,Yang Y,et al.Environmental impact of aquaculture and countermeasures to aquaculture pollution in China [J]. Environ Sci Pollut Res.,2007,14(7):452-462.
[2]薛利红,杨林章.太湖流域稻田湿地对低污染水中氮磷的净化效果 [J].环境科学研究,2015,28(1):117-124.
[3] Li S,Li H,Liang X Q,et al.Rural wastewater irrigation and nitrogen removal by the paddy wetland system in the Tai Lake region of China [J]. J Soil Sediment,2009,9(5):433-442.
[4]Li S,Li H,Liang X Q,et al.Phosphorus removal of rural wastewater by the paddy-rice-wetland system in Tai Lake Basin[J].J Hazard Mater,2009,171:301-308.
[5]Zhou Y,Zhu J Q,Li G,et al.The nutrients in the fertile water from fish pond assimilated and utilized by paddy field [J].J Irrig Drain Eng ,2011,30(5):78-81.
[6] 冯金飞,李凤博,吴殿星,等.稻作系统对淡水养殖池塘富营养化的修复效应及应用前景[J].生态学报, 2014,34(16):4480-4487.
[7] 陈柏湘.稻田对池塘养殖废水的净化研究[D].武汉:华中农业大学,2009.
[8] Li G,Zhu J Q, Zhang S Y,et al.Purification performance and production of a re-circulating pond aquaculture system based on paddy field[J]. Adv J Food Sci Tech,2012,4(6):383-388.
[9] Wang X G,He X G,Chen B X,et al.Rice field for the treatment of pond aquaculture effluents[J]. Afr J Biotechol ,2011,10(34):6456-6465.
[10]张 皓.养殖环境微生物群落的动态变化及与水环境的互作[D].江苏苏州:苏州大学, 2015.
[11] Moriarty D J W.The role of microorganisms in aquaculture ponds[J].Aquaculture,1997,151(1):333-349.
[12] 董 逸.我国黄、东海典型海域微生物群落结构及其与环境变化的关系[D].山东青岛:中国科学院研究生院(海洋研究所),2013.
[13] Williams S T, Foster P G, Littlewood D T J. The complete mitochondrial genome of a turbinid vetigastropod from MiSeq Illumina sequencing of genomic DNA and steps towards a resolved gastropod phylogeny[J].Gene,2013,533(1):38-47.
[12]张小平,王一冰,邓 斌,等.添加不同益生菌对草鱼养殖水体菌群结构的影响[J].水生生物学报, 2014,38(3):459-466.
[13] Sun Z, Li G, Wang C, et al. Community dynamics of prokaryotic and eukaryotic microbes in an estuary reservoir[J].Sci Rep, 2014,(4):6966.
[14] 任丽娟,何 聃,邢 鹏,等.湖泊水体细菌多样性及其生态功能研究进展[J].生物多样性,2013,21(4):421-432.
[15] 张小平.枯草芽孢杆菌SC02和施氏假单胞菌F1M对草鱼养殖水体水质的影响及机理研究[D].杭州:浙江大学,2014.
[16] Wu S D , Wang G T , Angert E R, et al. Composition, diversity, and origin of the bacterial community in grass carp intestine[J].Plos One, 2012,7(2):e30440.
[17] Kimura M. Populations, community composition and biomass of aquatic organisms in the floodwater of rice fields and effects of field management[J].Soil Sci Plant Nutr, 2005,51(2):159-181.
[18] 林 钦,朱志红.有益微生物专题之一:有益微生物菌群在水产养殖中的应用研究[J].中国水产, 2008,(10): 48-49.
[19] 王梦亮,王京伟,苏小睿.脱氮微生物对养殖水体有机氮去除作用的研究[J].水处理技术,2007,33(6):45-48,52.
[20]郑宗林,王广军,郑曙明. 二氧化氯对草鱼池塘环境异养菌数量及区系组成的影响[J].动物医学进展, 2015, 36(6):68-73.
[21]张 涵,周 涛,王 岩.综合养殖池塘中三角帆蚌和鱼类肠道细菌的组成[J].水生生物学报,2013,37(5):824-835.
[22]于世涛.精养池塘微囊藻的危害及控制[J].齐鲁渔业,2006,23(9):11-12.
[23] Stam M C,Mason P R D,Pallud C,et al.Sulfate reducing activity and sulfur isotope fractionation by natural microbial communities insediments of a hypersaline soda lake (Mono Lake, California) [J].Chem Geol, 2010, 278(1/2):23-30.
[24] 裘琼芬,张德民, 叶仙森,等.象山港网箱养殖对近海沉积物细菌群落的影响[J].生态学报, 2013, 33(2):483-491.
(责任编辑:邓 薇)
Characteristics of bacterioplankton communities in the outflow of ecological engineered paddy field recycling fishpond tail water
TAO Ling1,2,3, LI Xiao-li2,ZHU Jian-qiang1,LI Gu2
( 1.EngineeringResearchCenteronEcologyofWetlandandAgriculturalUse,MinistryofEducation,YangtzeUniversity,Jingzhou434025,China; 2 .YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China; 3.FreshwaterAquacultureCollaborativeInnovationCenterofHubeiProvince,Wuhan430070,China)
The community structure and diversity of bacterioplankton communities in the inflow and outflow of the engineered paddy field were analyzed and compared based on the Illumina MiSeq second generation high-throughput sequencing technology to characterize the effects of ecological engineed paddy field recycling the tail water from fishpond on the bacterioplankton communities.The results showed that the bacterioplankton community composition at phylum level in the inflow and outflow of the engineered paddy field was similar and the dorminatnt phylums were Cyanobacteria, Proteobacteria, Actinobacteria, Planctomycetes and Bacteroidetes.However, their relative abundances were different.The relative abundance of Cyanobacteria was significantly decreased from 46.72% in the inflow to 41.82% in the surface outflow and 34.77% in the subsurface outflow.The relative abundance of Actinobacteria significantly increased from 3.90% in the inflow to 5.65% in the surface outflow and 6.45% in the subsurface outflow.The bacterioplankton community composition at genus level was also similar whereas the relative abundance ofMicrocystissignificantly reduced from 0.83% to 0.46% in the subsurface outflow(P<0.05).The species richness index (Chao 1) of bacterioplankton communities significantly increased in the surface outflow.The Shannon diversity index significantly increased and the Simpson index significantly decreased in the subsurface outflow(P<0.05).
pond aquaculture; ecological engineering; paddy field; bacterioplankton; high-throughput DNA sequencing
2016-04-07;
2016-10-08
“十二五”国家科技支撑计划(2015BAD13B03,2012BAD25B05);现代农业产业技术体系建设专项资金(CARS-46);公益性行业(农业)科研专项经费(201203083)
陶 玲(1981- ),女,四川什邡人,助理研究员,专业方向为池塘生态养殖。E-mail:taolingcjs@yfi.ac.cn
李 谷。E-mail:ligu667@yahoo.com
S959
A
1000-6907-(2017)01-0071-07
