鲤疱疹病毒II型ORF4基因的克隆、表达与免疫学检测方法
2017-02-09范玉顶刘文枝曾令兵
周 勇,范玉顶,徐 进,马 杰,江 南,刘文枝,曾令兵
(中国水产科学研究院长江水产研究所,武汉430223)
鲤疱疹病毒II型ORF4基因的克隆、表达与免疫学检测方法
周 勇,范玉顶,徐 进,马 杰,江 南,刘文枝,曾令兵
(中国水产科学研究院长江水产研究所,武汉430223)
根据鲤疱疹病毒II型(Cyprinid herpesvirus II,CyHV-2)ORF 4基因序列(GenBank: JQ815364.1)设计特异性引物,PCR扩增得到ORF 4基因编码框全长序列1 041 bp,将其克隆至原核表达载体pET-32a(+)中,构建了重组原核表达载体pET-32a-ORF 4。将pET-32a-ORF 4重组载体转化大肠杆菌BL21(DE3),经IPTG诱导得到融合表达的重组蛋白,融合表达的重组蛋白主要以包涵体的形式存在,其分子质量约为57 ku,与预期大小一致。将纯化的重组蛋白免疫日本大耳兔,制备了多克隆抗体,ELISA检测抗体效价大于1∶50 000,Western blot检测显示该抗体可以特异性识别重组蛋白。间接免疫荧光检测结果表明:该多克隆抗体可与由CyHV-2感染引起细胞病变的异育银鲫脑组织细胞(GICB)发生特异性的结合。
鲤疱疹病毒II型;ORF 4;原核表达;多克隆抗体;免疫荧光检测
鲫(Carassiusauratusgibelio)是我国重要的淡水养殖鱼类。近年来,在鲫养殖过程中出现的病害问题,严重制约了鲫养殖业的健康发展。其中,鲤疱疹病毒II型(cyprinid herpesvirus 2,CyHV-2)感染养殖鲫引起的疱疹病毒性造血器官坏死症(herpesviral haematopoietic necrosis,HVHN)危害最为严重[1, 2-3],该病毒可感染各种规格的鲫,死亡率高达90%~100%[2]。
鲤疹病毒II型(CyHV-2)是第二个分离自鲤科鱼的疱疹病毒,与鲤痘疮病毒(Carp pox herpesvirus,Cyprinid herpesvirus I, CyHV-1)及锦鲤疱疹病毒(Koi herpesvirus,Cyprinid herpesvirus 3,CyHV-3)的关系接近,同属于异样疱疹病毒科鲤疱疹病毒属成员[4]。1992年,日本首次报道了CyHV-2引起养殖金鱼大规模死亡[5],随后在美国[6-7]、台湾[8]、澳大利亚[9]、新西兰[10]及英国[11]养殖的金鱼中都检测到该病毒。2011年,匈牙利首次报道了养殖的银鲫感染CyHV-2的病例[3],我国是继匈牙利后第二个从养殖鲫体内分离到CyHV-2病毒的国家,由该病毒引起的鲫大规模死亡已给我国鲫养殖业造成巨大的经济损失[2, 12]。
目前,对于鲤疱疹病毒II型检测方法有PCR[13]、双重PCR[14]、荧光实时定量PCR[15]、环介导的等温扩增[16-17]、电镜观察[4]及细胞培养分离[18]等方法。但尚未见利用免疫学技术检测鲤疱疹病毒II型的文献报道。本实验通过克隆与原核表达CyHV-2 ORF 4基因,表达产物纯化后注射免疫日本大白兔制备抗CyHV-2 ORF 4蛋白的多克隆抗体,建立了CyHV-2免疫学检测方法,并为进一步研究CyHV-2 ORF4基因编码蛋白的功能奠定前期基础。
1 材料和方法
1.1 材料
1.1.1 病毒株、细胞系、菌株与质粒
鲤疱疹病毒II型(CyHV-2)由本实验室从患典型造血器官坏死症的养殖鲫体内分离与鉴定[2];鲫脑组织细胞系(GICB)由本实验室建立与保存[18];原核表达载体pET-32a(+)、表达菌株BL21(DE3)购于Novagen公司;pMD19-T载体购于TaKaRa公司。
1.1.2 主要试剂及仪器
限制性内切酶BamH I、HindIII (Promega)、T4 DNA连接酶(TakaRa)、HRP标记的羊抗兔IgG(Abclonal Biotechology)、病毒DNA提取试剂盒(OMEGA)、胶回收试剂盒(OMEGA)、质粒提取试剂盒(Promega)、免疫荧光染色试剂盒(碧云天)、化学发光底物(Thermo)。
离心机(Sigma,3K-15)、化学发光成像与分析系统(Bio-Rad,ChemiDocTMXRS+)、PCR仪(Biometra,T-professional)、低温恒温槽(上海恒平科学仪器有限公司)、小型垂直电泳槽(Bio-Rad,Mini-PROTEAN®Tetra System)、酶标仪(Bio-Rad,iMarkTM)、半干转印槽(Bio-Rad,TRANS-BLOT®SD)、倒置荧光显微镜(Leica,DFC420C)。
1.2 CyHV-2 ORF 4基因的克隆
根据CyHV-2 ORF 4基因序列(GENBANK登录号:NC 019495.1),设计一对引物ORF 4-F∶5-CGGAATTCATGTCTTCTGTAACCG-3和ORF 4-R∶5’-CCAAGCTTTTACAAGATTGGGAATC-3。采用病毒DNA提取试剂盒(OMEGA),从GICB细胞增殖培养的CyHV-2 中提取病毒DNA作为PCR模板,进行PCR扩增。PCR扩增反应采用50 μL反应体系:10×PCR Buffer 5 μL,dNTP(10 mmol/L) 1 μL,Primers(ORF 4-F/ ORF 4-R,10 μmol/L)各1 μL,rTaq DNA聚合酶(5 U/μL)1 μL,DNA 模板为0.5 μL,ddH2O补足至50 μL。PCR扩增程序为:95 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR 产物经1.0%琼脂糖凝胶电泳分离后,经胶回收试剂盒回收目的片段,将纯化的的ORF 4基因与pMD19-T载体于16 ℃ 连接4 h后,转化到大肠杆菌DH5α感受细胞中,筛选阳性克隆,命名为:pMD19-T-ORF 4,送上海生工生物工程有限公司测序。
1.3 原核表达载体的构建
重组质粒pMD19-T-ORF 4与原核表达载体pET-32a(+)分别由BamH I和HindIII双酶切,经1.0%琼脂糖凝胶电泳分离后,胶回收试剂盒回收目的片段,用T4 DNA连接酶16 ℃连接过夜,转化到大肠杆菌BL21(DE3)感受态细胞中,PCR筛选阳性克隆,扩大培养后提取质粒,经酶切鉴定后,命名为:pET-32a-ORF 4,送上海生工生物工程有限公司测序。
1.4 重组蛋白诱导表达及纯化
将培养过夜的阳性重组菌pET-32a-ORF 4/BL21以1∶100的比例接种到LB液体培养基(含50 μg/mL Amp)中,37℃ 200 r/min振荡培养至菌液OD600nm为0.4-0.6时,加入终浓度为1 mmol/L的IPTG,诱导4 h后取样,进行SDS-PAGE分析。经过诱导的重组菌株经超声波破碎处理,离心去上清,沉淀溶解在适量的磷酸钠缓冲液(含8 mol/L尿素)中,然后参照蛋白纯化试剂盒(Promega,HisLink Spin Protein Purification System)对重组蛋白进行纯化。
1.5 多克隆抗体制备及效价测定
取纯化后的重组蛋白0.6 mg采用皮下多点注射法免疫日本大耳兔(免疫前采集正常血清作为阴性对照),以后每2周加强免疫一次,共5次。首次免疫加入与重组蛋白等量弗氏完全佐剂,后4次加入与重组蛋白等量弗氏不完全佐剂。末次加强免疫后7 d心脏采血,分离血清。抗血清经抗体亲和纯化得到纯化的多克隆抗体。以纯化的重组蛋白为抗原,以每孔100 μg的浓度4 ℃包被96孔板,待测多克隆抗体为一抗,按1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶16 000,1∶32 000,1∶64 000,1∶128 000,1∶256 000,1∶512 000的比例稀释待测多抗,将注射佐剂加PBS的阴性血清以1∶1 000,1∶4 000稀释作为阴性对照。用HRP标记的羊抗兔IgG为二抗,以四甲基苯胺(TMB)溶液显色后用酶标仪测定OD450nm,以确定抗体效价。
1.6 Western blot分析
将诱导表达的重组菌pET-32a-ORF 4/BL21进行SDS-PAGE电泳后,转移至硝酸纤维素膜上,用含有20 g/L BSA的PBST(含有终浓度为0.05%的Tween-20)室温封闭1 h,用制备的抗体室温孵育1 h,PBST(含有终浓度为0.05%的Tween-20)洗膜后,用HRP标记的羊抗兔IgG抗体室温孵育1 h,再次清洗,最后用化学发光底物工作液孵育5 min显色。同时用未经诱导表达的重组菌pET-32a-ORF 4/BL21作为对照进行相同操作。
1.7 间接免疫荧光检测
以纯化的多克隆抗体为一抗,红色荧光探针标记的羊抗兔IgG(H+L)抗体为二抗,参照免疫荧光染色试剂盒(碧云天,免疫荧光染色试剂盒—抗兔Cy3)对感染CyHV-2的GICB细胞进行检测,并用DAPI染色细胞核。同时设置未感染CyHV-2的GICB细胞作为对照进行相同操作。
2 结果
2.1 CyHV-2 ORF 4基因的克隆
PCR扩增反应从抽提的CyHV-2总DNA中扩增出目的片段,经1.0%琼脂糖凝胶电泳分析该片段大小约为1 000 bp,其分子质量与预期大小一致(图1)。胶回收PCR产物,连接pMD19-T载体,转化大肠杆菌感受态细胞,获得了阳性重组菌株pMD19-T-ORF 4/DH5α。测序结果表明成功克隆了大小为1 041 bp的目的片段至T载体中。
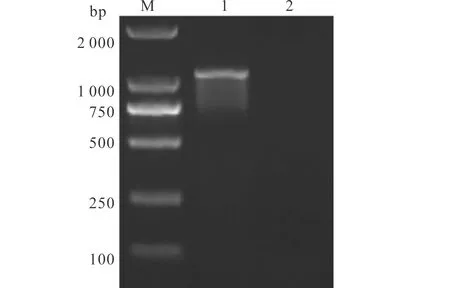
图1 PCR产物琼脂糖凝胶电泳;Fig.1 Agarose gel electrophoresis of PCR products M:DL2000 DNA Mark;1:PCR产物;2:阴性对照
2.2 重组表达载体的构建及鉴定
经BamH I和HindIII 双酶切的pET-32a(+),与ORF 4基因连接后,转化大肠杆菌BL21(DE3)感受态细胞,PCR鉴定获得了阳性重组菌株pET-32a-ORF 4/BL21。提取重组质粒经BamH I 和HindIII双酶切鉴定,琼脂糖凝胶电泳结果表明双酶切得到的目的片段以及PCR鉴定阳性克隆的产物均与预期大小的核酸片段相同(图2)。 测序结果进一步表明ORF 4基因被正确地插入到pET-32a(+)载体上,重组表达载体构建成功。
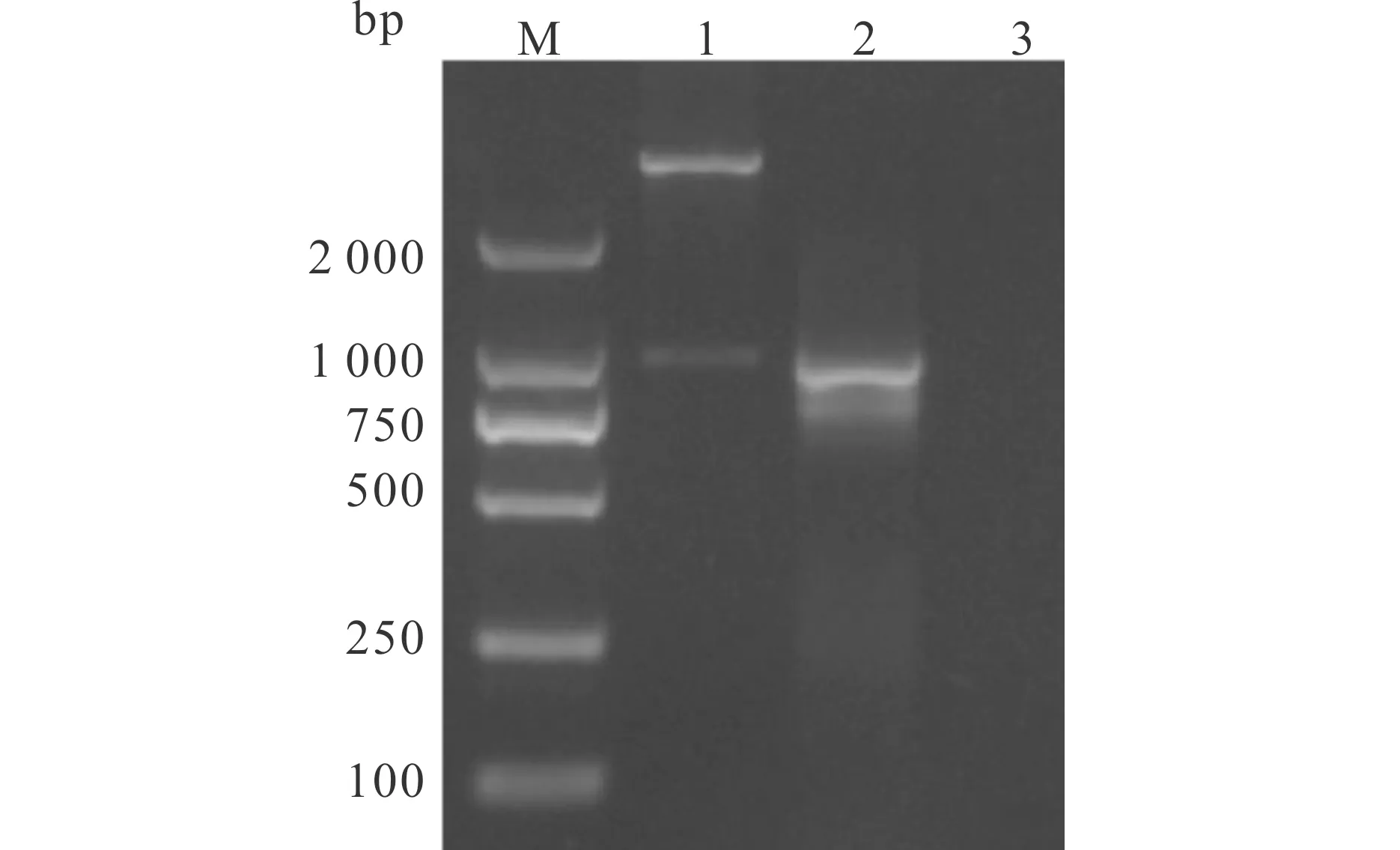
图2 重组质粒pET-32a-ORF 4酶切、PCR鉴定结果Fig.2 Identification of recombinant expression plasmid by restriction enzyme digestion analysis and PCRM∶ DL2000 DNA marker;1∶经BamHⅠ和Hind Ⅲ双酶切的重组质粒;2∶PCR鉴定阳性克隆产物;3∶PCR阴性对照。
2.3 重组蛋白的表达
SDS-PAGE分析表明,重组菌株pET-32a-ORF 4/BL21经1 mmol/L的IPTG 于37 ℃的条件下诱导4 h,能有效地诱导重组菌株中CyHV-2 ORF 4基因的表达,表达的蛋白分子质量约为57 ku,与预期大小一致(图3)。诱导表达的菌体通过超声破碎处理后,表达产物主要存在于超声破碎后的沉淀中,说明表达的蛋白主要以包涵体形式存在(图4)。

图3 重组质粒表达的CyHV-2蛋白SDS-PAGE分析Fig.3 SDS-PAGE analysis of CyHV-2 ORF 4 protein expressed by recombinant plasmid M∶蛋白分子标准;1-8∶诱导;9∶未诱导
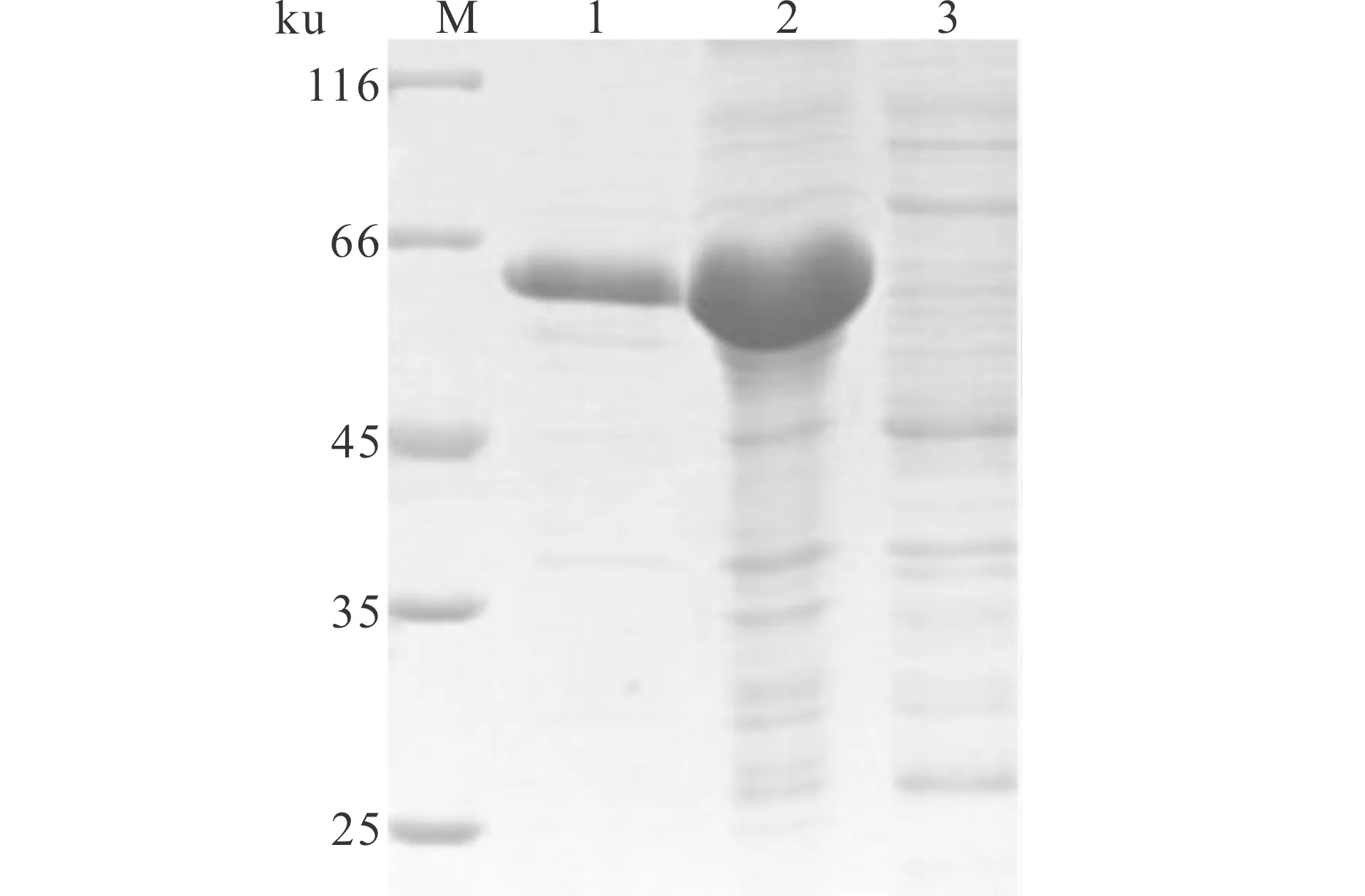
图4 CyHV-2 ORF 4蛋白的表达形式分析Fig.4 Analysis of CyHV-2 ORF 4 protein expression formM∶蛋白分子标准;1∶超声沉淀;2∶超声沉淀;3∶超声上清
2.4 重组蛋白多克隆抗体的制备及检测
收集经过5次免疫的日本大耳兔抗血清,抗血清经抗体亲和纯化得到纯化的多克隆抗体,浓度为4.75 mg/mL。经ELISA法测定,抗体效价大于1∶50 000。Western blot结果表明:多克隆抗体能特异性地结合重组蛋白(图5)。

图5 CyHV-2 ORF 4蛋白的Western blot分析Fig.5 Western blot analysis of expressed CyHV-2 ORF 4 protein with the polyclonal antibodies M∶蛋白分子标准;1∶诱导的Western blot检测;4∶未诱导的Western blot检测
2.6 间接免疫荧光检测
将感染CyHV-2的GICB细胞和未处理的正常GICB细胞依次与多克隆抗体和红色荧光探针标记的羊抗兔IgG抗体孵育。荧光显微镜下观察显示,感染CyHV-2的GICB细胞在绿光激发下呈现出红色,而没有感染CyHV-2的GICB细胞则没有红色荧光出现(图6)。说明制备的多抗能够特异性地检测CyHV-2。

图6 免疫荧光检测GICB细胞中的CyHV-2Fig.6 Detection CyHV-2 in GICB cells by the immunofluorescence A∶DAPI染色感染CyHV-2的GICB细胞;B∶绿色荧光下的感染CyHV-2的GICB细胞;C∶A和B融合图;D∶DAPI染色正常的GICB细胞;E∶绿色荧光下的正常的GICB细胞;F∶D和E融合图(标尺大小∶50 μm)
3 讨论
近年来,鲤疱疹病毒II型(CyHV-2)感染养殖鲫引起的鲫造血器官坏死症给水产养殖业造成了重大经济损失[2]。CyHV-2是一种大DNA病毒,其基因组全长290 304 bp(GenBank∶ JQ815364.1),包含154个基因开放阅读框,其中ORF 4和ORF 151A编码了肿瘤坏死因子受体类似物(Tumour Necrosis Factor Receptor, TNFR),此类蛋白可能在CyHV-2的免疫逃避中发挥作用[19]。通过Genbank氨基酸比对发现CyHV-2 ORF 4与草鱼TNFR、斑马鱼TNFR和大西洋鲑TNFR的相似性分别为27%、25%和27%,与石斑鱼虹彩病毒vTNFR和牛痘病毒vTNFR的相似性分别为28%和31%。
本研究通过PCR技术从CyHV-2基因组DNA中扩增得到完整的ORF 4基因,将其克隆至原核表达载体pET-32a(+)中,构建了重组原核表达载体pET-32a-ORF 4。pET表达系统与重组蛋白在大肠杆菌中表达的其他系统相比,具有很高的表达效率。该系统是一种带有T7 噬菌体lac 强启动子的原核高效融合蛋白表达载体,由lac 启动子和编码硫氧还蛋白(109个氨基酸,Trx-Tag)、组氨酸(6个氨基酸,His-Tag)及S标签(15个氨基酸,S-Tag)的基因组成。在其下游多克隆位点插入外源基因,经IPTG 诱导,可表达出含有S-Tag、His-Tag、Trx-Tag和外源基因的融合蛋白。由于ORF 4编码蛋白与上述标签蛋白的融合表达,所以本实验表达的重组蛋白分子量比原始ORF 4编码蛋白大18 ku,约为57 ku,与预测分子质量基本一致。对表达的重组蛋白可溶性分析显示,该重组蛋白主要以包涵体形式存在,这可能主要与目的蛋白自身氨基酸的组成和标签蛋白有关。根据6×His与金属Ni2+高亲和力结合的特性,利用Ni-NTA 赘合物树脂对重组蛋白直接进行纯化。
将纯化的重组蛋白与佐剂完全乳化后采用5次免疫程序免疫日本大耳兔,成功地制备了抗ORF 4 编码蛋白的特异性多克隆抗体。Western blot得到一条与预期大小一致蛋白杂交带,说明多克隆抗体特异性较好,纯度较高。本研究制备的多克隆抗体能在病变的GICB细胞中特异性地结合CyHV-2 ORF4编码蛋白,表明该多克隆抗体可应用于CyHV-2的免疫诊断。但由于CyHV-2 ORF4编码蛋白不是该病毒的膜蛋白,制备的多克隆抗体是否能检测到完整的病毒粒子还需进一步试验验证。
本研究建立了一种CyHV-2免疫学诊断方法,不仅丰富了该病毒的检测方法,对CyHV-2病毒的免疫学诊断与防控技术研究具有重要意义。而且为今后深入研究CyHV-2 ORF4基因编码蛋白的功能奠定了前期基础。
[1] Luo Y Z, Lin L, Liu Y, et al. Haematopoietic necrosis of cultured silver prussian carp (Carassiusgibelio) associated with cyprinid herpesvirus[J]. J Fish Dis, 2013, 36(12):1035-1039.
[2] Xu J, Zeng L B, Zhang H, et al. Cyprinid herpesvirus 2 infection emerged in cultured gibel carp,Carassiusauratusgibelioin China[J]. Vet Microbiol, 2013, 166, 138-144.
[3] Doszpoly A, Benko M, Csaba G. Introduction of the family Alloherpesviridae: the first molecular detection of herpesviruses of cyprinid fish in Hungary[J]. Magy Allatorvosok, 2011, 133:174-181.
[4] Waltzek T B, Kelley G O, Stine D M, et al. A viral erizztic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology[J]. J Vet Diagn Invest, 1998, 10 (4): 375-378.
[5] Jung S J, Miyazaki T. Herpesviral haematopoietic necrosis of goldfish,Carassiusauratus(L.)[J]. J Fish Dis, 1995, 18:211-220.
[6] Goodwin A E, Khoo L, LaPatra S E, et al. Goldfish hematopoietic necrosis herpesvirus (cyprinid herpesvirus 2) in the USA: molecular confirmation of isolates from diseased fish[J]. J Aquat Anim Health, 2006, 18:11-18.
[7] Groff J M, LaPatra S E, Munn R J, et al. A viral epizootic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology[J]. J Vet Diagn Invest, 1998, 10:375-378.
[8] Chang P H, Lee S H, Chiang H C, et al. Epizootic of herpes-like virus infection in goldfish,Carassiusauratusin Taiwan[J]. Fish Pathol, 1999, 34:209-210.
[9] Stephens F J, Raidal S R, Jones B. Haematopoietic necrosis in a goldfish (Carassiusauratus) associated with an agent morphologically similar to herpesvirus[J]. Aust Vet J, 2004,82:167-169.
[10] Hine P M, Tham K M, Morrison R. Cyprinid herpesvirus 2 in New Zealand goldfish[J]. Surveillance, 2006, 33:3-5.
[11] Jeffery K R, Bateman K, Bayley A, et al. Isolation of a cyprinid herpesvirus 2 from goldfish,Carassiusauratus(L.), in the UK[J]. J Fish Dis, 2007, 30:649-656.
[12] Wang L, He J, Liang L, et al. Mass mortality caused by Cyprinid Herpesvirus 2 (CyHV-2) in Prussian carp (Carassiusgibelio) in China[J]. B Eur Assoc Fish Pat, 2012, 32:164-173.
[13]李莉娟,罗杨志,刘学芹,等.金鱼鲤疱疹病毒II型的分子诊断[J].华中农业大学学报,2013,32(1):92-96.
[14]罗 丹,梁利国,谢 骏,等.2型鲤疱疹病毒双重PCR快速检测方法的建立及应用[J].中国预防兽医学报,2014,36(5):379-382.
[15]周 勇,曾令兵,张 辉,等.鲤疱疹病毒II型TaqMan real-time PCR检测方法的建立及应用[J].水产学报,2013,37(4):607-613.
[16] He J, Shi X, Yu L, et al. Development and evaluation of a loop-mediated isothermal amplification assay for diagnosis of Cyprinid herpesvirus 2[J]. J Virol Methods, 2013, 194:206-210.
[17] Zhang H, Zeng L B, Fan Y D, et al. A loop-mediated isothermal amplification assay for rapid detection of Cyprinid Herpesvirus 2 in gibel carp (Carassiusauratusgibelio)[J]. Sci World J, 2014, Article ID 716413, 6.
[18] Ma J, Jiang N, Scott E L, et al. Establishment of a novel and highly permissive cell line for the efficient replication of cyprinid herpesvirus 2 (CyHV-2)[J]. Vet Microbiol, 2015, 177:315-325.[19] Davison A J, Kurobe T, Gatherer D, et al. Comparative genomics of carp herpesviruses[J]. J Virol, 2013, 87(5): 2908-2922.
(责任编辑:张潇峮)
Cloning, expression and immunological assay of ORF 4 encoding protein of Cyprinid herpesvirus II
ZHOU Yong, FAN Yu-ding, XU Jin, MA Jie, JIANG Nan, LIU Wen-zhi, ZENG Ling-bing
(YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China)
The specific primer pairs were designed according to the ORF 4 gene sequence of Cyprinid herpesvirus II (CyHV-2) and the 1041bp full-length sequence of ORF4 gene coding frame was amplified by PCR, and then the full-length CyHV-2 ORF 4 gene was cloned into prokaryotic expression vector pET-32a(+) to construct the recombinant expression vector pET-32a-ORF 4. The recombinant expression vector pET-32a-ORF 4 was successfully expressed inE.coliBL21 (DE3) as a fusion protein with a size of 57 ku after induction by isopropyl-β-D-thiogalactoside (IPTG).The recombinant protein was presented mainly in inclusion body. The purified recombinant proteins were used to immune Japanese white rabbit to produce polyclonal antibody. Titer of polyclonal antibodies was above 1∶50 000. Western blot test demonstrated that the recombinant protein was recognized by the polyclonal antibody.
Cyprinid herpesvirus II (CyHV-2); ORF 4; prokaryotic expression; polyclonal antibodies; immunological assay
2015-06-05;
2015-08-25
国家“现代农业产业技术体系建设专项资金”(nycytx-46-11);中国水产科学研究院基本科研业务费专项课题(2016HY-200501);武汉市科技计划项目(2016020101010083)
周 勇(1984- ),男,助理研究员,研究方向为水生动物病害。E-mail:zhouy@yfi.ac.cn
曾令兵。E-mail: zlb@yfi.ac.cn
S941.41
A
1000-6907-(2017)01-0061-05
