紫外诱变选育米曲霉氨肽酶高产菌株
2017-02-08李鹏张艳芳王军韩玉婷王选年
李鹏,张艳芳,王军,2,韩玉婷,王选年*
(1.新乡学院 生命科学与技术学院生物技术研究中心,河南 新乡 453003;2.郑州大学 生命科学学院,郑州 450000)
紫外诱变选育米曲霉氨肽酶高产菌株
李鹏1,2,张艳芳1,王军1,2,韩玉婷1,王选年1*
(1.新乡学院 生命科学与技术学院生物技术研究中心,河南 新乡 453003;2.郑州大学 生命科学学院,郑州 450000)
以米曲霉CICC2066菌株为出发菌株进行紫外诱变,经过多次筛选后得到3株氨肽酶活力显著提高且遗传性较稳定的诱变株UY-15,UY-17和UY-20。将3株诱变株与出发菌株进行发酵实验性能比较,结果表明:米曲霉UY-15,UY-17和UY-20培养42 h后制曲中氨肽酶活力分别是出发菌株的1.24,1.38,1.54倍,且UY-20中性蛋白酶活力较出发菌株提高了7%。3株诱变株的孢子量较出发菌株具有优势。
米曲霉;紫外诱变;氨肽酶
氨肽酶不仅能够水解多肽,还能水解完整的蛋白酶[1]。在食品工业上通常与其他蛋白酶复合使用来进行发酵生产[2]。米曲霉是氨肽酶的重要来源菌之一[3]。目前亮氨酸氨肽酶(LAPs)已经成为最被关注的氨肽酶之一,LAPs通过对蛋白水解产物中苦味肽的水解并释放游离氨基酸,达到改善蛋白水解物的风味、缩短加工周期、提高营养价值的目的[4-6]。
传统酱油的发酵生产是利用米曲霉生长过程中产生的丰富酶系水解蛋白质、淀粉产生氨基酸、葡萄糖等物质,从而形成酱油产品独特的色、香、味、体[7],所以在酱油酿造过程中菌种的优劣决定了产品的品质。当前各生产单位所使用的高产菌株,几乎都是通过诱变育种来提高产量、扩大品种、改善产品质量、简化生产工艺[8]。司晓光等[9]对米曲霉3.042菌株进行了常压室温等离子体(ARTP)诱变,使酸性蛋白酶的活性提高了39.9%;吴冬梅等[10]通过对一株米曲霉出发菌进行紫外诱变,使中性蛋白酶的的酶活力提高了1倍。但是这些研究多集中在对中性蛋白酶及酸性蛋白酶方面,对氨肽酶活性进行考察的比较少。本研究以购买的CICC2066米曲霉菌株为出发菌株进行紫外诱变,以期提高目标菌株制曲42 h后产氨肽酶量与中性蛋白酶活性在42 h达到峰值保持一致,从而更好地应用于发酵生产中。
1 材料与方法
1.1 菌种
米曲霉(Aspergillusoryzae)菌株CICC2066:购于中国工业微生物菌种保藏中心。
1.2 培养基
1.2.1 斜面培养基
PDA培养基。
1.2.2 蛋白酶复筛培养基
制曲培养基。
1.2.3 氨肽酶活力筛选培养基
蔗糖30 g/L,LNA 0.5 g/L,MgSO4·7H2O0.5 g/L,KH2PO410.0 g/L,琼脂粉17 g/L,无菌水1000 mL,pH 6.4,121 ℃灭菌20 min。
1.3 实验方法
1.3.1 粗酶液的提取方法
1.3.1.1 中性蛋白酶粗酶液
取1 g于30 ℃培养后的固体干曲,按照1∶20(g/mL)加入0.1 mol/L pH 7.2 磷酸缓冲液,于40 ℃水浴中浸提1 h,间歇搅拌,用4层纱布过滤即得粗酶液。
1.3.1.2 氨肽酶粗酶液
取1 g于30 ℃培养后的固体干曲,按照1∶20(g/mL)加入0.1 mol/L pH 7.2磷酸盐缓冲液,放置4 ℃过夜,4层纱布过滤得粗酶液。
1.3.2 酶活性的测定方法
1.3.2.1 中性蛋白酶测定
采用福林-酚法,参考GB/T 23527-2009蛋白酶活力测定法。中性蛋白酶的测定pH值为7.2。
酶活定义:1 g干曲在40 ℃,pH 7.2条件下,1 min水解酪素产生1 μg酪氨酸为1个酶活力单位。
酶活力计算公式:U=A×K×4/10×n。
式中:A为平均吸光度值;K为吸光常数;4为反应试剂的总体积;10为反应时间;n为酶液稀释倍数。
1.3.2.2 氨肽酶测定
采用亮氨酸对硝基苯胺法。酶活定义:在40 ℃,pH 7.2的条件下,每1 min水解亮氨酸对硝基苯胺生成1 μg对硝基苯胺(pNA)所需的酶量定义为1个酶活力单位。
酶活力计算公式:U= A×V1×D/(k×t×V2)。
式中:A为平均吸光度值;V1为反应总体积;V2为酶液体积;D为酶液的稀释倍数;k为消光系数;t为恒温反应时间。
1.3.3 菌种诱变
1.3.3.1 致死率确定
将5 mL菌悬液(1.28×107个孢子/mL)置于6 cm的无菌培养皿中,距离30 W 紫外灯的距离为30 cm左右,分别处理0,2,4,6,8,10 min;取0.5 mL处理后的菌液进行10-1~ 10-5梯度稀释分离,取其中的10-3,10-4,10-53个稀释度各200 μL菌液涂布平板,设置3组重复,30 ℃倒置培养(避光培养)。培养3天后,进行平板菌落计数,计算致死率。

1.3.3.2 紫外诱变初筛
经氨肽酶水解LNA后对硝基苯胺在筛选培养基上呈现黄色,根据黄色水解圈的大小采用LNA筛选平板法进行初筛;分别测定HE值(HE值=水解圈直径/菌落直径),选择HE值较对照大者移入PDA斜面,30 ℃培养4天,4 ℃保存备用。
1.3.3.3 紫外诱变复筛
将经过初筛后所得菌株制成孢子悬液,吸取1 mL孢子悬液(1.28×107个孢子/mL) 接种于蛋白酶复筛培养基三角瓶中,于30 ℃ 培养,制曲42 h,测定其氨肽酶和中性蛋白酶活力。
1.3.3.4 遗传稳定性测定
将复筛得到的菌株在PDA斜面上连续传代5次,每次传代后在蛋白酶复筛培养基中培养并测定其氨肽酶和中性蛋白酶活力。
1.3.3.5 性能测定
米曲霉UY-15,UY-17和UY-20菌株与出发菌株的性能比较:氨肽酶和中性蛋白酶活力测定方法同上,生长速度的测定采用直线生长法,孢子数测定采用悬滴法(ZBX 66028-87)。
2 结果与讨论
2.1 CICC2066菌株中性蛋白酶和氨肽酶活性检测结果
CICC2066菌株制曲过程中性蛋白酶活性变化见图1,中性蛋白酶活性在42 h达到最高的830.8 U/g(干曲)。
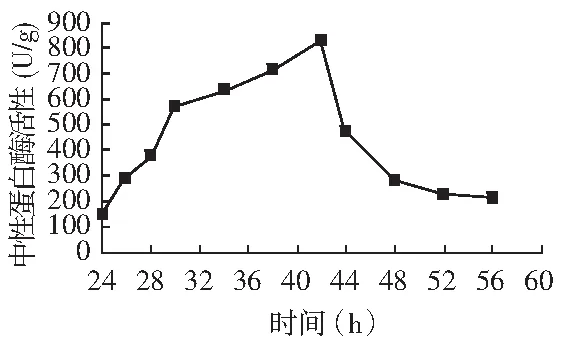
图1 CICC2066菌株曲中性蛋白酶活性
CICC2066菌株制曲过程中氨肽酶活性变化见图2,其氨肽酶活性在60 h达到201.4 U/mL。虽然菌株氨肽酶活性较高,但氨肽酶产量在60 h才达到峰值,不能与中性蛋白酶在42 h的最高产酶量保持一致,从而不能有效地水解多肽和提高酱油酿造过程中游离氨基酸的生成率,所以提高菌株制曲42 h的产氨肽酶量是有必要的。
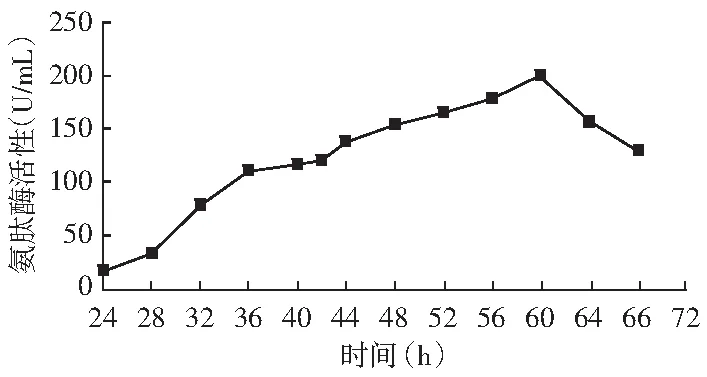
图2 CICC2066菌株曲氨肽酶活性
2.2 紫外诱变
2.2.1 诱变条件的确定
本研究采用紫外诱变的方式进行菌种选育,根据经验可知,当致死率达到75%左右时正突变率最高[11],因此选择75%左右致死率的致死剂量。
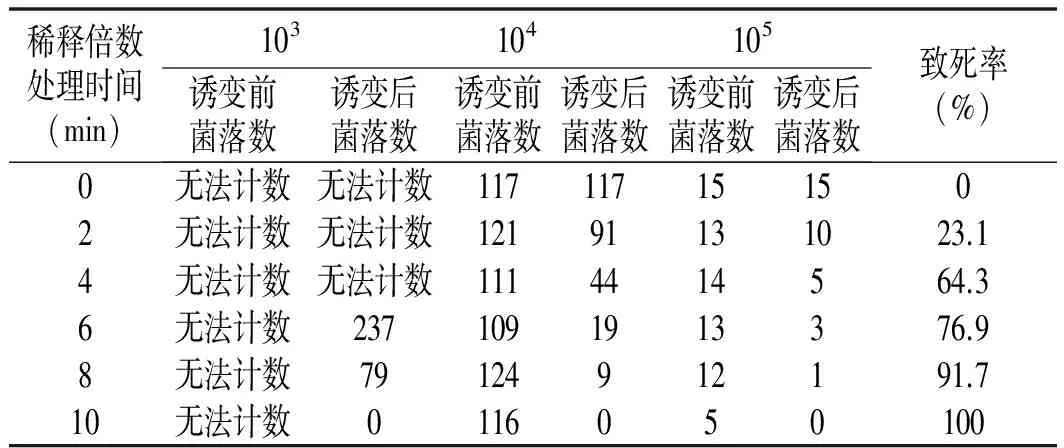
表1 不同紫外照射时间及稀释倍数的诱变结果
由表1可知,诱变后稀释倍数为103时,由于原始孢子液浓度为1.28×107个孢子/mL,所以很难计算菌落数。当诱变后稀释倍数为104时,虽然可以计算,但菌落紧贴无法看清水解圈,所以选择稀释倍数最佳的105。因此,最佳诱变条件是30 W照射灯,距离30 cm,照射时间6 min,诱变后稀释倍数105。
2.2.2 初筛
氨肽酶筛选平板培养3天后,测定单菌落的水解圈直径与菌落直径,计算HE值,HE值=透明圈直径/菌落直径,选择HE值增大的20株菌株进行复筛。
2.2.3 复筛
将初筛获得的20株诱变株进行PDA斜面传代培养,培养4天后将孢子液(1.28×107个孢子/mL)接入蛋白酶复筛培养基,检测其氨肽酶和中性蛋白酶制曲42 h酶活性,检测结果见图3和图4。
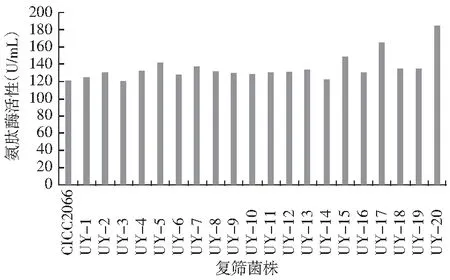
图3 各诱变菌株第一次复筛时氨肽酶活性
由图3可知,诱变菌株第1次复筛氨肽酶活性在120~184.3 U/mL,经比较其中UY-5,UY-7,UY-15,UY-17和UY-20的氨肽酶活性较高。
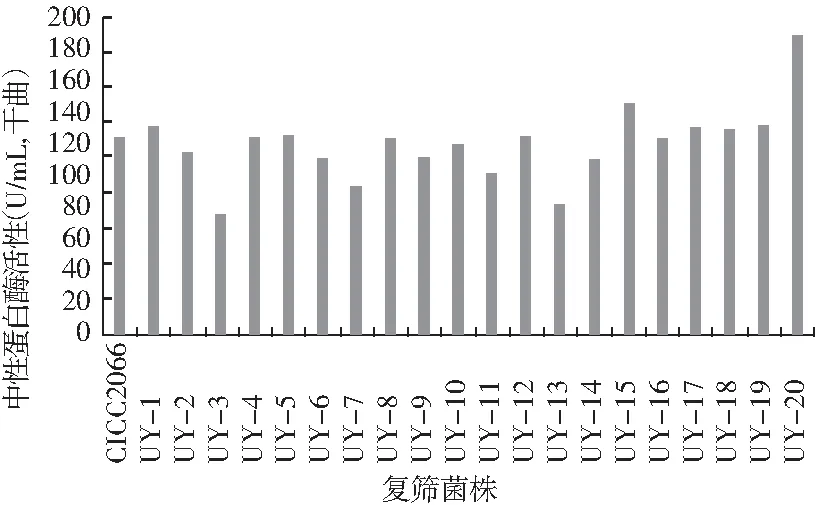
图4 各诱变菌株第一次复筛时中性蛋白酶活性
由图4可知,20株诱变菌株中性蛋白酶活性在787.4~889.04 U/g(干曲),CICC2066菌株活性为830.8 U/g(干曲)。其中UY-1,UY-15,UY-17,UY-18,UY-19和UY-20的中性蛋白酶活性高于原始菌株,但UY-17,UY-18,UY-19提高得很不明显。结合图3中各菌株氨肽酶活性,选择UY-1,UY-15,UY-17,UY-20 4株 诱变株作为目标菌株进行进一步研究。
2.2.4 高产突变株的确定和遗传稳定性研究
将UY-1,UY-15,UY-17,UY-20菌株分别经过3轮发酵产酶能力测试,在不低于出发菌株中性蛋白酶活性的基础下,最终筛选出3株具有产酶优势的突变株UY-15,UY-17,UY-20。将UY-15,UY-17和UY-20分别传代5次做遗传稳定性考察,结果见表2。
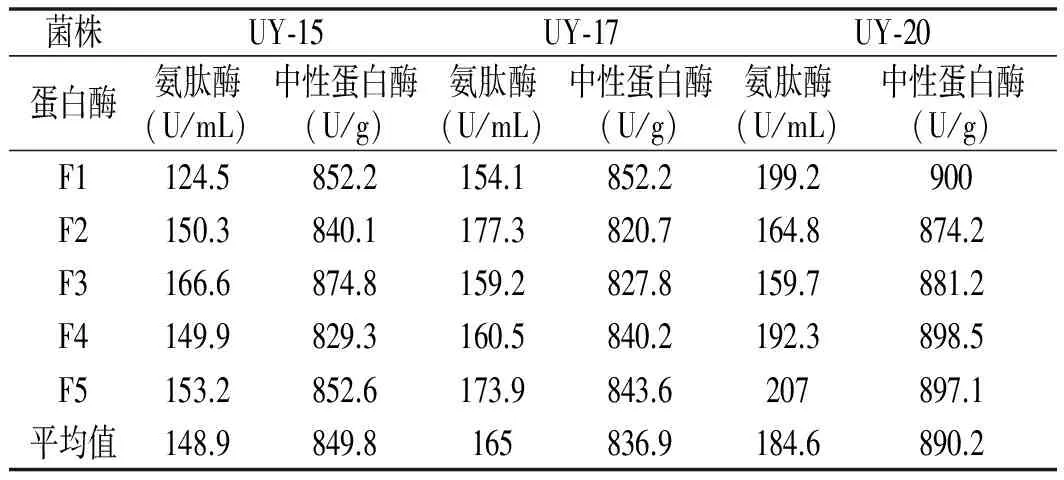
表2 突变菌株遗传稳定性实验
由表2可知,以均值作对照,氨肽酶与中性蛋白酶活性的变化范围不大,表明这3株突变株具有良好的遗传稳定性。其中,UY-15,UY-17和UY-20制曲中氨肽酶活力分别是出发菌株的1.24,1.38,1.54倍,且UY-20中性蛋白酶活力较出发菌株提高了7%。
2.2.5 3株米曲霉突变株与米曲霉CICC2066菌株的性能比较
米曲霉UY-15,UY-17和UY-20菌株与米曲霉CICC2066菌株的性能比较:由表3可知,米曲霉UY-15,UY-17,UY-20菌株的氨肽酶活性明显高于出发菌株CICC2066,且UY-20中性蛋白酶活性高于出发菌株7%,在蛋白质水解过程中可以发挥更大的优势,并且孢子数大于出发菌株。
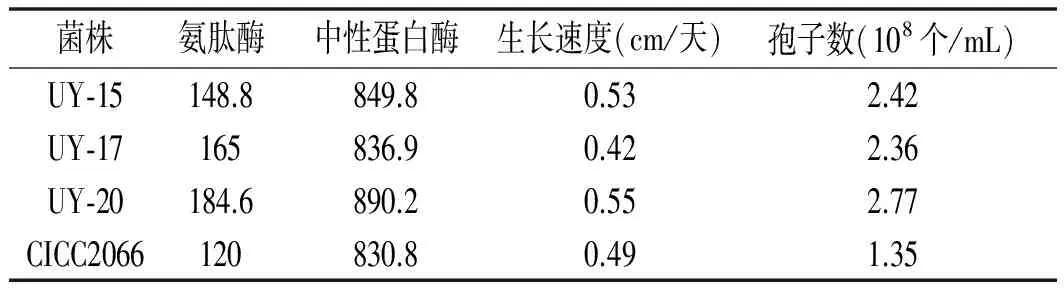
表3 突变菌株与CICC2066的性能比较
3 结论
通过对米曲霉CICC2066菌株进行紫外诱变,筛选出3株高产氨肽酶且遗传稳定的突变株UY-15,UY-17,UY-20。其中,米曲霉UY-15,UY-17和UY-20制曲42 h后其氨肽酶活力分别是出发菌株的1.24,1.38,1.54倍,且UY-20中性蛋白酶活力较出发菌株提高了7%。通过直线生长法和悬滴法,考察了原始菌株与诱变菌株生长速率和孢子量,3株诱变株孢子量较出发菌株具有较大优势。本研究用诱变育种方式提高了CICC2066菌株制曲42 h的氨肽酶活性,目前已有研究人员通过组合培养的方式来提高蛋白酶活力,结合此类研究成果,通过不同米曲霉菌株组合制曲来提高氨肽酶产量会有很大的可能性。
[1]吴庆勋.氨肽酶高产菌株的选育及发酵条件优化[D].无锡:江南大学,2006:1-5.
[2]段刚,赵振锋,钱莹.酶制剂在蛋白质加工行业的应用[J]. 食品与生物技术学报,2005,24(4):104-110.
[3]Elegans A.A.oryzae和R.oligosporus肽酶系统及其脱苦机理的比较研究[D].上海:华东理工大学,2011.
[4]Rao M B, Tanksale A M, Ghatge M S,et al. Molecular, biotechnological aspects of microbial protease[J].Microbiol Mol Biol Rev,1998,62:597-635.
[5]Barry C M, O'cuinn G. Debittering of a tryptic digest of bovine β-casein using porcine kidney general aminopeptidase and X-prolydiptptidyl aminopeptidase fromLactococcuslactissubsp.cremoris AM2[J].Journal of Food Science,2000,65(7):1145-1150.
[6]Raji Rahulan, Kiran S Dhar,K Madhavan Nampoothiri,et al.Characterization of leucine amino peptidase fromStreptomycesgedanensisand its applications for proteinhydrolysis[J].Process Biochemistry,2012,47:234-242.
[7]姚开,吕远平,何强,等.高活力酸性蛋白酶酱油菌种的选育[J].中国调味品,2002(5):16-18.
[8]韦革宏,杨祥.发酵工程[M].北京:科学出版社,2008:54.
[9]司晓光,郑博,王小霞,等.米曲霉3.042突变株高产酸性蛋白酶的发酵条件优化[J].食品科技,2014,39(9):12-17.
[10]吴冬梅, 刘琨毅,李进,等.基于物理诱变的米曲霉高产菌株的选育及应用[J].中国调味品,2014,39(6):38-42.
[11]张克旭,陈宁,张蓓,等.代谢控制发酵[M]. 北京:中国轻工业出版社,1998.
Breeding ofAspergillusoryzaeAminopeptidase-producing Strains by Ultraviolet Induced Mutation
LI Peng1, 2,ZHANG Yan-fang1,WANG Jun1,2,HAN Yu-ting1,WANG Xuan-nian1*
(1.Biotechnology Research Center,College of Life Science and Technology,Xinxiang University, Xinxiang 453003,China;2.College of Life Science,Zhengzhou University,Zhengzhou 450000,China)
One strain ofAspergillusoryzaeCICC2066 is screened by UV induced mutagenesis. With screening for several times, three mutants UY-15, UY-17 and UY-20 with higher, stable aminopeptidase activity are obtained. Compared with CICC2066 on fermentation performance, the aminopeptidase activity of mutants UY-15, UY-17 and UY-20 of culturing for 42 h is 1.24, 1.38,1.54 times that of the starting strain. The neutral protease activity of UY-20 is increased by 7% than that of the starting strain. The number of spores of three induced strains is higher than that of CICC2066.
Aspergillusoryzae; ultraviolet induced mutation; aminopeptidase
2016-07-15 *通讯作者
河南省教育厅自然科学研究项目(2011C550002)
李鹏(1988-),男,硕士,研究方向:食品与微生物发酵; 王选年(1969-),男,河南灵宝人,教授,硕士生导师,博士,研究方向:微生物学与免疫学。
TS201.25
A
10.3969/j.issn.1000-9973.2017.01.014
1000-9973(2017)01-0061-04
