儿童内生软骨瘤的影像学特征
2017-02-07孙英伟葛晓雪夏丽莹潘诗农郭启勇
孙英伟,葛晓雪,夏丽莹,潘诗农,郭启勇
(1.辽宁中医药大学附属医院医学影像中心,辽宁沈阳110032;2.中国医科大学附属盛京医院放射科,辽宁沈阳110004)
临床报道
儿童内生软骨瘤的影像学特征
孙英伟1,葛晓雪2,夏丽莹1,潘诗农2,郭启勇2
(1.辽宁中医药大学附属医院医学影像中心,辽宁沈阳110032;2.中国医科大学附属盛京医院放射科,辽宁沈阳110004)
目的探讨儿童内生软骨瘤的影像学特征。方法选取2008~2015年26例诊断为内生软骨瘤患儿的影像学资料,影像学分析主要包括:病变的分布、边缘、基质内钙化、骨内膜扇贝样压迹、骨膜反应、磁共振信号特征及骨髓、软组织水肿情况等。结果男性12例,女性14例。年龄2~18岁,平均14.2岁。病变单发18例,多发8例。26例共51个病灶,其中手指骨病灶占41%(21/51),掌骨占25%(13/51),长骨占28%(14/51),肩胛骨、肋骨、足趾骨各1个,各占2%。平片及计算机体层摄影具有特征性诊断价值的征象有弧形、环形的软骨基质钙化约为59%(30/51),膨胀性生长致内缘形成扇贝样压迹约为75%(38/51)。磁共振成像显示,病变呈等-稍长T1长T2信号。本组患者未见骨髓及软组织水肿。结论内生软骨瘤是儿童常见的良性骨肿瘤,具有特征性影像学征象,准确诊断对后续治疗具有非常重要的作用。
内生软骨瘤;儿童;X线摄影;计算机体层摄影;磁共振成像
内生软骨瘤是一种发生于骨髓腔的良性软骨类肿瘤,是儿童第二常见的良性骨肿瘤,约占24%[1-2]。病变多始于幼年,但常因无自觉症状而于成年期发现。多发者称为内生软骨瘤病或Ollier病,合并软组织血管瘤病时,称为Maffucci综合征。由于病变好发于干骺端,累及生长板时,可导致患肢缩短、弯曲、畸形,严重影响儿童及青少年骨骼发育,且多发者的长骨病灶恶变率≥20%[3-4]。因此及时正确的诊断、治疗对预后至关重要。笔者选取并分析经手术及组织病理学诊断的26例儿童内生软骨瘤临床、影像及病理资料,旨在提高对该病的认识。
1 资料与方法
选取2008年1月-2015年12月本院26例经组织病理学诊断的内生软骨瘤的临床及影像学资料。其中,男性12例,女性14例;年龄2~18岁,平均14.2岁。年龄<10岁患儿12例,≥10岁患儿14例。共51个病灶,其中手指骨病灶占41%(21/51),掌骨占25%(13/51),长骨占28%(14/51),肩胛骨、肋骨及足趾骨各占2%(1/51)。临床表现无特征。部分患肢出现短缩、弯曲、畸形,多为长骨病变。10例出现病理性骨折,均为短管状骨病变。
应用美国KODAK公司DR7500型X光机行正、侧/斜位片。应用德国Siemens公司及荷兰Philips公司多层螺旋CT扫描仪行轴位CT扫描,并行冠状位、矢状位重建。扫描参数:120 kV,200 mA,层厚1 mm。采用美国GE公司或荷兰Philips公司3.0 T超导磁共振成像(magnetic resonance imaging,MRI)仪行常规SE、FSE序列轴位、矢状位、冠状位T1加权像(T1weighted imaging,T1WI)、T2加权像(T2weighted imaging,T2WI)、T2WI脂肪抑制序列。采集参数:层厚3.5~5.0 mm,视野300~400 mm,矩阵512×512。
由3位阅片者分别对病变的部位、边界、形态、密度、信号、周围软组织改变等影像特征进行分析并达成共识。
2 结果
26例行病变部位X线检查,其中20例行CT检查,2例行磁共振检查。共发现51个病灶。18例单发病灶,8例多发病灶。
2.1 病灶的分布
按照受累部位进行统计,手指骨病灶21个(其中近节指骨病灶17个,中节指骨4个),掌骨13个(均位于骨干),长骨14个(股骨5个,肱骨3个,胫骨2个,桡骨2个,尺骨1个,腓骨1个。9个位于干骺端,5个同时累及干骺端及骨干,4个累及骨骺),肩胛骨、肋骨、足趾骨各1个。
2.2 X线及CT主要表现
短管状骨病灶表现为髓腔内边界清晰的透亮区6个。透亮区内磨玻璃样、斑片状、絮状高密度、斑点状、颗粒状钙化者17个。病灶边界清楚,多呈分叶状外观。边缘可见硬化环16个。病灶呈不同程度的膨胀性骨质破坏,骨皮质变薄,骨内膜可见扇形、弧形压迹24个。其中,10例出现病理性骨折,仅2例可见骨膜反应。长管状骨病灶范围较大,呈地图状。病变多位于干骺端和骨干,位于干骺端者同时累及骨骺病变4例。骨质破坏区见典型的软骨基质点环状钙化者13个,周围可见硬化缘,多数可见患肢畸形。见图1~4。

图1 16岁男性患者右手中指近节指骨内生软骨瘤

图2 9岁男性患者右手第2掌骨、食指近、中节指骨及中指近、中节指骨多发内生软骨瘤
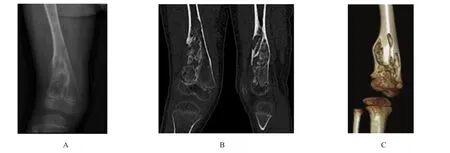
图3 4岁男性患者右侧股骨远端内生软骨瘤
2.3 MRI主要表现
MRI表现为T1WI低或等信号,T2WI高信号,类似透明软骨的信号。病变内钙化基质呈T1WI和T2WI低信号。见图5。

图4 12岁女性患者左侧肱骨上端、肩胛骨肩峰内生软骨瘤
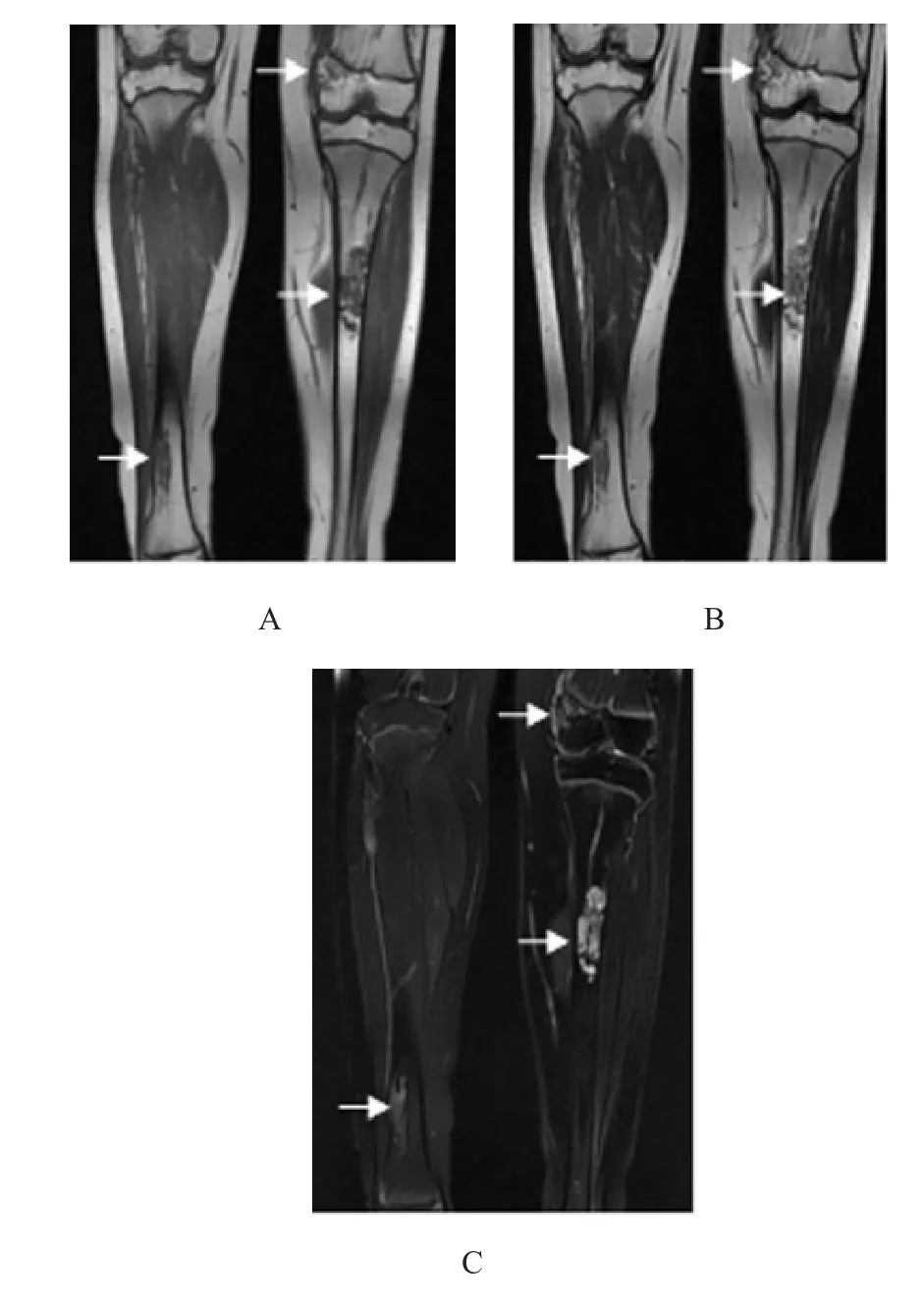
图5 9岁女性患者双侧胫骨、左侧股骨下端骨骺多发内生软骨瘤
3 讨论
内生软骨瘤在各个年龄段均可见,其中约25%发生于儿童,最常见于十几岁儿童,是手部短管状骨最常见的肿瘤。DOUIS等[5]推测内生软骨瘤是胚胎期静息的软骨细胞在骨骼发育过程中,由骨骺板异位至干骺端衍变而成,但该假说尚未得到证实。最近的细胞遗传学研究表明,内生软骨瘤的发生与异柠檬酸脱氢酶1和异柠檬酸脱氢酶2的缺失、移位等染色体畸变相关[6]。
40%~64%的内生软骨瘤位于手部掌指骨,其中40%~50%位于近节指骨,15%~30%位于掌骨,20%~30%位于中节指骨。其中小指最多见,拇指最少见。25%的内生软骨瘤位于长骨,最好发于股骨,其次为肱骨和胫骨。其中长骨干骺端最常见,推测可能与内生软骨瘤源自骺板有关,也见于骨干,但骨骺最少见。7%的内生软骨瘤位于足趾骨,大多数发生于近节趾骨,70%合并病理性骨折。扁骨,如脊椎、髂骨、坐骨、肩胛骨、肋骨少见[3,5]。
组织学上内生软骨瘤以形成大量成熟的透明软骨为特征,外有纤维包膜,小叶间隙的血管附近和肥大软骨层的基质内有不同程度的钙化,偶见液化坏死及囊变。因此骨髓腔内囊状破坏区内沙粒状、点环状钙化是其特征,是具有诊断意义的特征性影像学征象,约95%的患者可显示不同程度的肿瘤基质钙化[5]。由于软骨呈分叶状生长,骨皮质内侧缘(骨内膜)的扇贝样边缘也可提示本病。多数病变X线及CT足以作出正确诊断。MRI的作用主要在于评价病灶范围、骨髓水肿、周围软组织肿胀情况。病变呈T1WI低或中等信号,T2WI高信号,类似软骨信号。T1WI局部高信号代表被肿瘤包裹的正常骨髓脂肪组织。肿瘤基质的钙化及间隔均为T2WI低信号。注入对比剂可见环形或弧形强化,代表无血供的透明软骨小叶周围的纤维血管组织[7]。
对放射科医师来说,最困难的是鉴别内生软骨瘤与低度恶性软骨肉瘤,两者鉴别的判断标准不仅一直存在争议,而且两者在影像学上根本无法区分。笔者总结相关文献,从以下几个方面阐述两者的鉴别要点:①临床特征。95%的软骨肉瘤临床上有疼痛症状。CRIM等[8]认为,局部疼痛是软骨肉瘤区别于内生软骨瘤的一个可靠的观察指标。内生软骨瘤多无明显临床症状,合并病理性骨折可出现疼痛,但病理性骨折多发生在短管状骨,而短管状骨很少发生软骨肉瘤;②发病部位。内生软骨瘤好发于手足骨,而软骨肉瘤很少发生于此。软骨肉瘤好发于骨盆,而内生软骨瘤很少发生于此。因此发生于长骨者才是鉴别的难点。两者均好发于股骨。内生软骨瘤好发于远端,软骨肉瘤好发于近端[5];③肿瘤大小。软骨肉瘤往往比内生软骨瘤大(8 cm vs 5 cm)。内生软骨瘤最大径通常≤6 cm[5,7];④肿瘤特征。由于软骨呈分叶状生长,两者都可在骨皮质内侧面(骨内膜)形成扇贝样边缘。软骨肉瘤在骨内膜的扇贝形压迹的深度和范围比内生软骨瘤更大,90%的患者原发骨皮质厚度的2/3。但BUI等[9]认为,压迹的程度取决于肿瘤所在的位置,而非良、恶性的判断标准。笔者发现,起源于骨内膜的内生软骨瘤往往呈偏心性生长,100%出现皮质扇贝形压迹,72%患者的深度超过骨皮质厚度的2/3,甚至突破骨皮质向外延伸;⑤瘤周异常信号。通常软骨肉瘤的含水量比内生软骨瘤高,瘤旁水肿范围往往比内生软骨瘤大。其含水量越高代表组织学恶性程度越高。JANZEN等[10]发现,存在骨髓异常水肿信号的软骨肉瘤往往同时出现软组织水肿,可能是由于骨髓水肿通过骨皮质和骨膜进入邻近软组织所致。因此瘤周骨髓、邻近软组织出现异常信号往往提示软骨肉瘤可能;⑥其他检查技术的应用。99mTc-亚甲基二磷酸盐骨闪烁成像中,内生软骨瘤呈轻、中度放射性摄取增高,低于或等于髂前上嵴的吸收程度。而软骨肉瘤放射性浓聚超过髂前上嵴[5]。18F-脱氧葡萄糖正电子发射计算机断层显像显示两者活性均增高。但最大标准摄取值在2.0~2.2时能够对两者进行有效鉴别[11]。磁共振动态增强扫描中软骨肉瘤强化速率快[12]。而磁共振弥散加权成像定量技术尚不能鉴别内生软骨瘤与低级别软骨肉瘤[13]。
内生软骨瘤另一个主要的鉴别诊断是骨梗死。内生软骨瘤分叶状骨皮质内缘,肿瘤基质内的点状、环形、弧形钙化具有特征性,骨梗死无明显硬化缘。
总之,内生软骨瘤是儿童常见的良性骨肿瘤,具有特征性影像学征象,准确诊断对后续治疗具有非常重要的作用。
[1]WOOTTON-GORGES S L.MR imaging of primary bone tumors and tumor-like conditions in children[J].Magn Reson Imaging Clin N Am,2009,17(3):469-487.
[2]BIERRY G,KERR D A,NIELSEN G P,et al.Enchondromas in children:imaging appearance with pathological correlation[J]. Skeletal Radiol,2012,41(10):1223-1229.
[3]CHUN K A,STEPHANIE S,CHOI J Y,et al.Enchondroma of the foot[J].J Foot Ankle Surg,2015,54(5):836-839.
[4]刘兰,唐雪梅.多发性内生软骨瘤研究进展[J].中华小儿外科杂志, 2012,33(5):386-388.
[5]DOUIS H,SAIFUDDIN A.The imaging of cartilaginous bone tumours I.benign lesions[J].Skeletal Radiol,2012,41(10):1195-1212.
[6]SAKAI JUNIOR N,ABE KT,FORMIGLI LM,et al.Cytogenetic findings in 14 benign cartilaginous neoplasms[J].Cancer Genet, 2011,204(4):180-186.
[7]MURPHEY MD,FLEMMING D J,BOYEA S R,et al.Enchondroma versus chondrosarcoma in the appendicular skeleton:differentiating features[J].Radiographics,1998,18(5):1213-1237.
[8]CRIM J,SCHMIDT R,LAYFIELD L,et al.Can imaging criteria distinguish enchondroma from grade 1 chondrosarcoma[J].Eur J Radiol,2015,84(11):2222-2230.
[9]BUI K L,ILASLAN H,BAUER T W,et al.Cortical scalloping and cortical penetration by small eccentric chondroid lesions in the long tubular bones:not a sign of malignancy[J].Skeletal Radiol,2009,38(8):791-796.
[10]JANZENL,LOGANP M,O'CONNELLJ X,et al.Intramedullary chondroid tumors of bone:correlation of abnormal peritumoral marrow and soft tissue MRI signal with tumor type[J]. Skeletal Radiol,1997,26(2):100-106.
[11]JESUS-GARCIA R,OSAWA A,FILIPPI R Z,et al.Is PET-CT an accurate method for the differential diagnosis between chondroma and chondrosarcoma[J].Springerplus,2016,29(5):236.
[12]MOSIER S M,PATEL T,STRENGE K,et al.Chondrosarcoma in childhood:the radiologic and clinical conundrum[J].J Radiol Case Rep,2012,6(12):32-42.
[13]DOUIS H,JEYS L,GRIMER R,et al.Is there a role for diffusion-weighted MRI(DWI)in the diagnosis of central cartilage tumors[J].Skeletal Radiol,2015,44(7):963-969.
(童颖丹 编辑)
R445
B
10.3969/j.issn.1005-8982.2017.01.028
1005-8982(2017)01-0133-04
2016-05-19
孙英伟,E-mail:sunyingwei012010@126.com
