Obestatin在心肌梗死后心力衰竭大鼠循环和肾脏的表达及其生物学意义*
2017-02-07沈明郭志福鲍礼智李然郑兴
沈明,郭志福,鲍礼智,李然,郑兴
(第二军医大学长海医院心内科,上海200433)
论著
Obestatin在心肌梗死后心力衰竭大鼠循环和肾脏的表达及其生物学意义*
沈明,郭志福,鲍礼智,李然,郑兴
(第二军医大学长海医院心内科,上海200433)
目的探究obestatin在心肌梗死后心力衰竭(以下简称心衰)大鼠循环和肾脏组织中的表达及其可能的生物学意义。方法以冠状动脉结扎法复制大鼠心肌梗死后心衰模型,酶联免疫吸附法检测大鼠血浆obestatin浓度,免疫组织化学法检测obestatin在肾脏组织的表达并分析累积光密度值,比较不同组的差异,Western blot检测不同组肾脏组织表达obestatin水平,并进行半定量分析。结果心衰组大鼠循环血浆内obestatin浓度较正常组及假手术组增高(P<0.05),免疫组织化学法显示,obestatin在大鼠肾脏肾小管和集合管表达,心衰组大鼠肾脏组织obestatin表达较正常组和假手术组升高(P<0.05)。结论Obestatin在心力衰竭大鼠循环和肾脏表达增高,可能以内分泌及自分泌或旁分泌形式参与心衰水潴留的发生、发展。
obestatin;心力衰竭;水平衡
Obestatin是由23个氨基酸残基组成的多肽类激素[1],主要在胃肠道组织表达,具有多种功能。脑室内给予obestatin注射可以抑制口渴,减少饮水并呈剂量依赖性降低精氨加压素(Argininevasopressin,AVP)的释放[2-3],揭示obestatin对机体水平衡具有调节作用。同时有研究表明,obestatin不能通过血脑屏障进入中枢[4],因而obestatin在外周对于机体水平衡的作用值得进一步研究。前期研究发现,心力衰竭(以下简称心衰)患者循环中obestatin水平较心功能正常者明显升高[5],而水潴留是心衰发生、发展的重要机制[6]。本实验以SD大鼠为研究对象,进一步证实obestatin在心肌梗死(以下简称心梗)后心衰大鼠循环中的表达,并探究其在心衰水潴留发展中发挥的作用。
1 材料与方法
1.1 材料与试剂
无特定病原体级雄性SD大鼠20只,体重180~200 g左右,购自上海第二军医大学实验动中心(第二军医大学实验动物中心代养)。实验期间,动物房室温保持22℃左右,相对湿度70%左右,08∶00~20∶00自动照明,自由进食和饮水。
Obestatin酶联免疫吸附(enzyme-linked immunosorbent assays,ELISA)试剂盒(上海西塘生物公司),抗兔/鼠通用型免疫组织化学法试剂盒(丹麦Dako公司),RIPA裂解液、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自上海碧云天生物公司,LDS sample buffer(芬兰Thermo公司),obestatin抗体(美国Abcam公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(上海西塘生物公司),荧光标记的驴抗兔二抗(美国LI-COR公司)。
1.2 仪器与设备
小动物呼吸机(上海奥尔科特生物科技有限公司),心电图机(上海光电医用电子仪器有限公司),Vevo 707超声仪(加拿大Visualsonics公司),酶标仪(芬兰Thermo公司),台式离心机(上海安亭科学仪器厂),石蜡切片机(上海徕卡仪器有限公司),烘箱(上海福玛实验设备有限公司),普通光学显微镜(重庆光电仪器有限公司),Odyssey红外荧光扫描成像系统(美国LI-COR公司)。
1.3 方法
1.3.1 实验分组及心衰模型复制与筛选实验分为正常组、假手术组及心衰组3组,利用Excel表格随机数生成法抽取5例为正常组,5例为假手术组,剩余大鼠用于心衰模型复制。
参照既往相关文献[7],采用冠状动脉结扎法复制大鼠心梗后心衰模型:以10%水合氯醛(0.3 ml/ 100 g)腹腔注射麻醉大鼠后固定在木板上,用24号笔型静脉留置针套管行气管插管,连接小动物呼吸机和心电图机(潮气量7~8 ml,呼吸频率80次/min,吸呼比1∶2)。选取左前胸第三或第四肋间水平切口,逐层暴露心脏,在右心室流出道与左心房之间,距主动脉根部2~3 mm处用6号丝线穿过左冠状动脉主干,连同小束心肌一起结扎,可见缝线下方心肌颜色变浅、苍白。同时心电图可记录到R波升高及ST段抬高为结扎成功。随后挤压胸腔排气,逐层关闭胸腔。假手术组采用同样步骤,但仅将丝线绕过左冠状动脉,不结扎。正常组及所有手术大鼠术后常规饲养,定期称重。术后8周对大鼠心脏进行超声检查,采用射血分数(ejection fraction,EF)值≤45%作为心衰的评定标准[7-8]。共手术15例,其中假手术组5例全部存活;心梗手术10例,术中及术后1周内死亡3例,EF值>45%排除1例,共获得心衰大鼠6例作为心衰组。
1.3.2 大鼠尿液收集将待测大鼠分别放入代谢笼内,禁食。将装有100 ml饮用水的水瓶放入饮水孔,集尿口下接集尿袋,环境温度控制在25℃左右,适应3 d后,收集24 h尿液并测量水瓶剩余水量,计算大鼠饮水量。分别收集术前及模型筛选完毕后各组大鼠24 h尿液及饮水量。
1.3.3 ELISA法检测大鼠血浆obestatin的表达采用内眦取血方法,大鼠麻醉后,左手拇指及食指抓住两耳之间的皮肤,使其固定,并轻轻压迫颈部两侧,阻碍静脉回流,使眼球充分外突,提示眼眶后静脉丛冲血。右手持毛细玻璃管,将尖端插入内眼角与眼球之间,轻轻向眼底方向刺入,当感到有阻力时即停止刺入,旋转玻璃管以切开静脉丛,血液即流出,将血液流入含乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)的紫色真空采血管内,4℃、3 000 r/min离心取上清待测。分别收集术前及模型筛选完毕后各组大鼠血浆待测。按试剂盒说明书检测血浆内obestatin含量。
1.3.4 免疫组织化学法和Western blot检测肾脏obestatin表达所有大鼠术后8周模型筛选完毕取血尿样本后即行处死,立即剖开大鼠腹腔取大鼠2个肾脏,用预冷的生理盐水充分冲洗后分别用于免疫组织化学法和Western blot检测。
新鲜肾脏固定于4%多聚甲醛>24 h,常规石蜡包埋切片,片厚4μm。65℃烘箱中烘片2 h,脱蜡至水,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次,5 min/次;置于EDTA缓冲液中微波修复,中火至沸后断电,间隔10 min低火至沸,自然冷却后PBS洗3次,5 min/次;随后放入3%过氧化氢溶液,室温下孵育10 min,以阻断内源性过氧化物酶;PBS洗3次,5 min/次,甩干后5%牛血清白蛋白(albumin from bovine serum,BSA)封闭20 min;去除BSA液,滴加obestatin抗体(1∶200),4℃过夜后PBS洗3次,5 min/次;滴加二抗(试剂盒A液),4℃孵育50 min,PBS洗3次,5 min/次;滴加100μl新鲜配制3,3'-二氨基联苯胺(3,3'-Diaminobenzidine,DAB)溶液,显微镜控制显色。显色完全后,蒸馏水冲洗,苏木素复染,脱水透明,中性树胶封固。显微镜观察,拍照。各组内每张切片随机挑选3个200倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出其阳性的累积光密度(integral optical density,IOD)值,以IOD值反应obestatin在组织表达水平。
将新鲜肾脏组织剪成细小碎片,滤纸吸干水分称重,按每20 mg组织加入200μl RIPA裂解液裂解组织提取总蛋白,BCA法测定蛋白浓度,配置12%的分离胶(GAPDH用)、15%的分离胶(obestatin用)及5%的浓缩胶,调整蛋白浓度30μg/孔加样,经十二烷基硫酸钠聚丙烯酰氨凝胶电泳分离蛋白(80 V恒压电泳20 min至分离胶,110 V恒压电泳至底),电泳结束后转膜300 mA恒流GAPDH(60 min),obestatin(25 min),5%牛奶室温封闭2 h,三羟甲基氨基甲烷缓冲盐水(triethanolamine buffered saline solution, TBST)洗膜10 min/次,共3次,加一抗obestatin(1∶1 000)、GAPDH(1∶20 000),4℃孵育过夜,TBST洗膜10 min/次,共3次,加荧光标记的驴抗兔二抗(1∶10 000),室温孵育1 h,TBST洗膜10 min/次,共3次。以Odyssey Infrared Imaging System扫膜,使用Quantity one软件分别测定obestatin条带及GAPDH条带的密度值,并以obestatin/GAPDH比值表示蛋白表达水平。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(x±s)表示,用单因素方差分析,若方差齐,则组间多重比较用最小显著差异LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠饲养8周后出入量及心脏超声检查结果
经单因素方差分析,3组大鼠出入量平衡比较,差异有统计学意义(F=29.215,P=0.000),经LSD-t检验,心衰组与正常组及假手术组比较,差异有统计学意义(t=5.950和6.979,P=0.000),心衰组较正常组及假手术组水潴留增多。假手术组与正常组比较,差异无统计学意义(t=-0.985,P=0.343)。见附表。
2.2 大鼠循环血浆内obestatin ELISA检测结果
ELISA结果显示,正常组、假手术组及心衰组大鼠血浆obestatin浓度分别为(1 700.862±146.867)、(1 713.007±128.377)和(1 923.331±145.243)pg/ml,经方差分析,组间差异有统计学意义(F=4.439,P= 0.034),经LSD-t检验,心衰组与正常组及假手术组比较,差异有统计学意义(t=2.610和2.467,P=0.022和0.028),心衰组大鼠循环血浆内obestatin含量高于正常组及假手术组。假手术组与正常组比较,差异无统计学意义(t=0.136,P=0.894)。见图1。
2.3 Obestatin在大鼠肾脏的表达
附表大鼠出入量平衡及心功能改变(±s)
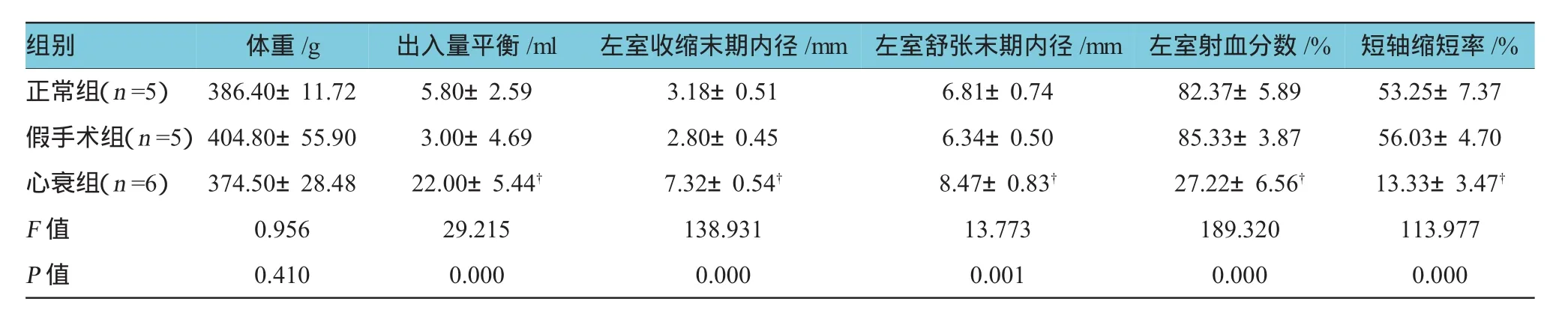
附表大鼠出入量平衡及心功能改变(±s)
注:出入量平衡=入量-出量,†与正常组比较,P<0.05
组别短轴缩短率/%正常组(n=5)386.40±11.725.80±2.593.18±0.516.81±0.7482.37±5.8953.25±7.37假手术组(n=5)404.80±55.903.00±4.692.80±0.456.34±0.5085.33±3.8756.03±4.70心衰组(n=6)374.50±28.4822.00±5.44†7.32±0.54†8.47±0.83†27.22±6.56†13.33±3.47†F值0.95629.215138.93113.773189.320113.977 P值0.4100.0000.0000.0010.0000.000 体重/g 出入量平衡/ml 左室收缩末期内径/mm 左室舒张末期内径/mm 左室射血分数/%
采用DAB染色,并行核复染,阳性结果为棕黄色颗粒,结果显示,obestatin在肾小管与集合管丰富表达。统计分析各组阳性IOD值,正常组、假手术组、心衰组分别为(32386.546±5862.752)、(31322.416± 4 911.751)和(42 675.848±7 640.683),经方差分析,差异有统计学意义(F=5.463,P=0.019),经LSD-t检验,心衰组与正常组及假手术组比较,差异有统计学意义(t=2.672和2.948,P=0.019和0.011),obestatin在心衰组的表达较正常组及假手术组增高。假手术组与正常组比较,经LSD-t检验,差异无统计学意义(t= -0.265,P=0.796)。见图2。
各组大鼠肾脏组织提取总蛋白后,Western blot检测obestatin蛋白表达相对水平,结果显示,正常组、假手术组、心衰组相对表达水平分别为(0.542± 0.055)、(0.506±0.043)和(0.812±0.070),经方差分析,心衰组与正常组及假手术组比较,差异有统计学意义(F=46.190,P=0.000),经LSD-t检验,心衰组与正常组及假手术组比较,差异有统计学意义(t=7.641和8.666,P=0.000),心衰组大鼠肾脏obestatin表达高于正常组及假手术组。假手术组与正常组比较,差异无统计学意义(t=-0.982,P=0.344)。见图3。

图13 组大鼠血浆obestatin浓度比较(x±s)

图2 Obestatin在不同组大鼠肾脏组织的表达(免疫组织化学×200)
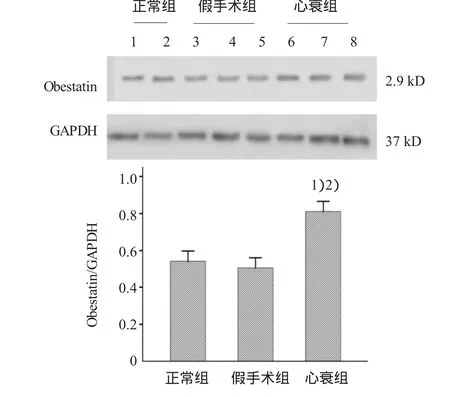
图3 Western blot检测各组大鼠肾脏组织的obestatin表达(x±s)
3 讨论
心力衰竭时,肾脏集合管水通道蛋白2(Aquaporin 2,AQP2)在集合管管腔侧质膜分布及合成上调,进而增加水的重吸收,是心衰水潴留最重要的病理生理机制之一[9-10]。AQP2也被称为AVP依赖性蛋白,心衰时AVP合成和分泌增加,同时其V2受体敏感性增加,进而上调AQP2合成与分布,增加水潴留[11];近年来多项研究显示,除AVP外,尚有其他因素参与AQP2的调控,例如血管紧张素Ⅱ、高渗状态及降钙素等通过不同的机制参与AQP2的合成及分布,进而调控肾脏对水的重吸收[12-14]。
Ghrelin/obestatin是近年来进入心血管研究领域的新的因子。斯坦福大学博士ZHANG等[1]于2005年推测并证实ghrelin的前体原除可产生ghrelin外,还可以产生另一种多肽,命名为obestatin,由23个氨基酸残基组成,经酰胺化修饰后成为生物活性形式,在机体食欲和体重调节中与ghrelin功能完全相反。近年来研究发现,obestatin除参与调节机体的物质和能量代谢外,其在心血管系统亦发挥作用[15-16]。既往研究显示,脑室内注射obestatin可抑制饮水并且可抑制脱水导致的AVP释放[2-3],提示obestatin是机体水、电解质平衡的重要调控因子。Obestatin在肾脏可以引发基因表达的早反应,同时可以激活人胚肾细胞表面G蛋白偶联受体GPR39信号通路,提示GPR39为obestatin的受体[17]。
本研究结果显示,慢性心衰大鼠循环中obestatin表达增高,这与在人类心衰患者循环中发现obestatin增高一致[5,18],提示循环中obestatin紊乱参与心衰的发生、发展。结合GPR39在肾脏表达及obestatin不能通过血脑屏障影响中枢调节机体水平衡,推测循环中obestatin以内分泌形式作用于肾脏,参与机体水平衡的调控。同时免疫组织化学法结果证实,obestatin在肾脏的肾小管和集合管表达,并通过分析光密度值及Western blot检测半定量证实心衰大鼠肾脏obestatin表达升高,提示obestatin除内分泌外,尚可能通过旁分泌及自分泌的方式参与肾脏对机体水平衡的调控,进而调控心衰的水潴留。
综上所述,心梗后心衰大鼠循环及肾脏表达obestatin增多,通过肾脏调节机体水平衡参与心衰水潴留的发生、发展。结合肾脏AQP2的调控,可以提出如下设想:obestatin通过调节肾脏水通道蛋白2的合成及其在集合管管腔侧质膜的分布,进而调控机体的水平衡,参与心衰的水潴留。进一步研究可以从动物和细胞实验的整体和分子水平来验证obestatin是否参与AQP2的调控及其具体机制。
[1]ZHANG J V,REN P G,AVSIAN-KRETCHMERO,et al. Obestatin,a peptide encoded by the ghrelin gene,opposes ghre lin's effects on food intake[J].Science,2005,310(5750):996-999. [2]SAMSON W K,WHITE MM,PRICE C,et al.Obestatin acts in brain to inhibit thirst[J].Am J Physiol Regul Integr Comp Physiol,2007,292(1):R637-R643.
[3]SAMSON W K,YOSTEN G L,CHANG J K,et al.Obestatin inhibits vasopressin secretion:evidence for a physiological action in the control of fluid homeostasis[J].J Endocrinol,2008,196(3): 559-564.
[4]PAN W,TU H,KASTIN A J.Differential BBB interactions of three ingestive peptides:obestatin,ghrelin,and adiponectin[J]. Peptides,2006, 27(4):911-916.
[5]SHI J B,GUO Z F,ZHENG X,et al.Circulating obestatin is increased in patients with cardiorenal syndrome and positively correlated with vasopressin[J].Peptides,2012,38(2):377-380.
[6]ZIAEIAN B,FONAROW G C.Epidemiology and aetiology of heart failure[J].Nat Rev Cardiol,2016,13(6):368-378.
[7]ZHANG L,GAN Z K,HAN L N,et al.Protective effect of heme oxygenase-1 on Wistar rats with heart failure through the inhibi tion of inflammation and amelioration of intestinal microcirculation[J]. J Geriatr Cardiol,2015,12(4):353-365.
[8]MADIAS J E.Standard electrocardiographic and signal-averaged electrocardiographic changes in congestive heart failure[J].Congest Heart Fail,2005,11(5):266-271.
[9]FENTON R A,PEDERSEN C N,MOELLER H B.New insights into regulated aquaporin-2 function[J].Curr Opin Nephrol Hypertens,2013,22(5):551-558.
[10]AGRE P.The aquaporin water channels[J].Proc Am Thorac Soc,2006,3(1):5-13.
[11]WILSON J L,MIRANDA CA,KNEPPER MA.Vasopressin and the regulation of aquaporin-2[J].Clin Exp Nephrol,2013,17(6): 751-764.
[12]LI C,WANG W,RIVARD C J,et al.Molecular mechanisms of angiotensin Ⅱ stimulation on aquaporin-2 expression and trafficking[J].Am J Physiol Renal Physiol,2011,300(5):F1255-F1261.
[13]KORTENOEVEN ML,van DEN BRAND M,WETZELS J F,et al.Hypotonicity-induced reduction of aquaporin-2 transcription in mpkCCD cells is independent of the tonicity responsive element,vasopressin,and cAMP[J].J Biol Chem,2011,286(15): 13002-13010.
[14]BOULEY R,LU H A,NUNES P,et al.Calcitonin has a vasopressin-like effect on aquaporin-2 trafficking and urinary concentration[J].J Am Soc Nephrol,2011,22(1):59-72.
[15]WANG W M,LI S M,DU F M,et al.Ghrelin and obestatin levels in hypertensive obese patients[J].J Int Med Res,2014, 42(6):1202-1208.
[16]KU J M,ANDREWS Z B,BARSBY T,et al.Ghrelin-related peptides exert protective effects in the cerebral circulation of male mice through a nonclassical ghrelin receptor(s)[J].Endocrinology,2015,156(1):280-290.
[17]ZHANG J V,JAHR H,LUO C W,et al.Obestatin induction of early-response gene expression in gastrointestinal and adipose tissues and the mediatory role of G protein-coupled receptor, GPR39[J].Mol Endocrinol,2008,22(6):1464-1475.
[18]XIN X,REN A J,ZHENG X,et al.Disturbance of circulating ghrelin and obestatin in chronic heart failure patients especially in those with cachexia[J].Peptides,2009,30(12):2281-2285.
(童颖丹 编辑)
Expression of obestatin in circulation and kidneys of rats with heart failure after myocardial infarction and its biological significance*
Ming Shen,Zhi-fu Guo,Li-zhi Bao,Ran Li,Xing Zheng
(Department of Cardiovasology,Changhai Hospital,the Second Military Medical University,Shanghai 200433,China)
ObjectiveTo investigate the expression of obestatin in the circulation and kidneys of heart failure rats after myocardial infarction and its possible biological significance.MethodsA heart failure rat model was induced by coronary artery ligation.Enzyme-linked immunosorbent assay was used to test the plasma concentration of obestatin.Immunohistochemistry was used to detect the expression of obestatin in the rats' kidneys and integral optical density(IOD)was measured to analyze the difference among different groups. The expression level of obestatin in the kidneys was measured by Western blot and compared among different groups.ResultsThe plasma concentration of obestatin in the heart failure group was significantly higher than that in the normal group and the sham group(P<0.05).Immunohistochemistry proved that obestatin was expressed in renal tubules and collecting tubules.The level of obestatin in the kidneys of the heart failure group was significantly higher than that in the normal group and the sham group(P<0.05).ConclusionsThe expression of obestatin increases in the circulation and kidneys of rats with heart failure.Obestatin might participate in the development of water retention in heart failure by endocrine and autocrine or paracrine secretion.
obestatin;heart failure;water balance
郑兴,E-mail:zhengxing57530@163.com
R541.6
A
10.3969/j.issn.1005-8982.2017.01.002
1005-8982(2017)01-0006-05
2016-06-15
国家自然科学基金项目(No:81470517)
