内质网应激对心肌细胞FGF21及其受体表达的影响和机制研究*
2017-02-07梁平平仲琳龚磊王佳慧杨军
梁平平,仲琳,龚磊,王佳慧,杨军
(1.滨州医学院临床学院,山东烟台264003;2.青岛大学医学院附属烟台毓璜顶医院心内科,山东烟台264000;3.青岛大学医学院附属烟台毓璜顶医院生物芯片实验室,山东烟台264000;4.青岛大学医学院附属烟台毓璜顶医院中心实验室,山东烟台264000)
论著
内质网应激对心肌细胞FGF21及其受体表达的影响和机制研究*
梁平平1,仲琳2,龚磊3,王佳慧4,杨军2
(1.滨州医学院临床学院,山东烟台264003;2.青岛大学医学院附属烟台毓璜顶医院心内科,山东烟台264000;3.青岛大学医学院附属烟台毓璜顶医院生物芯片实验室,山东烟台264000;4.青岛大学医学院附属烟台毓璜顶医院中心实验室,山东烟台264000)
目的探讨内质网应激(ERS)对心肌细胞成纤维细胞生长因子21(FGF21)及其主要受体表达的影响和机制。方法在大鼠H9c2心肌细胞中加入不同浓度的衣霉素(TM)(1、5、10、20和50μmol/L)复制ERS模型,利用活细胞计数法试剂盒检测细胞存活率。Western blot检测凋亡相关蛋白(C-caspase3、GRP78、Bax、Bcl-2)和PERK-eIF2α-ATF4信号通路相关蛋白(p-PERK、p-eIF2α、ATF4),CHOP蛋白,FGF21及其主要受体(p-FGFR1和β-Klotho)的表达。结果与对照组比较,TM处理组诱导H9c2细胞发生ERS,提高促凋亡蛋白C-caspase3、GRP78、Bax的表达,减少抗凋亡蛋白Bcl-2的表达,并以浓度依赖形式降低细胞的存活率。此外,当TM浓度≤10μmol/L时,TM处理组可以部分激活PERK-eIF2α-ATF4信号通路,诱导FGF21、p-FGFR1、β-Klotho的表达;当TM浓度>10 μmol/L时,TM处理组完全激活PERK-eIF2α-ATF4信号通路,诱导CHOP的表达,而FGF21、p-FGFR1及β-Klotho表达却随TM浓度的增加而逐渐降低。结论FGF21及其主要受体的表达与ERS程度有关,轻微的ERS(TM浓度≤10 μmol/L)诱导心肌细胞FGF21及其受体的表达,而严重的ERS(TM浓度>10μmol/L)则相对降低FGF21及其受体的表达,其机制可能与PERK-eIF2α-ATF4信号通路在ERS中的调控有关。
内质网应激;成纤维细胞生长因子21;心肌细胞
成纤维细胞生长因子21(fibroblast growth factor,FGF21)作为一个新颖的内源性因子,主要参与糖脂代谢的调节[1]。FGF21在受体β-Klotho辅助下主要与活化的成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)结合,形成FGF21-FGFR1-β-Klotho复合物,激活下游信号分子[2]。近年来发现,FGF21作为心脏疾病的生物标志物,在心肌肥大、心肌缺血、动脉粥样硬化及心肌缺血/再灌注(ischemia reperfusion,I/R)损伤等心血管病理生理条件下,其分泌和表达水平明显升高[3-5]。
未折叠或错误折叠蛋白在内质网腔中大量积聚,引起细胞发生内质网应激(endoplasmic reticulum stress,ERS),从而启动未折叠蛋白反应(unfolded protein response,URP)[6],其中蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)-真核生物起始因子2(eukaryotic initiation factor 2,eIF2)α亚基-转录激活因子4(activating transcription factor 4,ATF4)信号通路的激活是细胞发生ERS的特征表现[7]。研究发现,ERS诱导的心肌细胞和内皮细胞损伤是导致心血管疾病重要的病理生理机制之一[8],然而,FGF21及其主要受体的表达是否与ERS有关,尚不清楚。本实验通过不同剂量的衣霉素(tunicamycin,TM)复制ERS模型,探索ERS对心肌细胞FGF21及其主要受体表达影响和可能的机制。
1 材料与方法
1.1 材料与试剂
大鼠H9c2心肌细胞(上海中国科学院细胞库),胎牛血清(fatal bovine serun,FBS)、达尔伯克必需基本培养基(dulbecco's minimum essential,DMEM)购自美国Gibco公司,FGF21抗体(英国Abcam公司),p-FGFR1抗体(Y654)(美国Immunoway公司),β-Klotho抗体(美国Sigma公司),FGFR1抗体、PERK抗体、p-PERK抗体、eIF2α抗体、p-eIF2α抗体、ATF4抗体、半胱氨酸天冬氨酸蛋白酶3剪切体(cleaved cysteinyl aspartate specific proteinase 3,C-caspase-3)抗体均购自美国Cell Signaling Technology公司,B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体、Bcl-2的相关X蛋白(Bcl-2 assaciated X protein,Bax)抗体均购自武汉博士德生物工程有限公司,葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)抗体、CCAAT/增强子结合蛋白同源蛋白(C/EBP homologous protein,CHOP)抗体、βactin抗体均购自美国Santa Cruz公司。本实验中除β-actin抗体抗性为小鼠抗兔,其他抗体抗性均为兔抗小鼠。二抗-羊抗兔IgG、二抗-羊抗小鼠IgG购自北京中杉金桥生物技术有限公司,二喹啉甲酸(bicinchoninic acid,BCA)试剂盒、TM、总蛋白质提取试剂盒均购自上海生工生物工程股份有限公司,活细胞计数法试剂盒(cell counting kit-8,CCK-8)试剂盒(日本Dojindo公司)。
1.2 实验方法
1.2.1 细胞培养与内质网模型的复制用含10% FBS的高糖型DMEM完全培养液培养大鼠H9c2心肌细胞,常规置于37℃、5%二氧化碳CO2细胞培养箱中。将H9c2细胞以1×106个/孔的密度接种于6孔板中,TM于二甲基亚砜(dimethyl sulfoxide,DMSO)中溶解,待细胞培养至80%融合时加入不同浓度的TM,至终浓度为1、5、10、20和50 μmol/L,继续培养24 h,以含相同浓度的DMSO(0.5%)作为对照组。
1.2.2 CCK-8检测细胞存活率H9c2细胞以7× 103个/孔的密度接种于96孔培养板中,培养至80%融合时,按1.2.1中的方法处理细胞,在各实验组中加入100 μl无血清DMEM培养基及10 μl CCK-8溶液,继续培养4 h,用酶联免疫检测仪在450 nm处检测光密度(optical density,OD)值,细胞存活率(%)=(实验组OD值-空白对照组OD值)/(对照组OD值-空白对照组OD值)×100%,每组设3孔,结果取均值,将所得比值进行统计分析。
1.2.3 Western blot检测收集各组细胞加入蛋白裂解液提取总蛋白,用BCA法测定蛋白浓度,取50 μg蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。电泳结束后切取目的蛋白,转膜,用含5%牛血清白蛋白(bovine serum albumin,BSA)室温封闭1 h,加入相应一抗(FGF21 1︰500,FGFR1 1︰500,p-FGFR1 1︰200,β-Klotho 1︰500,C-caspase3 1︰300,GRP78 1︰500,Bax 1︰200,Bcl-2 1︰200,PERK 1︰1000,p-PERK 1︰1000,eIF2α 1︰1000,p-eIF2α 1︰1 000,ATF4 1︰500,CHOP 1︰500,β-actin 1︰1 000)4℃过夜,二氢甲基胺甲烷缓冲盐溶液洗膜3次,加入对应二抗(山羊抗小鼠1︰5 000,山羊抗兔1︰5 000)孵育1 h,洗膜3次,化学发光并曝光成像,以β-actin作为对照,利用Image J软件计算条带灰度比值,实验重复≥3次,取各实验组平均值后进行统计分析。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(x±s)表示,多组间比较用单因素方差分析,在方差分析有统计学意义的基础上,用LSD-t检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 ERS诱导凋亡蛋白表达增加,促进H9c2细胞凋亡
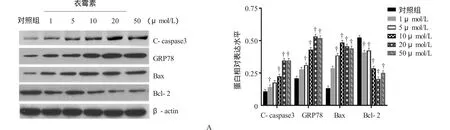
在TM诱导的ERS模型中,Western blot检测凋亡相关蛋白发现,与对照组比较,当TM浓度≤10 μmol/L时,TM处理组以浓度依赖形式诱导ERS标志蛋白C-caspase3、GRP78、Bax的表达,降低抗凋亡蛋白Bcl-2的表达(F=105.489、63.048、25.127和63.443,P=0.000);而当TM浓度>10 μmol/L时,C-caspase3、GRP78及Bax的表达水平最高并基本趋于平衡(见图1A),提示过强的ERS(TM浓度>10 μmol/L)以最大水平诱导凋亡蛋白大量合成。此外,随着TM浓度的升高,细胞存活率逐渐降低,并呈浓度依赖关系(见图1B),差异有统计学意义(F= 15.237,P=0.000),同时细胞形态也逐渐变得不规则,甚至死亡(见图1C),提示ERS通过诱导凋亡蛋白的表达,引起细胞凋亡。
2.2 ERS激活PERK-eIF2α-ATF4信号通路,诱导CHOP的表达
检测ERS特征性信号通路PERK-eIF2α-ATF4发现,与对照组比较,当TM浓度≤10 μmol/L时,p-PERK、p-eIF2α及ATF4的表达水平逐渐提高,差异有统计学意义(F=94.910、60.676和80.397;P= 0.001、0.000和0.000),提示PERK-eIF2α-ATF4信号通路部分被激活。而当TM浓度>10μmol/L时,p-PERK、p-eIF2α、ATF4表达水平最高并基本趋于平衡,提示PERK-eIF2α-ATF4信号通路被完全激活。此外,CHOP作为PERK-eIF2α-ATF4信号通路的下游分子,TM可诱导CHOP的表达(F=60.721,P= 0.000),但当TM浓度>10μmol/L时,CHOP蛋白表达水平最高并保持平衡(见图2),提示CHOP的表达量与PERK-eIF2α-ATF4信号通路激活水平有关。
2.3 ERS诱导心肌细胞FGF21及其主要受体的表达
与对照组比较,当TM浓度≤10 μmol/L时,TM处理组以浓度依赖的形式诱导FGF21、p-FGFR1及β-Klotho表达,并在TM浓度为10μmol/L时达峰值,差异有统计学意义(F=28.674、17.863和37.336,P=0.000);而在TM浓度>10μmol/L时,FGF21及其主要受体的表达却随TM终浓度的增加而逐渐减少(见图3),提示FGF21及其主要受体的表达与细胞ERS程度有关。

图1 不同浓度TM中细胞凋亡蛋白和存活率的表达变化(n=3)
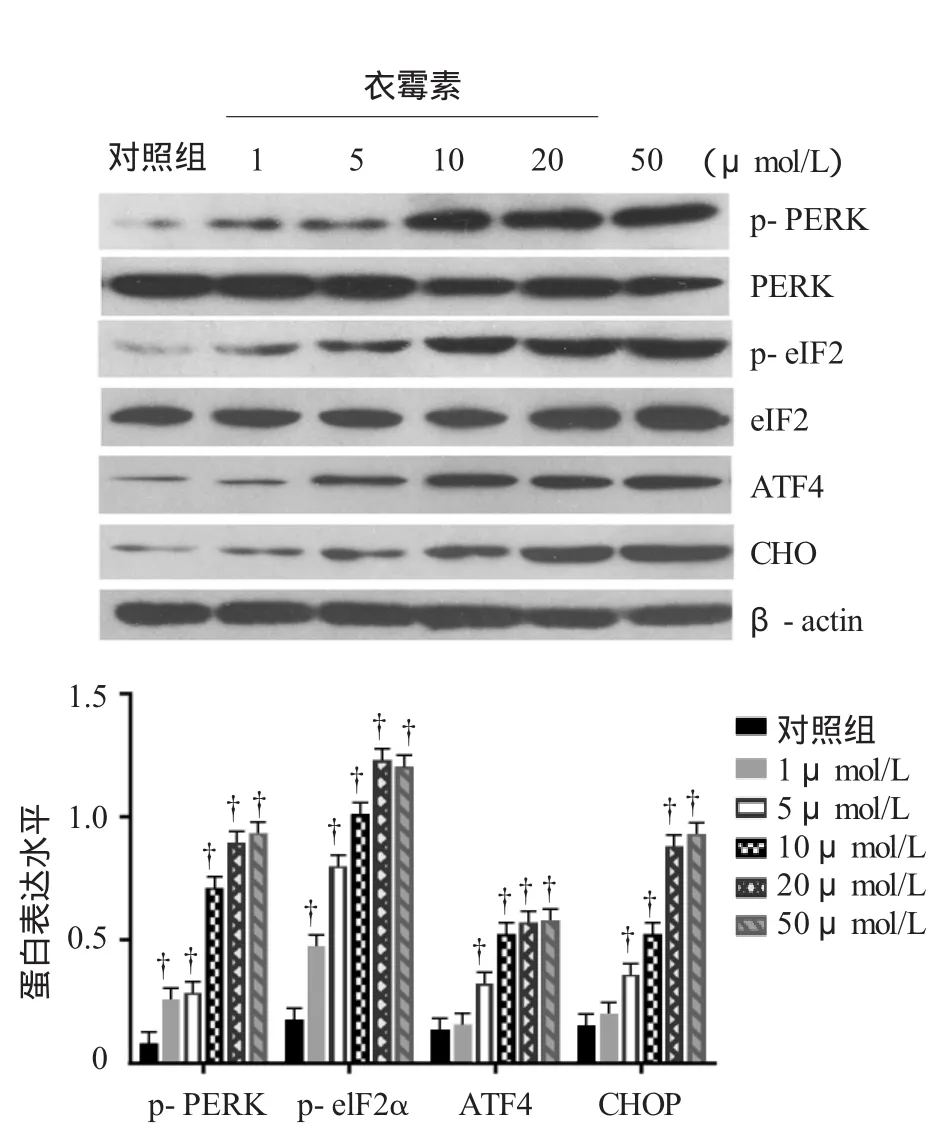
图2 不同浓度TM对PERK-eIF2α-ATF4信号通路和CHOP蛋白的影响(n=3)
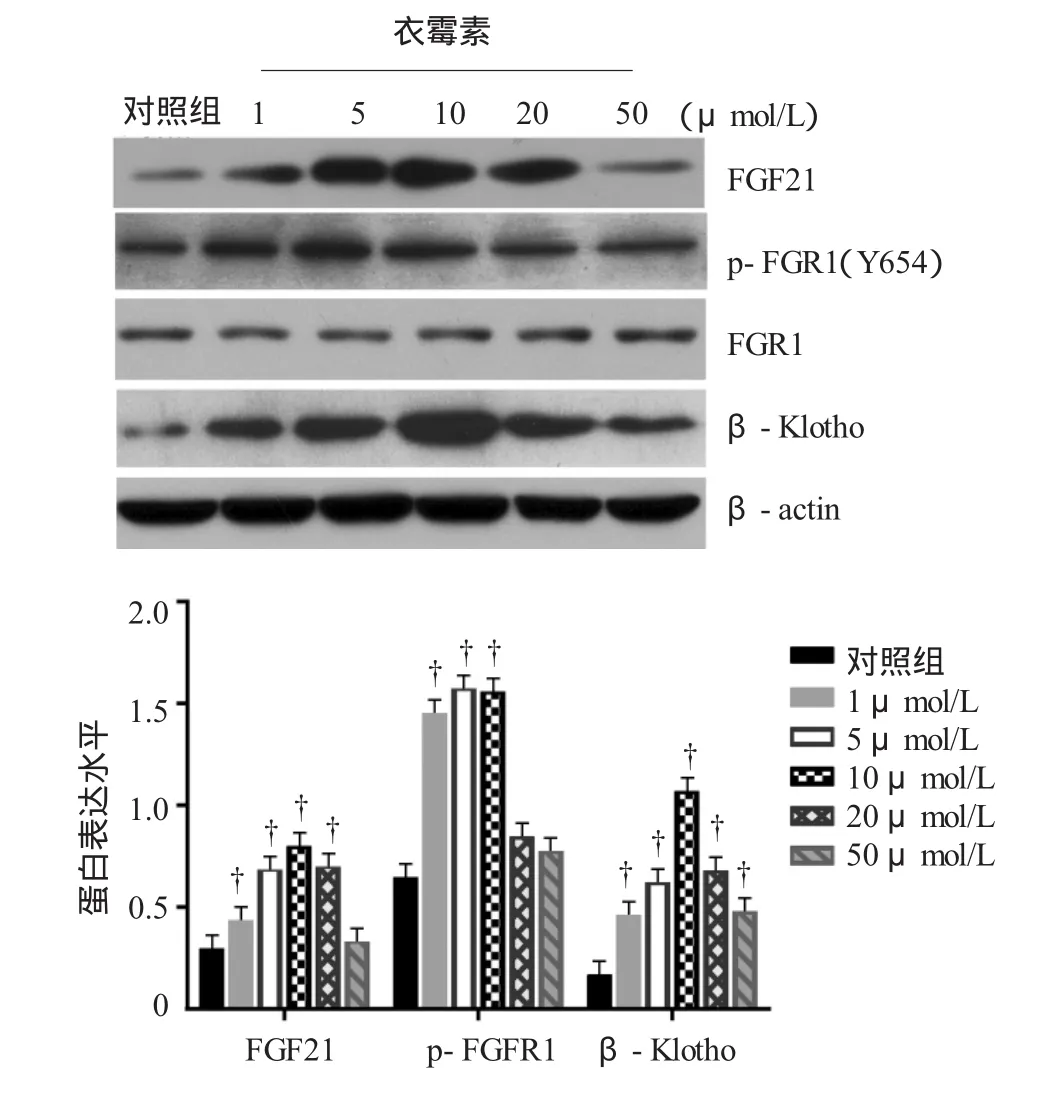
图3 不同浓度TM对FGF21及其主要受体的影响(n=3)
3 讨论
近年来发现,FGF21作为心血管保护因子,具有改善内皮细胞功能,减轻心肌缺血性损伤等功能。研究发现,当大鼠心肌缺血时,可诱导肝脏合成和分泌FGF21,通过血循环到达受损心肌,减少心肌缺血性损伤[2]。此外,氧化型低密度脂蛋白以剂量依赖形式诱导内皮细胞分泌和表达FGF21,而FGF21过表达则抑制氧化型低密度脂蛋白诱导的内皮细胞凋亡,改善内皮细胞功能[9]。因此,FGF21反应性升高可能是机体有效的代偿反应,从而减缓心血管疾病的发生、发展。
TM作为内质网Ca2+-ATP酶抑制剂,导致胞内Ca2+超载,诱导细胞发生ERS。本研究利用不同浓度的TM复制H9c2细胞ERS模型,发现TM诱导促凋亡蛋白C-caspase3、GRP78、Bax的表达,减少抗凋亡蛋白Bcl-2表达,导致细胞生存能力不断降低和细胞功能、形态的改变,提示ERS通过诱导凋亡蛋白的表达,引起细胞凋亡。然而,随着TM浓度增高(TM浓度>10 μmol/L),ERS逐渐增强,诱导C-caspase3、GRP78、Bax表达水平也达到最高,细胞存活率降低,提示在TM浓度>10 μmol/L时,细胞发生严重的ERS,从而诱导凋亡蛋白大量合成,加重细胞损伤。
在ERS早期,PERK-eIF2α-ATF4通路是URP最先启动的信号通路[7],PERK诱导eIF2α磷酸化,激活ATF4,诱导内质网分子伴侣合成,从而减少未折叠和错误折叠蛋白在内质网腔内的积累和聚集[6],这也是机体自身代偿的表现。本研究中笔者发现,当TM浓度≤10 μmol/L时,ERS诱导PERK和eIF2α发生磷酸化,以及增加ATF4的表达,从而部分激活PERK-eIFα-ATF4信号通路;而且FGF21及其主要受体p-FGFR1和β-Klotho也在ERS诱导下表达增加,并在TM浓度为10μmol/L时达高峰。研究发现,FGF21启动子区包含ATF4结合位点[10],ATF4过表达明显诱导β-Klotho的合成[11],提示ATF4可调控FGF21、β-Klotho的表达。因此,当发生轻微的ERS时(TM浓度≤10 μmol/L),心肌细胞可能经过PERK-eIF2α-ATF4信号途径代偿性诱导FGF21及其主要受体的表达,从而形成更多的FGF21/FGFR1/β-Klotho复合物,减轻ERS对心肌细胞的损伤。然而,随着TM浓度的增加(TM浓度>10 μmol/L),严重的ERS诱导p-PERK、p-eIF2α和ATF4表达水平达到最大,PERK-eIF2α-ATF4信号通路完全被激活,FGF21、p-FGFR1和β-Klotho的表达水平反而逐渐降低,而ATF4的下游信分子CHOP却经PERK-eIF2α-ATF4信号通路被大量诱导合成。研究发现,CHOP和FGF21均为ATF4的调控基因[7,10],CHOP被大量合成,竞争抑制FGF21及其主要受体的相对表达。因此,当TM浓度>10 μmol/L时FGF21及其主要受体的表达降低。此外CHOP作为ERS执行凋亡的关键蛋白[12],其介导的PERK-eIF2α-ATF4-CHOP通路成为严重的ERS诱导细胞发生凋亡的主要途径,因此,在TM浓度>10 μmol/L时,细胞存活率降低。
综上可知,轻微的ERS(TM浓度≤10 μmol/L)通过PERK-eIF2α-ATF4信号通路代偿性诱导心肌细胞FGF21及其主要受体的表达,从而减轻心肌细胞损伤;而严重的ERS(TM浓度>10 μmol/L)超过细胞自身代偿能力,显著激活PERK-eIF2α-ATF4信号通路,CHOP蛋白的大量合成,竞争抑制FGF21及其主要受体的相对表达。因此,FGF21及其主要受体的表达水平可能与不同程度ERS调控PERK-eIF2α-ATF4信号通路的传导有关,但其更进一步的信号机制还需深入研究。
[1]SEO J A,KIM N H.Fibroblast growth factor 21:a novel metabolic regulator[J].Diabetes Metab,2012,36(1):26-28.
[2]YIE J,WANG W,DENG L,et al.Understanding the physical interactions in the FGF21/FGFR/beta-Klotho complex:structural requirements and implications in FGF21 signaling[J].Chem Biol Drug Des[J],2012,79(4):398-410.
[3]LIU S Q,ROBERTS D,KHARITONENKOV A,et al.Endocrine protection of ischemic myocardium by FGF21 from the liver and adipose tissue[J].Sci Rep,2013,3:2767.
[4]CHOW W S,XU A,WOO Y C,et al.Serum fibroblast growth factor-21 levels are associated with carotid atherosclerosis independent of established cardiovascular risk factors[J].Arterioscler Thromb Vasc Biol,2013,33(10):2454-2459.
[5]PLANAVILAA,REDONDO-ANGULOI,VILLARROYAF. FGF21 and cardiac physiopathology[J].Front Endocrinol(Lausanne),2015,6:133.
[6]WALTER P,RON D.The unfolded protein response:from stress pathway to homeostatic regulation[J].Science,2011,334(6059): 1081-1086.
[7]CHEN Y J,SU J H,TSAO C Y,et al.Sinulariolide induced hepatocellular carcinoma apoptosis through activation of mitochon drial-related apoptotic and PERK/eIF2alpha/ATF4/CHOP pathway[J]. Molecules,2013,18(9):10146-10161.
[8]SOZEN E,KARADEMIR B,OZER N K.Basic mechanisms in endoplasmic reticulum stress and relation to cardiovascular diseases[J].Free Radic Biol Med,2015,78:30-41.
[9]LU Y,LIU J H,ZHANG L K,et al.Fibroblast growth factor 21 as a possible endogenous factor inhibits apoptosis in cardiac endothelial cells[J].Chin Med J(Engl),2010,123(23):3417-3421.
[10]MARUYAMA R,SHIMIZU M,LI J,et al.Fibroblast growth factor 21 induction by activating transcription factor 4 is regulated through three amino acid response elements in its promoter region[J].Biosci Biotechnol Biochem,2016,80(5):929-934.
[11]DONG K,LI H,ZHANG M,et al.Endoplasmic reticulum stress induces up-regulation of hepatic β-Klotho expression through ATF4 signaling pathway[J].Biochem Biophys Res Commun,2015,459(2):300-305.
[12]SIDHU A,MILLER J R,TRIPATHI A,et al.Borrelidin induces the unfolded protein response in oral cancer cells and chop-dependent apoptosis[J].ACS Med Chem Lett,2015,6(11): 1122-1127.
(童颖丹 编辑)
Effect of endoplasmic reticulum stress on expressions of FGF21 and its receptors in cardiomyocytes and its mechanism*
Ping-ping Liang1,Lin Zhong2,Lei Gong3,Jia-hui Wang4,Jun Yang2
(1.Clinical Medical College,Binzhou Medical University,Yantai,Shandong 264003,China; 2.Department of Cardiology,3.Biochip Laboratory,4.Central Laboratory,the Affiliated Yuhuangding Hospital of Yantai,Medical College of Qingdao University, Yantai,Shandong 264000,China)
ObjectiveTo investigate the effect of endoplasmic reticulum stress(ERS)on the expressions of fibroblast growth factor 21(FGF21)and its main receptors in cardiomyocytes and its mechanism.MethodsERS model was established by treating rat H9c2 cardiomyocytes with various concentrations of Tunicamycin (TM)(1,5,10,20 and 50 μmol/L).The cell survival rate was measured by CCK-8 assay.The expression of apoptosis-related proteins(c-caspase3,GRP78,Bax and Bcl-2),the key proteins of PERK-eIF2α-ATF4 signaling pathway(p-PERK,p-eIF2α and ATF4),CHOP as well as FGF21 and its main receptors(p-FGFR1 and β-Klotho)were measured by Western blot.ResultsCompared with the control group,TM treatment in-duced ERS in H9c2 cells,up-regulated the expression of pro-apoptosis proteins including c-caspase3,GRP78 and Bax,and reduced the level of anti-apoptosis protein Bcl-2;meanwhile it reduced cell viability rate in a dose-dependent manner.In addition,in the TM treated group the PERK-eIF2α-ATF4 signaling pathway was partly activated,which significantly induced expressions of FGF21,p-FGFR1 and β-Klotho when the concentration of TM was≤10 μmol/L.However,when the concentration of TM was>10 μmol/L,the expression of CHOP was significantly induced through fully-activated PERK-eIF2α-ATF4 signaling pathway,but the expressions of FGF21,p-FGFR1 and β-Klotho gradually decreased with the increase of ERS level.ConclusionsThe expressions of FGF21 and its main receptors correlate with the degree of ERS.Mild ERS(TM≤10 μmol/L)induces the expression of FGF21 and its main receptors in cardiomyocytes,while excessive ERS(TM>10 μmol/L)relatively reduces their expressions.The mechanism might be partly related to the regulation of PERK-eIF2α-ATF4 pathway in ERS.
endoplasmic reticulum stress;fibroblast growth factor 21;cardiomyocyte
R54
A
10.3969/j.issn.1005-8982.2017.01.001
1005-8982(2017)01-0001-05
2016-04-06
国家自然科学基金(No:81571636);山东省自然科学基金(No:ZR2015HM058)
杨军,E-mail:yangjun19640124@163.com
